联合质谱法与光谱法探讨辐照前后医用胶原蛋白海绵的三螺旋结构及变化
程红,田锐(.华中科技大学分析测试中心,武汉 430074;.华中科技大学同济医学院附属同济医院,武汉 430030)
胶原蛋白是哺乳动物体内最丰富的蛋白质,是细胞外基质中的主要结构蛋白,广泛存在于皮肤、骨骼、肌腱、韧带和其他结缔组织中,主要用于止血海绵、软组织增强注射物、细胞产品基质以及药物输送的载体。其中,胶原蛋白海绵具有吸收组织渗出物、透气性好、促进上皮细胞生长和肉芽组织生成等优良特性,可应用于止血和创面愈合。手术创伤引起不同程度的出血和渗血直接影响手术的治疗效果。手术中采用物理、机械或化学的止血方法均存在一定的局限性和不良反应,而胶原蛋白类的止血敷料则是一种有益的补充,如在胆囊切除手术、T 管引流手术、阑尾切除手术、胃大部切除手术、肝叶切除手术、胰十二指肠切除术、左半或右半结肠切除手术(切除后端-端吻合)、脾脏切除等相关手术中均能获得稳定而满意的止血效果。在大多数的手术操作中,在切除的断端或出血的局部,应用1 ~2 片胶原蛋白海绵短暂压迫即可达到止血的目的。
胶原蛋白和胶原蛋白海绵的共同特点是三螺旋结构:三条α
多肽链形成超螺旋构象,出现频率最高的氨基酸序列是-Gly-Y-Z,其中甘氨酸(Gly)代表每隔两个氨基酸就出现的重复残基,Y 和Z 是脯氨酸(Pro)和羟脯氨酸(Pro-OH)。由三条相同大小的多肽链组成的三螺旋结构是胶原的基本结构单元,其分子量约为285 kDa。使用质谱直接测定天然胶原蛋白的分子量仍然具有挑战性,电喷雾电离质谱适合分析相对分子质量在20 万以下的极性化合物,对于胶原蛋白来说,通常是在一定转变温度内,当三螺旋结构由三股胶原转变为单链时测定。使用热裂解气质联用仪(Py-GCMS)测试胶原蛋白可以通过裂解产物分析天然蛋白的分子结构,为分析蛋白质中的氨基酸组成提供了另一种思路。同时,新一代商用拉曼仪器促进了拉曼(Raman)光谱在生物科技和食品工业中的诸多应用,Raman 光谱已成为蛋白质科学的一种通用工具。圆二色(CD)光谱则可以分析胶原蛋白的三螺旋构象是否得以保留。目前,胶原蛋白海绵应用最广泛的灭菌方法是γ
-射线辐照。该方法被认为是最简单和有效的灭菌方法,不会产生有毒物质,不会破坏化学键,不会降低拉伸强度和模量,从而不会从根本上影响到被辐照的材料。但是γ
-射线辐照对于胶原蛋白三螺旋结构的影响尚不明确。本文使用Py-GCMS 对灭菌前后的胶原蛋白海绵的三螺旋结构进行测试,研究其辐照前后的结构变化,并使用Raman 光谱观察辐照对胶原蛋白海绵三螺旋结构的影响,进一步通过对其CD 光谱数据进行计算来分析判断辐照前后胶原蛋白海绵三螺旋结构的完整性是否发生改变。该工作可为胶原蛋白相关科研工作提供实验参考,并可为胶原蛋白海绵的生产企业在研究辐照灭菌的剂量和时长方面的测试提供技术支撑。1 材料
1.1 仪器
Agilent 7890A/5975C 气相色谱质谱联用仪(美国Agilent 公司,配有美国CDS 公司 Pyroprobe 6150型热裂解仪);HR-800 型激光共焦Raman 光谱仪(Horiba Jobin Yvon 公司);J-810 型圆二色光谱仪(日本Jasco 公司)。
所有试剂均为分析纯;实验用水为超纯水(电阻率为18 MΩ·cm)。
1.2 样品
未辐照胶原蛋白海绵:由武汉某生物材料有限公司提供,经由采用酸酶联合法提取自牛跟腱的胶原蛋白原液(批号为YF19070001)冷冻干燥得到,使用前未做任何处理。辐照后胶原蛋白海绵:由同一生物材料有限公司提供,系同批号的未辐照胶原蛋白海绵经过γ
-射线辐照后的样品。2 方法与结果
2.1 Py-GCMS
热裂解参数:热裂解温度500℃;裂解时间6 s;阀温325℃;传输线温度350℃。色谱条件:色谱柱HP-5ms 弹性石英毛细管柱(30 m×0.25 mm×0.25 μm,美国Agilent 公司);载气高纯氦;柱流速1 mL·min;采用分流进样,分流比20∶1;进样口温度280℃;柱温40℃保持1 min,6℃·min升至300 ℃,保持10 min。
质谱条件:离子源EI;离子源温度230℃;四极杆温度150℃;质量扫描范围30 ~600m/z
。准确称取辐照前后的胶原蛋白海绵各1 mg,分别填入石英管,经热裂解后进行GC-MS 全扫描分析,得到的总离子流图见图1。辐照前后的总离子流图使用相同的积分参数进行处理,经NIST14 谱库检索得到谱峰对应的化合物,选取匹配度大于60%的产物列于表1,采用峰面积归一化法计算面积百分比含量。表1 中产物主要分为乙腈类、吡咯环及衍生物类、酰胺类、芳烃和烷烃几种,其中含吡咯环化合物占总裂解产物的比例分别为28%和23%,较好地说明了胶原蛋白海绵的结构组成。表1 辐照前后胶原蛋白海绵裂解产物
Tab 1 Collagen sponge pyrolysis products before and after the irradiation
编号保留时间/min裂解产物结构式可能的来源峰面积百分比/%辐照前 辐照后11.763 乙腈脯氨酸1.381.21 22.539 乙酸images/BZ_74_1304_490_1412_512.pngimages/BZ_74_1304_531_1412_603.png提取使用的溶剂3.024.47 33.535 二甲基二硫images/BZ_74_1293_622_1423_662.png二硫键0.550.51 43.774 吡咯images/BZ_74_1318_681_1398_752.png脯氨酸3.113.52 53.910 甲苯images/BZ_74_1297_770_1419_838.png其他蛋白1.201.29 64.602 乙酰胺images/BZ_74_1307_856_1410_933.png脯氨酸和羟脯氨酸0.540.63 74.725 1-乙基-1H-吡咯images/BZ_74_1296_952_1421_1008.png脯氨酸和羟脯氨酸0.460.48 84.880 2-甲基吡啶images/BZ_74_1302_1027_1414_1099.png不明0.140.12 95.275 3-甲基-1H-吡咯images/BZ_74_1292_1118_1425_1177.png脯氨酸和羟脯氨酸0.770.80 105.450 2-甲基-1H-吡咯images/BZ_74_1304_1196_1412_1269.png脯氨酸和羟脯氨酸0.180.19 115.605 糠醇images/BZ_74_1293_1288_1424_1338.png不明0.070.09 125.696 间二甲苯images/BZ_74_1295_1357_1421_1426.png其他蛋白0.070.07 135.883 4-甲基吡啶images/BZ_74_1298_1445_1418_1512.png不明0.060.09 146.239 丙酰胺images/BZ_74_1293_1531_1423_1595.png脯氨酸和羟脯氨酸0.080.09 156.342 苯乙烯images/BZ_74_1301_1614_1415_1682.png其他蛋白0.120.13 167.209 3-乙基-1H-吡咯images/BZ_74_1280_1701_1436_1761.png脯氨酸和羟脯氨酸0.360.51 177.254 2,3-二甲基-1H-吡咯images/BZ_74_1297_1780_1419_1872.png脯氨酸和羟脯氨酸0.14/187.474 2,5-二甲基-1H-吡咯images/BZ_74_1304_1890_1413_1961.png脯氨酸和羟脯氨酸0.170.17 197.675 3-乙基-1H-吡咯images/BZ_74_1279_1980_1438_2037.png脯氨酸和羟脯氨酸0.140.15 207.798 2,3-二甲基-1H-吡咯images/BZ_74_1300_2056_1416_2134.png脯氨酸和羟脯氨酸0.060.06 218.225 二甲基三硫images/BZ_74_1292_2153_1425_2200.png二硫键0.220.27 228.328 2-乙基-4-甲基-1H-吡咯images/BZ_74_1278_2219_1439_2288.png脯氨酸和羟脯氨酸0.060.05 238.464 苯胺images/BZ_74_1289_2307_1428_2369.png不明0.05/248.949 3-乙酰基-1-甲基吡咯images/BZ_74_1284_2388_1432_2454.png脯氨酸和羟脯氨酸0.05/259.137 2-乙基-4-甲基-1H-吡咯images/BZ_74_1269_2473_1447_2566.png脯氨酸和羟脯氨酸0.050.05 269.24 2-乙基-4-甲基-1H-吡咯279.305 乙酰胺images/BZ_74_1272_2585_1445_2657.pngimages/BZ_74_1235_2676_1482_2749.png脯氨酸和羟脯氨酸0.180.25不明0.05/289.363 2-氨基吡啶images/BZ_74_1275_2768_1441_2834.png不明0.490.68 299.590 2-乙基-4-甲基-1H-吡咯images/BZ_74_1279_2853_1438_2923.png脯氨酸和羟脯氨酸0.180.18 309.700 2-乙基吡啶images/BZ_74_1290_2942_1426_3003.png不明0.170.17 31 10.165 4-乙基-3,5-二甲基-1H-吡咯images/BZ_74_1281_3022_1436_3129.png脯氨酸和羟脯氨酸0.040.07
续表1
编号保留时间/min裂解产物结构式可能的来源峰面积百分比/%辐照前 辐照后32 10.444 1-戊基-1H-吡咯33 10.663 2-乙酰基吡咯images/BZ_75_1269_454_1447_542.pngimages/BZ_75_1305_558_1404_636.png脯氨酸和羟脯氨酸0.070.11脯氨酸和羟脯氨酸0.070.17 34 10.78 1,3-辛二烯images/BZ_75_1202_662_1515_704.png脂肪0.130.17 35 11.013 对甲酚images/BZ_75_1281_723_1431_778.png其他蛋白0.170.40 36 11.052 间甲酚images/BZ_75_1291_798_1419_870.png其他蛋白0.20/37 11.543 3-乙基-2,5-二甲基-1H-吡咯38 11.601 2-氨基-3-甲基吡啶39 11.685 3-乙基-2,5-二甲基-1H-吡咯40 11.88 2,3-环戊烯并吡啶images/BZ_75_1276_893_1432_967.pngimages/BZ_75_1292_990_1421_1065.pngimages/BZ_75_1294_1086_1411_1194.pngimages/BZ_75_1299_1223_1411_1295.png脯氨酸和羟脯氨酸0.09/不明0.10/脯氨酸和羟脯氨酸0.130.11不明0.190.40 41 11.944 2,3,4,5-四氢吡啶images/BZ_75_1318_1318_1399_1385.png不明0.12/42 12.242 对氨基苯甲醚images/BZ_75_1270_1404_1446_1461.png其他蛋白0.09/43 12.332 吲哚images/BZ_75_1293_1480_1410_1550.png其他蛋白0.12/44 12.501 苯乙腈images/BZ_75_1285_1576_1421_1636.png其他蛋白0.650.78 45 13.057 3-氰基吡咯images/BZ_75_1270_1659_1446_1709.png脯氨酸和羟脯氨酸1.722.31 46 14.952 苯代丙腈images/BZ_75_1281_1728_1436_1820.png其他蛋白0.290.35 47 15.502 2-吡啶甲酰胺48 16.233 吲嗪49 16.576 2-哌啶基乙酸50 17.481 1H-吡咯-2-甲酰胺51 17.663 2-吡咯甲酸甲酯52 18.206 2-乙酰基-5-甲基咪唑53 24.552 2-isopropylidene-5,6,7,8-tetrahydro-2H-imidazo[1,2-a]pyridin-3-oneimages/BZ_75_1275_1839_1440_1912.pngimages/BZ_75_1290_1931_1427_2016.pngimages/BZ_75_1269_2035_1442_2108.pngimages/BZ_75_1285_2133_1432_2228.pngimages/BZ_75_1297_2247_1419_2330.pngimages/BZ_75_1284_2349_1432_2428.pngimages/BZ_75_1281_2447_1433_2534.png不明0.800.97脯氨酸和羟脯氨酸0.260.30不明0.32/脯氨酸和羟脯氨酸2.492.52脯氨酸和羟脯氨酸2.44/脯氨酸和羟脯氨酸0.240.33脯氨酸和羟脯氨酸0.760.77 54 24.739*O N N两分子羟脯氨酸缩合脱去两分子水和四个氢4.014.31 O 55 25.198 2H-naphtho[1,8-bc]thiophene,2-methyl-56 25.425 5-苯基-1,4-二甲基咪唑images/BZ_75_1298_2708_1412_2817.pngimages/BZ_75_1282_2838_1428_2927.png不明0.450.33不明1.111.78 57 25.651 cyclopropane,1-pentyl-2-propyl-images/BZ_75_1199_2952_1518_2997.png脂肪1.23/58 26.136 pyrrolo[1,2-a]pyrazine-1,4-dione,hexahydro-images/BZ_75_1284_3022_1432_3128.png脯氨酸和甘氨酸缩合脱去两分子水4.834.15
续表1
注(Note):结构式为推导得到(The structural formula was derived)。
编号保留时间/min裂解产物结构式可能的来源峰面积百分比/%辐照前 辐照后59 26.964 thiazolo[4,5-f]quinoline,7-methyl images/BZ_76_1254_444_1462_528.png不明0.170.30 60 27.126 exo-2-Methyl-endo-2-(acetylamino)norbornane images/BZ_76_1287_547_1429_613.png不明0.17/61 28.692*images/BZ_76_1291_631_1425_769.png两分子脯氨酸缩合脱去两分子水1.270.82images/BZ_76_1180_788_1536_849.png62 29.067 棕榈酸脂肪3.562.04 63 29.468 2H-pyrrol-2-one,1,5-dihydro-4-(1-pyrrolidinyl)-images/BZ_76_1272_868_1444_952.png脯氨酸和羟脯氨酸0.37/64 30.47 1H-indolizino[8,7-b]indole-1-propanol,.beta.-ethyl-2,3,5,6,11,11b-h exahydro-images/BZ_76_1225_974_1492_1080.png脯氨酸和羟脯氨酸0.220.11 65 31.667 油酸images/BZ_76_1226_1099_1490_1220.png脂肪0.450.34 66 32.107 硬脂酸images/BZ_76_1198_1238_1518_1290.png脂肪3.92.01 67 32.767*images/BZ_76_1194_1309_1346_1438.pngimages/BZ_76_1383_1317_1522_1438.png羟脯氨酸和甘氨酸缩合脱去两分子水;羟脯氨酸和脯氨酸缩合脱去两分子水2.910.42 68 37.838 正二十六烷脂肪0.140.03 69 39.054 正二十七烷脂肪0.160.04 70 40.238 正二十八烷images/BZ_76_1180_1477_1536_1503.png脂肪0.220.05 71 40.626 角鲨烯images/BZ_76_1143_1594_1574_1617.pngimages/BZ_76_1170_1641_1546_1731.png脂肪0.16/72 41.377 正二十九烷脂肪0.250.06 73 43.912 胆固醇images/BZ_76_1121_1758_1596_1783.pngimages/BZ_76_1204_1807_1513_2002.png提取物0.210.27
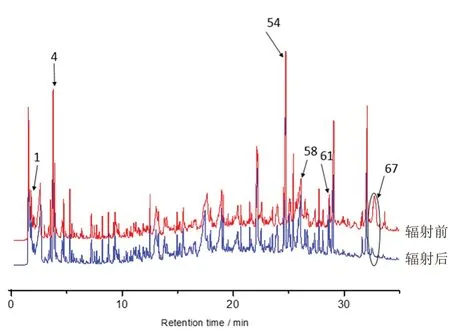
图1 γ-射线辐照前后胶原蛋白海绵的Py-GCMS 总离子流图Fig 1 Total ion chromatogram of Py-GCMS collagen sponge before and after the gamma irradiation
胶原蛋白三螺旋是由三条相同或不同的胶原蛋白肽相互缠绕得到特征的右手三螺旋,其中每一条多肽链各自采取左手螺旋的聚脯氨酸Ⅱ型(polyproline type Ⅱ,PPⅡ)螺旋结构,见图2,通过热裂解质谱可以观察到胶原蛋白组成中的三种氨基酸两两通过肽键缩合形成的哌嗪二酮(diketopiperazine,DKP)特征结构,在裂解产物列表中可见5 个DKP 结构,对应峰编号为54、58、61、67(含两个峰),其质谱图分别见图3,对应的产物分析见图4。从图4 中可以看出,两分子氨基酸之间的缩合以羧酸和氨基反应脱去两分子水为主,而当羟脯氨酸自身缩合时,由于结构中还存在羟基,脱去了四分子水和四分子氢。这些DKP产物印证了胶原蛋白海绵的分子结构。在总离子流图中,辐照后的样品第67 号峰高出现明显下降,说明辐照对于胶原蛋白海绵的结构产生了一定影响,证实辐照导致了胶原蛋白三螺旋结构中局部羟脯氨酸与甘氨酸和脯氨酸的连接丢失,自身的共价交联度变低。值得注意的是,当裂解温度不变而裂解时长加长至1 min 时或样品风干后,结果类似,即第67 号峰出现明显下降或消失,这说明辐照、温度、失水等因素对羟脯氨酸与甘氨酸和脯氨酸的影响一致,而且羟脯氨酸与甘氨酸和脯氨酸的连接相较其他连接而言对这些因素更为敏感。

图2 胶原蛋白三螺旋结构片段的平面图(a)和球-棒图(b)Fig 2 Plane graph (a) and ball-and-stick graph(b) of segments of triple-helix collagen
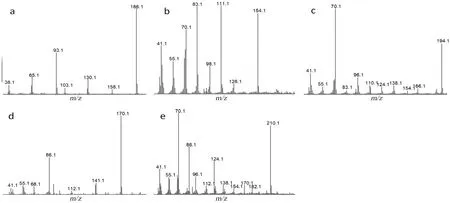
图3 Hyp-Hyp(a),Pro-Gly(b),Pro-Pro(c),Gly-Hyp(d),Pro-Hyp(e)的DKP 质谱图Fig 3 DKP mass spectra of Hyp-Hyp(a),Pro-Gly(b),Pro-Pro(c),Gly-Hyp(d),and Pro-Hyp(e)
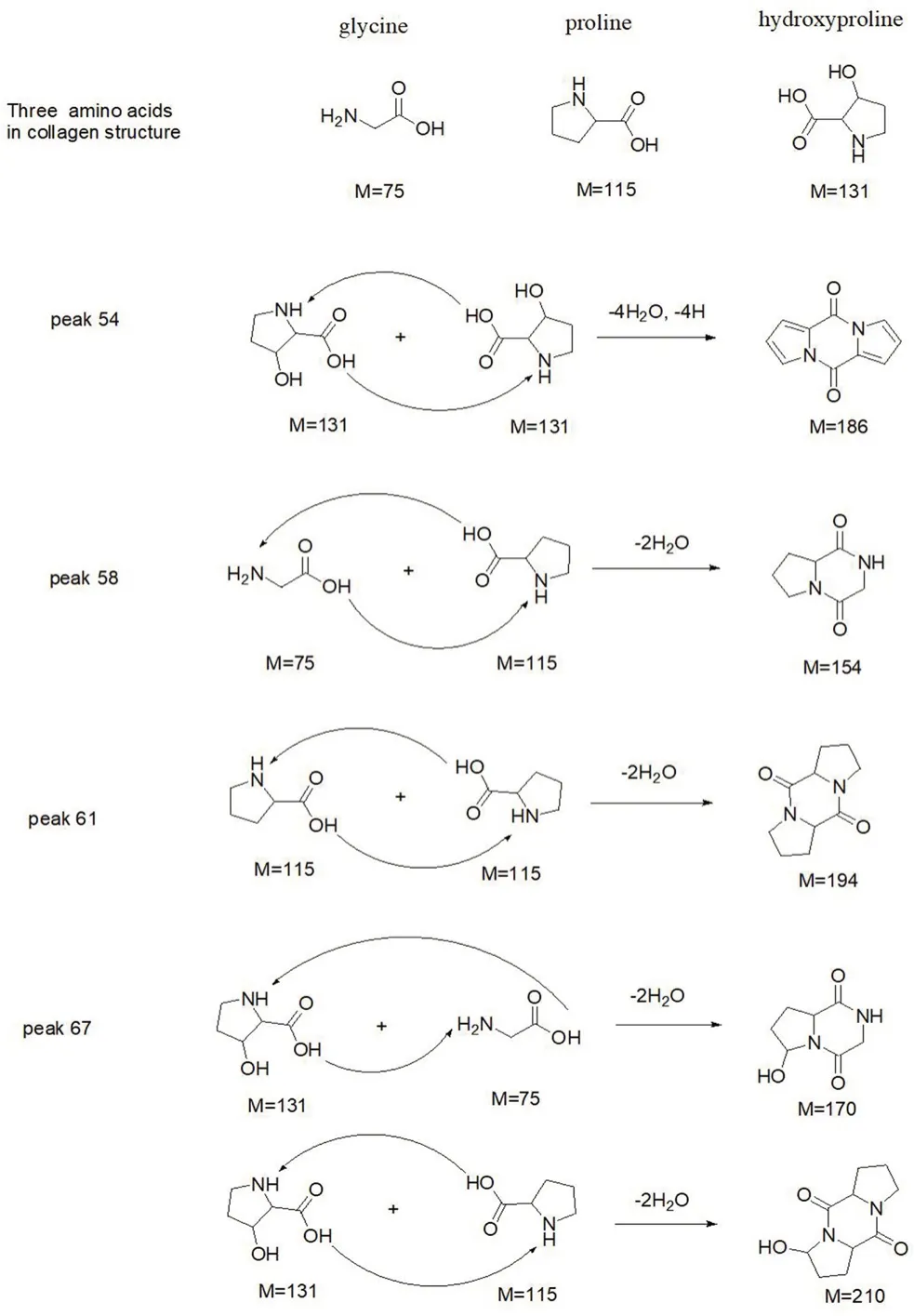
图4 裂解产物中DKP 的分析Fig 4 DKP in pyrolysis products
2.2 Raman
将辐照前后的胶原蛋白海绵放在样品台上进行常温Raman 光谱测试。激发源为Nd-YAG:532 nm,采用600 gr/mm 光栅,×50LWD 物镜,200 μm 针孔,60 s 曝光时间,为避免激光高温灼伤样品,在样品表面覆盖一片薄的石英片。测试前,使用单晶硅对峰位进行校准。测试得到Raman 光谱图,见图5。
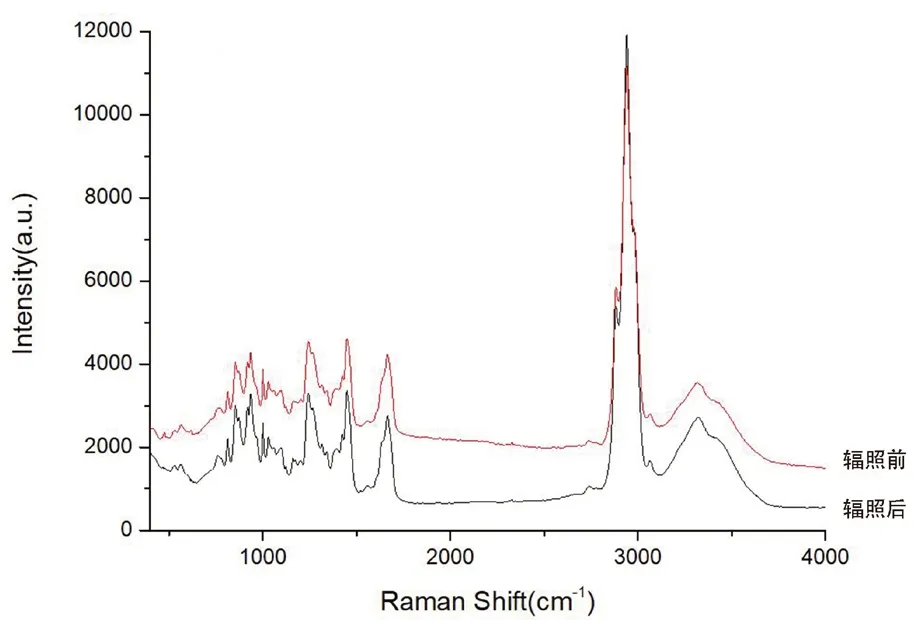
图5 γ-射线辐照前后胶原蛋白海绵的拉曼光谱图Fig 5 Raman spectra of collagen sponge before and after the gamma irradiation
对Raman 光谱图进行基线校正和归一化处理,基线校正采用Labspec5 软件(Labspec;Horiba Jobin Yvon,Japan)。在光谱分析中没有使用去噪或平滑处理。脯氨酸和羟脯氨酸吡咯烷环上亚甲基的反对称和对称伸缩振动峰,以及酰胺A 带、Ⅰ带和Ⅲ带是Raman 光谱的主要组成部分。酰胺Ⅱ带在红外光谱中很强,但在Raman 光谱中很弱。主要谱峰的归属见表2。获得的Raman光谱数据在γ
-射线辐照前后几乎相同,但当用最高峰归一化时,我们发现辐照后的谱峰强度普遍得到了增强,说明辐照对胶原的交联结构产生了一定影响。根据Born-vonkamann 周期性条件,Raman 频率满足λ
=π/
N,式中,π
为常数,N 是碳原子数目,由于胶原蛋白中N 值超过10 000,所以少量碳原子数目变化不会影响Raman 位移。因此,在本实验中,辐照前后样品的Raman 频移变化不大。但强度有变化,是由于Raman 光谱对氢键网络结构和酰胺附近的条件很敏感,共价交联链局部断裂后氢键作用力减弱,使得分子键的振动加剧,从而强度得以增强。表2 胶原蛋白海绵拉曼光谱数据解析
Tab 2 Raman spectra data of collagen sponge
辐照前辐照后波数/cm-1 强度/%波数 /cm-1 强度 /%归属3321 233313 25 ν 对称(N-H),酰胺A 带29411002941100 ν 反对称(CH2)2883 452883 48 ν 对称(CH2)1664 231664 32 ν 反对称(C =O),酰胺Ⅰ带1448 281449 36 δ(CH2),亚甲基的剪式振动1265 251265 32 ν(C-N),δ(N-H),酰胺Ⅲ带1243 281243 35 ν(C-N),δ(N-H),酰胺Ⅲ带936 28 936 33 ν(C-C),脯氨酸和羟脯氨酸中与羰基相连的碳碳键伸缩振动854 25 854 30 ν(C-C),脯氨酸和羟脯氨酸中的吡咯烷环骨架振动
2.3 CD 光谱
准确称取辐照前后的胶原蛋白海绵,使用0.01 mol·L乙酸水溶液溶解稀释为0.1 mg·mL的溶液,于4 ℃冰箱放置过夜,测试前于室温下放置1 h,注入1 mm 光程的圆形比色皿中(型号:31/B/Q/1,Starna Scientific Ltd.Hainault,Essex IG6 3UT,United Kingdom)。设置带宽为1 nm,响应时间0.5 s,标准灵敏度,扫描范围为190 ~260 nm。为了防止CD 光谱变形,扫描速度(nm·s)和响应时间(s)的乘积应小于半高宽的10%(蛋白质光谱的半高宽通常约为15 nm)。本实验设置响应时间为0.5 s,扫描速度为100 nm·min,再通过数据平滑处理降低噪声,得到高质量的CD 光谱图,见图6。
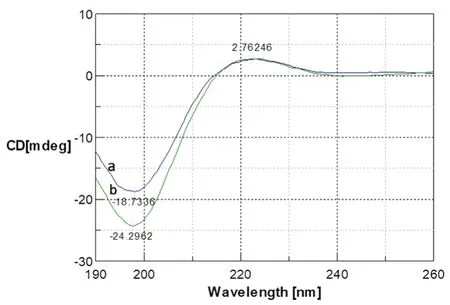
图6 室温下γ-射线辐照前(a)和辐照后(b)胶原蛋白海绵溶液的CD 光谱图Fig 6 CD spectra of collagen solution before(a)and after(b)the gamma irradiation at room temperature
对于天然胶原蛋白,理想的CD 光谱是出现221 nm 处的明显正峰和198 nm 处的负峰。在本研究中,医用胶原海绵样品的三螺旋构象由图6 中的CD 光谱证实。CD 光谱图中显示负峰和正峰,这表明胶原海绵在γ
-射线辐照前后呈正常的三螺旋结构。此外,可以使用两个峰(221 nm 处的正峰,198 nm 附近的负峰)的强度比值计算的正负峰强度比(ratio of positive to negative peak intensity,Rpn)用于估计溶液中的三螺旋构象。在本实验中,两个胶原海绵样品显示出良好的Rpn,辐照前Rpn 为0.15,辐照后Rpn 为0.11,表明辐照灭菌后保留了三螺旋结构。3 结论
对于胶原蛋白产品来说,完整的三螺旋结构是保持其稳定性、机械性能和生物活性的重要保证,对胶原蛋白三螺旋结构的理解也将有利于指导用于生物医学和纳米技术的人工胶原材料的进一步开发,因此有必要对其三螺旋结构进行分析。本文联合Py-GCMS 质谱法和两种光谱方法(Raman 及CD)对辐照前后胶原蛋白海绵的结构进行了讨论,详细分析了热裂解产物,并对组成胶原蛋白的3 种氨基酸两两通过肽键缩合形成的DKP 结构进行了推导,证实了胶原蛋白的三螺旋结构在辐照后发生了肽链的变化。Raman 光谱数据进一步佐证了这一变化,局部肽链断裂导致交联度降低。通过对CD 光谱的计算和分析,结果表明,辐照前后医用胶原蛋白海绵的三螺旋结构得以保持。联合质谱法和光谱法对胶原蛋白进行分析,有助于更好地理解其三螺旋结构,为胶原蛋白相关科研和胶原蛋白海绵生产企业提供参考依据。

