黄瓜硫酸盐转运蛋白家族成员的鉴定与表达分析
赵 闻,廖伟民,赵金栋,刁慧贞,江孟涛,蒋伦伟
(江西农业大学生物科学与工程学院,南昌 330045)
硫(sulfur)作为植物体中所需的6种大量元素之一,是硫胺素、甲硫氨酸、半胱氨酸、铁氧化还原蛋白、生物素等有机物的重要组成部分,广泛参与植物的生长发育过程。硫酸盐(SO42-)是土壤中硫营养的主要存在形式,根系从土壤环境中吸收SO42-的能力是影响植物硫素营养状况的重要因素之一。植物体内的硫以无机硫酸盐和有机硫化合物的形式存在。其中SO42-主要贮藏在液泡中,有机态硫则主要以含硫氨基酸如胱氨酸、半胱氨酸、甲硫氨酸及谷胱甘肽等化合物存在于植物体内的各器官中。
大量研究发现,无论是植物从土壤中吸收硫,还是SO42-在细胞内的运输都离不开硫酸盐转运(sulfate transporter,SULTR)蛋白。SULTR蛋白的C端具有抗σ因子拮抗(sulfate transport anti-sigma,STAS)结构域,N端具有硫转运结构域,同时还包含12个跨膜结构域(transmembrane domains,TMDs)[1]。SULTR基因通常是以家族的形式存在于不同植物中的,迄今为止已经在拟南芥(Arabidopsis thaliana)[2]、高粱(Sorghum bicolor)[3]、小麦(Triticum aestivum)[4]、苹果(Malus domestica)[5]、山黧豆(Lathyrus sativus)[6]、茶树(Camellia sinensis)[7]等植物中得到鉴定。拟南芥SULTR基因家族共有12个成员,根据其亚细胞定位、序列同源性及功能特性可分为4个亚家族(SULTR1~4),分别负责不同组织和胞内SO42-的转运。它们在不同的组织中以不同水平表达,其亲和力和表达方式的差异体现了它们各自在功能上的差异。其中,高亲和力的SULTR一般在根部特异性表达,主要负责吸收土壤中的硫;低亲和力的SULTR主要在叶片中表达,负责调节植物细胞间硫的转运。如在低硫胁迫时,AtSULTR1;1和AtSULTR1;2能促使硫酸盐进入根;其中AtSULTR1;2是主要的硫酸盐吸收者,At-SULTR1;2基因的缺失会导致大幅降低植物硫酸盐的吸收,而AtSULTR1;1仅在低硫条件下表达,从而辅助AtSULTR1;2增强植物对硫酸盐的吸收[8]。At-SULTR1;3则位于韧皮部,参与硫酸盐从地上部分向根部的转运;而AtSULTR3;5可以促进硫酸盐由根系到地上部分的运输[9];AtSULTR4;1和AtSULTR4;2定位于液泡膜,在低硫环境胁迫下可以通过把液泡中的SO42-释放到维管组织中来调节根系组织液泡的硫贮存能力[10]。除SO42-的转运外,一些SULTR蛋白还参与硒酸盐的转运,其表达受硒酸盐和硫酸盐的调控[11-12]。如茶树CsSULTR3.5基因在短时间内能够快速响应硫酸盐的诱导,而硒酸盐需要较长时间才能诱导其表达[11]。此外,SULTR蛋白还广泛参与植物的胁迫应答过程,如重金属[3]、低温[13]、干旱、盐等非生物胁迫[14-16]。如在镉胁迫下,高粱SbSULTR1;2、SbSULTR1;3、SbSULTR3;3、Sb-SULTR3;5,以及拟南芥AtSULTR1;1、AtSULTR1;2、AtSULTR1;3、AtSULTR2;1、AtSULTR2;2等基因的表达量明显上调[3]。AtSULTR3;1的缺失影响了脱落酸(abscisic acid,ABA)的合成,从而改变了植株在种子萌发和根系生长阶段对于外源ABA的响应[16]。
黄瓜是一年蔓生植物,因富含维生素、糖类、胡萝卜素、铁等营养成分以及其种植简单的特性在世界各地被广泛种植,是一种重要的经济农作物。霜霉病是黄瓜生产中的重要病害之一,它是由古巴假霜霉菌(Pseudoperonospora cubensis)侵染所引起的一种叶部病害,严重时会导致黄瓜大面积枯死,造成严重的经济损失。SULTR基因作为硫酸盐吸收和转运过程中的关键基因,在含硫营养代谢以及胁迫应答中发挥着重要的作用。但是迄今为止,黄瓜SULTR基因家族成员尚未被鉴定。本研究利用生物信息学的方法和相关软件鉴定黄瓜SULTR基因家族成员,并对该基因家族的组成、结构、进化关系、保守性、编码蛋白及表达模式进行分析,为将来探究该家族基因潜在的生物学功能提供参考,为探究黄瓜硫的同化及霜霉病的抗性机制奠定基础。
1 材料与方法
1.1 黄瓜SULTR基因家族的全基因组鉴定
从NCBI下载12条拟南芥SULTR蛋白作为参考序列,在黄瓜基因组网站(http://cucurbitgenomics.org/organism/2)进行BLAST,e值设置为0.01;同时,在PFAM数据库(http://pfam.xfam.org/)中下载基因的HMM(Hidden Markov Model)种子文件(PF00916和PF01740),运用HMMER v3.0软件对黄瓜v2蛋白数据库进行扫描。整理BLAST与HMMER结果,除去冗余基因,并通过PFAM和SMRAT网站(http://smart.embl-heidelberg.de/)鉴定候选序列是否同时具有SULTR蛋白的两个特征结构域,最后符合条件的被列为黄瓜SULTR基因家族成员。
1.2 黄瓜SULTR基因染色体定位与蛋白理化性质分析
在黄瓜基因组网站中提取黄瓜SULTR基因的染色体位置信息和蛋白序列,通过ExPASy数据库(http://web.expasy.org/)预测黄瓜SULTR蛋白的亲疏水性均值(grand average of hydropathicity,GRAVY)、等电点(isoelectric point,pI)、相对分子质量(molecular weight,MW)和氨基酸数目。通过Plant-mPLoc数据库(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测黄瓜SULTR蛋白的亚细胞定位。
1.3 黄瓜SULTR家族成员蛋白系统进化树分析
参考之前的文献[17],使用MAFFT在线服务器(https://www.ebi.ac.uk/Tools/msa/mafft/)对拟南芥和黄瓜2个物种SULTR基因家族的蛋白序列进行比对,构建系统发育树,并利用MEGA7.0软件对系统发育树进行可视化分析。
1.4 黄瓜SULTR基因结构及启动子顺式作用元件分析
利用 Gene Structure Display Server服务器(GSDS,http://gsds.gao-lab.org/)对黄瓜SULTR基因的编码序列(coding sequence,CDS)和基因组序列(genomic DNA,gDNA)进行比对,分析CsaSULTR基因中CDS、非编码区(untranslated region,UTR)与内含子的结构分布。在PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)上提交黄瓜SULTR基因起始密码子(ATG)上游2 000 bp启动子序列,分析启动子区域中与生长发育、逆境胁迫以及激素应答相关的顺式作用元件。
1.5 黄瓜SULTR基因表达分析
在NCBI网站中下载黄瓜不同组织(包括根、茎、叶、雄花、雌花、卷须、子房等,编号PRJNA80169)和霜霉病处理不同时期(编号PRJNA285071)的RNA-seq数据[18-19],根据前人的文献进行数据化处理,并以TPM(transcripts per million)值进行可视化[17,20]。
2 结果与分析
2.1 CsaSULTR基因的全基因组鉴定及染色体定位
基于黄瓜v2蛋白数据,利用HMMER软件比对搜索种子文件(PF00916和PF01740),同时利用已发表的拟南芥SULTR序列,对黄瓜v2蛋白数据进行检索,进一步通过保守结构域分析,最终鉴定获得10个黄瓜SULTR基因家族成员。根据这10个基因及与拟南芥SULTR基因的亲缘关系将它们命名为CsaSULTR1;1~CsaSULTR4;1(表1)。这些基因不均等分布在黄瓜的3号、4号、5号、7号染色体上,其中5号染色体上含有的CsaSULTR基因最多(共4个),3号染色体上分布的CsaSULTR基因最少(共1个)。对CsaSULTR基因序列分析发现,Csa-SULTR3;3的gDNA最长(10 307 bp),CsaSULTR1;2的gDNA长度最短(4 189 bp)(表1)。
2.2 黄瓜SULTR蛋白理化性质分析
通过分析蛋白的理化性质发现,黄瓜SULTR蛋白相对分子质量在70.93(CsaSULTR2;1和CsaSULTR3;2)~76.69 kD(CsaSULTR4;1)之间,pI在8.48(CsaSULTR3;2)~9.30(CsaSULTR2;1)之间。亚细胞定位预测表明,除CsaSULTR4;1定位于叶绿体外,其他CsaSULTR蛋白全部定位于细胞膜上(表1)。

表1 黄瓜SULTR家族成员基本信息Tab. 1 Basic information of the SULTR gene family in cucumber
2.3 黄瓜SULTR基因家族成员系统发育分析与分类
进化树分析表明,拟南芥和黄瓜SULTR蛋白可分为4组(GROUP 1~4):第1组中包含3个Csa-SULTR成员(CsaSULTR1;1、CsaSULTR1;2、CsaSUL-TR1;3);第2组包含2个CsaSULTR成员(CsaSULTR2;1、CsaSULTR2;2);第3组包含4个CsaSULTR成员(CsaSULTR3;1、CsaSULTR3;2、CsaSULTR3;3、Csa-SULTR3;4);第4组包含1个CsaSULTR成员(Csa-SULTR4;1)(图1)。此聚类结果与拟南芥、水稻、高粱、玉米等物种一致[3,14]。
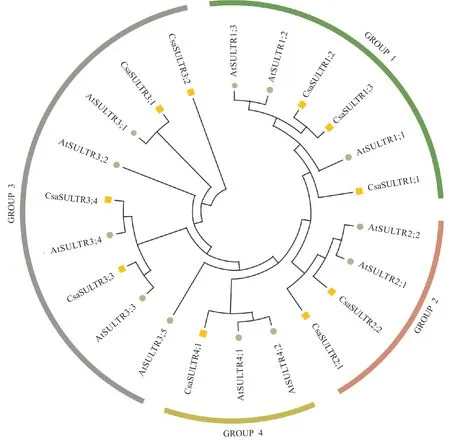
图1 拟南芥与黄瓜SULTR家族成员的系统进化分析Fig. 1 Phylogenetic analysis of SULTR family members from Arabidopsis and cucumber
2.4 黄瓜SULTR家族成员基因结构分析
基因结构分析结果表明,CsaSULTR基因均含有较多数量的内含子(图2)。其中CsaSULTR1;1含有9个内含子,其余的CsaSULTR基因包含10~16个数量不等的内含子。此外,属于同一组的CsaSULTR基因含有相似的基因结构,与系统发育分析的结果一致。如CsaSULTR3;1和CsaSULTR3;2内含子的数量分别都为11个,而且每个外显子的长度都非常相似。
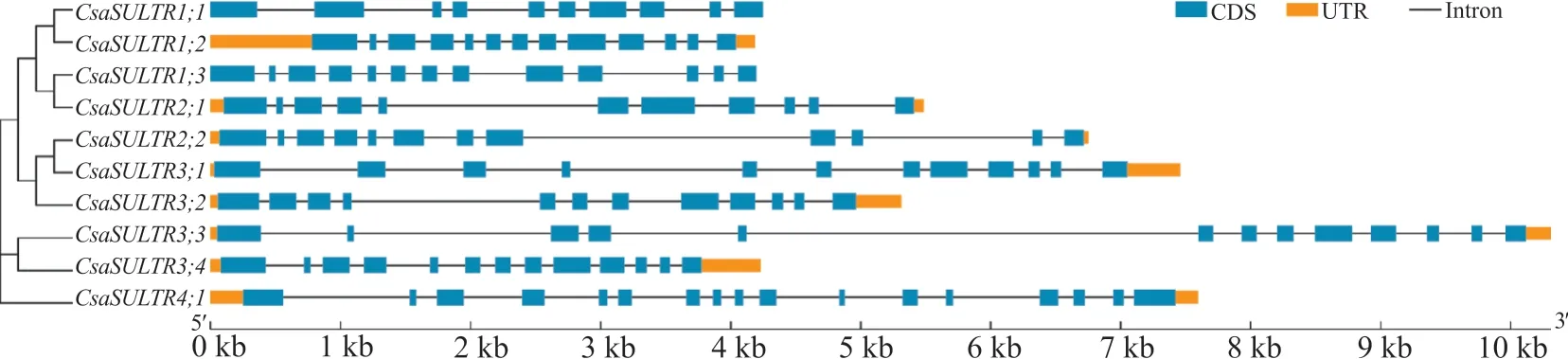
图2 黄瓜SULTR家族成员基因的结构分析Fig. 2 Gene structure analysis of SULTR family members in cucumber
2.5 黄瓜SULTR基因启动子顺式作用元件分析
为了对SULTR基因的转录调控进行深入的了解,本文利用PlantCARE数据库对10个CsaSULTRs上游2 000 bp位点内的激素反应与胁迫应答元件进行了分析,结果如图3所示。在激素反应元件中,ABA 响应元件(abscisic acid responsive element,ABRE)含量最多,每一个CsaSULTR基因的启动子中均含有不同数量的ABRE元件。在胁迫应答元件中,抗厌氧元件(anaerobic induction element,ARE)的基因数目含量最多,分布在除CsaSULTR2;2和Csa-SULTR3;2外的其他CsaSULTR基因中。这些结果表明,CsaSULTR基因可能在黄瓜的生长发育、激素应答及胁迫应答过程中具有重要功能。

图3 黄瓜SULTR基因顺式作用元件分析Fig. 3 Cis-acting elements in the promoters of each SULTR gene in cucumber
2.6 黄瓜SULTR基因在不同组织下的表达模式分析
利用TBtools软件,基于现有的RNA-seq数据绘制黄瓜CsaSULTR基因在根、茎、叶、雄花、雌花、卷须、子房等7个不同组织的表达模式热图,结果如图4所示。CsaSULTR1;1和CsaSULTR1;3在各组织中的表达量都非常低,甚至不表达,其余基因至少在一个组织中存在高表达。其中CsaSULTR2;2在雌花中高表达,而在茎中却检测不到表达;CsaSULTR3;1基因在根、雄花、雌花和子房中表达最高;CsaSULTR1;2和CsaSULTR2;1基因在雄花中表达最高;CsaSULTR3;4在根和雄花中表达最高。不同的CsaSULTR基因的表达量与表达模式不尽相同,表明黄瓜SULTR基因的功能存在着组织特异性。

图4 黄瓜CsaSULTR基因的组织表达谱Fig. 4 Tissue expression profiles of cucumber CsaSULTR genes
2.7 黄瓜SULTR基因在霜霉病菌侵染下的表达分析
为了确定黄瓜SULTR基因的表达是否受到霜霉病菌侵染的响应,本文利用前人发表的RNA-seq数据[18],在霜霉病菌侵染不同时间点的PI 197088(霜霉病高抗品种)和Vlaspik(霜霉病高感品种)中对CsaSULTR基因的表达量进行了分析(图5)。结果表明,在霜霉病菌侵染后的Vlaspik中,Csa-SULTR1;2、CsaSULTR2;1、CsaSULTR2;2、CsaSULTR3;1、CsaSULTR3;3的表达量明显呈下降趋势,而CsaSULTR3;4和CsaSULTR4;1表达量明显上升。在PI 197088中,CsaSULTR3;2、CsaSULTR4;1、Csa-SULTR1;2、CsaSULTR2;2接种霜霉病菌后的表达量均呈上升趋势,而CsaSULTR3;1、CsaSULTR3;3、CsaSULTR2;2接种霜霉病菌1 d后的表达量明显下降,随后上调表达或恢复至对照水平。
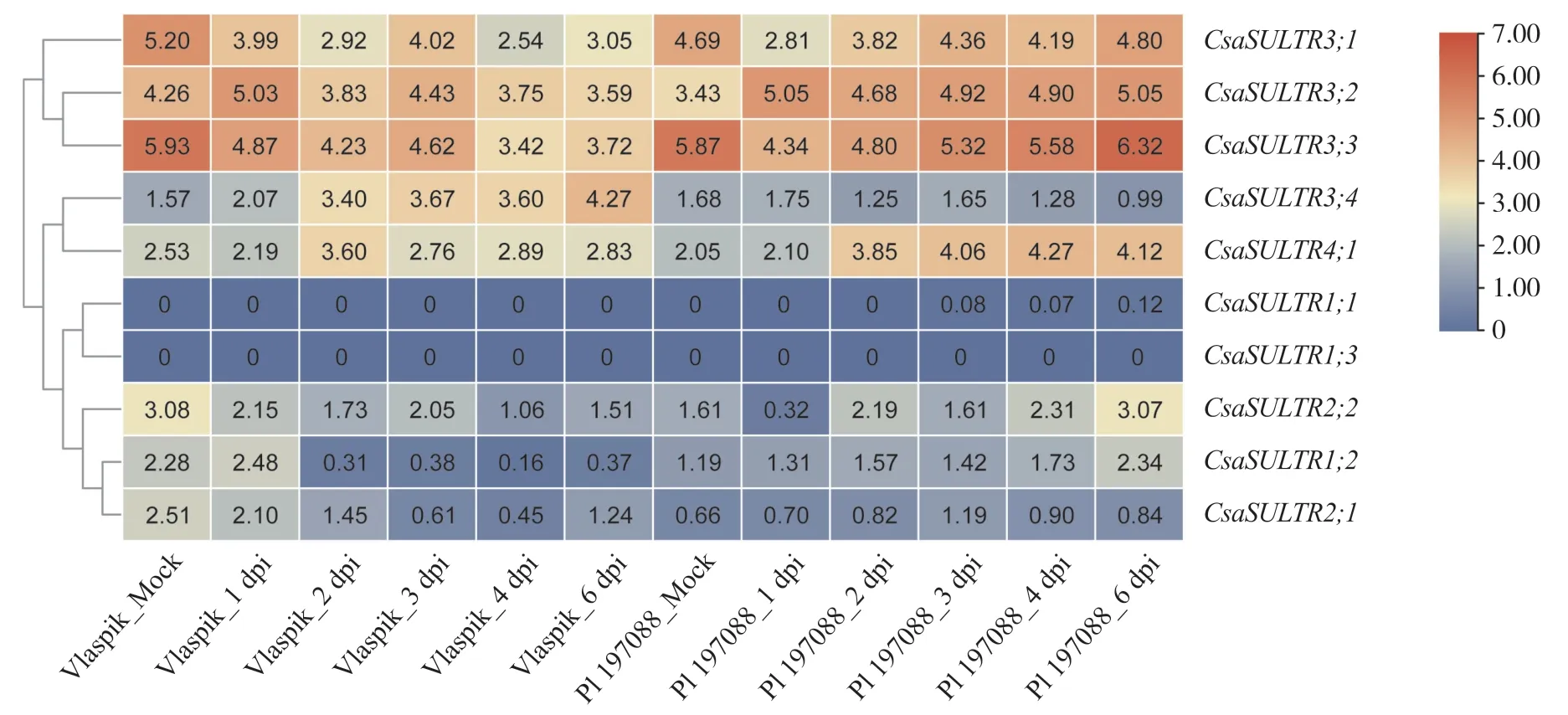
图5 黄瓜CsaSULTR基因在霜霉病菌侵染胁迫下的表达模式Fig. 5 Expression pattern of cucumber CsaSULTR genes during Pseudoperonospora cubensis infection
3 讨论
SULTR蛋白在植物吸收土壤中硫的过程中发挥着重要的作用。近年来,许多SULTR基因已经在各种植物物种中被相继报道。如拟南芥和水稻中被报道各有12个SULTR基因[5],高粱中有11个[3],小麦中有10个[4],苹果中有9个[5],茶树中有8个[7]。本研究利用生物信息学方法在黄瓜中共鉴定得到了10个CsaSULTR基因,它们不均等地分布在4条染色体上。理化性质结果表明,所有CsaSULTR蛋白的pI值都大于7,表明它们均呈碱性,与茶树、土豆、高粱等物种的研究相一致,表明CsaSULTR蛋白与其他物种一样,需要在碱性条件下才能发挥其对硫的吸收转运等功能。此外,绝大部分CsaSULTR蛋白均定位于质膜上,故可推测这些CsaSULTR蛋白可能在质膜中发挥其转运功能,这与先前报道的茶树[3]、高粱[7]等物种SULTR蛋白主要定位于质膜上相同,表明SULTR蛋白在不同物种间具有相似或相同的功能。此外,亚细胞定位预测结果表明,CsaSULTR4;1定位于叶绿体上,暗示其可能负责转运硫酸盐到叶绿体,参与叶绿体硫酸盐的代谢。
通过对拟南芥和黄瓜的系统发育树分析,上述CsaSULTR成员可分为GROUP 1~4四组,且亲缘关系较近的CsaSULTR成员的基因结构非常相似。这些结果与先前报道的拟南芥、茶树、玉米等的SULTR基因家族一致[7,15]。此外,CsaSULTR基因的启动子分析显示,这10个CsaSULTR基因的上游区存在较多的激素响应和胁迫应答等多种顺式作用元件。需要特别指出的是,植物激素同样能调节硫营养的运输和同化代谢过程。如硫酸盐及其同化产物Cys可以影响ABA合成途径中关键酶ABSCISIC ALDEHYDE OXIDASE 3(AAO3,EC 1.2.3.1)的活性,从而调节ABA的生物合成[16,21]。所有CsaSULTR基因对ABA的响应元件数量居多,表明CsaSULTR基因在黄瓜ABA合成过程中可能有着较为重要的作用。在胁迫应答方面,除Csa-SULTR3;2外,其余CsaSULTR基因中均包含数量不等的胁迫应答响应元件,表明它们可能在胁迫应答过程中发挥一定的作用。之前在玉米中的研究表明,除ZmSULTR3;3外,其余ZmSULTR基因均能够响应干旱、高盐和高温等非生物胁迫[15]。当土壤中含硫量较低时,在大豆中过表达GmSULTR1;2b基因能增强大豆对缺硫胁迫的耐受性,从而提高作物的产量[22]。
对黄瓜SULTR基因的组织表达模式分析表明,SULTR基因在黄瓜中具有组织特异性。例如:Csa-SULTR2;2不在茎中表达,可能不参与茎中硫元素的运输传递;CsaSULTR3;1、CsaSULTR3;4在根、雄花、雌花和子房中表达量最高,表明两者在黄瓜的花房发育过程中发挥着重要的作用。这与之前报道的一些物种的SULTR基因表达模式相同。例如:拟南芥AtSULTR1亚家族主要在根系中表达,负责在根部于外界环境中摄取转运硫酸盐[8];AtSULTR2亚家族主要在维管组织中表达,负责组织间硫的分布[23]。茶树中除CsSULTR1;1和CsSULTR3;2外,其余6个CsSULTR基因在处于休眠期的茎中高量表达[7]。大豆的SULTR1;2b基因与油菜的SULTR2;2基因在根中特异性表达[24]。最近的研究表明,谷子SiSULTR2.1也具有组织表达特异性,且在谷子茎、叶片中表达量较高[25]。此外,在亲缘关系相近的一些CsaSULTR之间,基因表达量也较为相似。例如:CsaSULTR1;1与CsaSULTR1;3在各组织中都低量表达或不表达;CsaSULTR2;1与CsaSULTR1;2都在雄花中表达量最高,在卷须中表达量最低;CsaSULTR3;1与CsaSULTR3;4都在根中表达量最高,在卷须中表达量最低(图4)。而第3亚家族和第4亚家族的CsaSULTR成员基因表达量相对于第1亚家族和第2亚家族要高出许多,具有明显的差异,且亲缘关系相近的基因结构也较为相似(图2)。这些结果表明,亲缘关系相近的CsaSULTR基因可能在黄瓜的同一组织中具有相似的硫转运功能,同时,它们可能在黄瓜对SO42-吸收转运的不同环节与过程中发挥作用。
硫营养与激素之间的信息交流是与环境胁迫的响应等交织在一起的,是植物对营养和其他环境胁迫适应所作出的自我调节的反应。大部分CsaSULTR基因启动子的上游区存在较多的ARE以及水杨酸(salicylic acid,SA)和茉莉酸(jasmonic acid,JA)相关的顺式作用元件,暗示CsaSULTR基因可能参与生物胁迫响应。本研究在霜霉病高抗品种PI 197088和霜霉病高感品种Vlaspik中对CsaSULTR基因响应霜霉病菌诱导的表达变化进行了对比分析,结果表明,仅有CsaSULTR4;1在两个品种中均表现出上调表达,特别是在病原菌处理早期(2 dpi)。而Csa-SULTR3;1、CsaSULTR3;3、CsaSULTR2;2在两个品种中均表现出下调表达,但它们的表达量在高感品种接种霜霉病菌1~7 d后均呈下调趋势,而在高抗品种中仅在病原菌处理早期(1 dpi)明显下降,随后上调表达或恢复至对照水平。此外,CsaSULTR2;1、CsaSULTR1;2仅在高感品种中表现出明显的下调表达,而CsaSULTR3;2和CsaSULTR3;4分别仅在高抗品种和高感品种中表现出明显的上调表达。这些结果表明,CsaSULTR基因可能在黄瓜抵御霜霉病菌侵染过程中发挥了重要的作用。

