不同分子质量水溶性大豆皮膳食纤维的单糖组成、结构、性质研究
吴金祥,李荣丽,吴喆超,戴 煌,毕 洁,张 威,肖安红
(武汉轻工大学食品科学与工程学院;湖北省农产品加工与转化重点实验室;大宗粮油精深加工省部共建教育部重点实验室,武汉 430023)
膳食纤维作为一种食品原料,有益于控制体重、降低胆固醇、预防糖尿病和高血压等。膳食纤维的单糖组成、分子质量、结构特征等不同,及其功能特性的差异,会影响其生理活性。刘静娜等[1]研究分子质量为499、2 750 ku壳聚糖对胆固醇的吸附能力,发现499 ku壳聚糖对胆固醇吸附能力更强。韩晴等[2]研究分子质量为140、2 300 ku水溶性大豆多糖的乳化性和起泡性,发现2 300 ku的功能特性更好。何喜珍等[3]采用DPPH自由基、羟自由基清除法和铁氰化钾法研究分子质量为550、347、285、21 ku大豆多糖的抗氧化能力,结果表明,285 ku大豆多糖的抗氧化效果最好,分子质量为21 ku的大豆多糖抗氧化效果最差。可见,膳食纤维的性质与其生物活性具有相关性,所以研究两者的关系具有重要意义。
大豆皮是大豆加工中产生的副产物,约占籽粒的10%,含纤维性超过50%,是生产膳食纤维的良好资源。膳食纤维按溶解性可分为水溶性(SDF)和水不溶性(IDF)的膳食纤维,在性质和生理作用上有较大差异,其中SDF因更容易添加到食品中而被广泛使用。本实验研究了3种不同分子质量水溶性大豆皮的膳食纤维的单糖种类、结构及性质上的差异,以期为充分利用大豆皮开发膳食纤维提供参考。
1 材料与方法
1.1 材料与试剂
本研究室自制3种不同分子质量水溶性大豆皮膳食纤维:SDF-1、SDF-2、SDF-3,其成分及分子质量分布见表1和表2。一级玉米油;溴化钾、刚果红、氢氧化钡、硝酸银、冰乙酸、邻苯二甲醛、氢氧化钠、盐酸、水杨酸、无水乙醇、浓硫酸、过氧化氢、硫酸亚铁等均为分析纯。

表1 SDF-1、SDF-2、SDF-3的基本成分/%(干基)
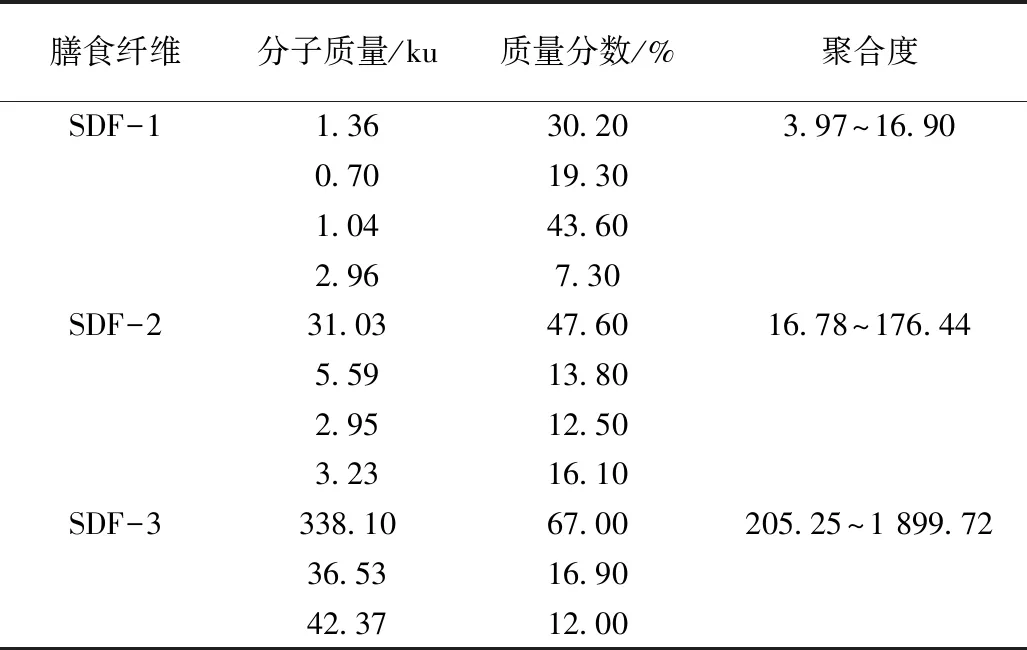
表2 SDF-1、SDF-2、SDF-3的分子质量的分布情况
1.2 主要仪器与设备
210型高效液相色谱仪,NEXUS670傅里叶红外光谱仪,锐影Empyrean高分辨率X-射线衍射仪,Q2000差示扫描量热仪,NDJ-79旋转黏度计。
1.3 方法
1.3.1 组成膳食纤维分子的单糖成分的测定[4]
采用高效液相色谱法测定。制样:取样0.1 g,加入5 mL 1 mol/L H2SO4,90 ℃水解2 h,冷却后用Ba(OH)2中和至pH 6.0,静置过夜,离心(4 000 r/min,10 min),取上清水解液。测定条件:ShodexSP0810色谱柱,90 ℃柱温,水流动相,流速0.6 mL/min,Optilab T-rEX示差检测器,进样量20 μL,运行时间30 min。
1.3.2 膳食纤维分子官能团的测定
将1 mg样品与0.1 g 溴化钾用玛瑙研钵研磨成均匀粉末,手动压力机压制成薄片后,采用傅里叶红外光谱在25 ℃,分辨率为4 cm-1,扫描次数为64次条件下进行全波段扫描(4 000~400 cm-1)。
1.3.3 刚果红实验[5]
取5 mg样品,加入2.0 mL蒸馏水和2.0 mL 80 μmol/L的刚果红试剂,加入1 mol/L的NaOH溶液,使反应体系中的NaOH浓度分别达到0.1、0.2、0.3、0.4、0.5 mol/L时,测其最大吸收波长。以不加样本的刚果红溶液为实验对照。
1.3.4 膳食纤维分子的晶体结构的测定[6]
取0.1 g样品放在载玻片上,用盖玻片压平,在Cu-Kα靶、0.02°步宽、6(°)/min扫描速率、5°~60°扫描范围的条件下,进行X-射线衍射实验。
1.3.5 膳食纤维热稳定性的测定[7]
采用差示扫描量热仪分析,取3 mg样品于铝盘中并压片,以空铝盘为对照。在氮气流速50 mL/min,以10 ℃/min的升温速率由20 ℃升至210 ℃。记录此过程的起始温度(T0)、峰值温度(Tp)、终止温度(Te)和热焓变(ΔH)。
1.3.6 膳食纤维吸水(油)力的测定[8]
取样品m0(小于3.0 g,水分为w)于质量为m1的离心管中,加入25 mL蒸馏水或食用油,室温静置1 h后,离心(2 500 r/min,10 min),弃去上清液,并用滤纸吸干离心管壁残留水分或食用油,称重样品和离心管(m2,g)。按式(1)计算吸水力(W)或吸油力(H)。
W或H=[(m2-m1)-m0(1-w))/ (m0(1-w)]
(1)
1.3.7 膳食纤维吸水膨胀力的测定[9]
取样品m0(小于1.0 g,水分为w)置于量筒中,记录样品体积v0(mL),在量筒中加入10 mL蒸馏水,充分振荡,室温下静置24 h,记录膨胀后体积v1(mL)。按式(2)计算膨胀力(S)。
S=(v1-vo)/[m0(1-w)]
(2)
1.3.8 膳食纤维胆固醇吸附能力的测定[9]
1.3.8.1 胆固醇标准曲线的制作
准确吸取0.25 mg/mL胆固醇标准溶液0、0.16、0.32、0.48、0.64、0.80 mL于比色管中,加入冰乙酸至0.80 mL,再依次加入1 mg/mL邻苯二甲醛0.4 mL及混合酸(冰乙酸∶浓硫酸=1∶1)8 mL,静置10 min,于550 nm处测定吸光值(y)。y与x(胆固醇的质量浓度,μg/mL)的关系曲线:y=0.000 4x-0.008 0,R2=0.997。
1.3.8.2 胆固醇吸附能力的测定
取鲜鸡蛋蛋黄,加入9倍蒸馏水搅打成乳液。取4份蛋黄乳液(各30 mL),其中2份加入样品(m0=1.0 g,水分为w),2份不加样品,搅拌均匀。分别调节pH 2.0、7.0,37 ℃振荡2 h后离心(4 000 r/min, 20 min);各吸取0.1 mL上清液,按1.3.8.1步骤加入试剂,静置后在550 nm处测吸光度,按标准曲线计算蛋黄中吸附前(m1)和吸附后(m2)的胆固醇量,按式(3)计算胆固醇吸附能力(D)。
D=(m1-m2)/[m0(1-w)]
(3)
1.3.9 膳食纤维与阳离子交换能力的测定[4]
取1.0 g(水分w)样品,加入30 mL 0.1mol/L HCl,常温静置24 h后过滤,用蒸馏水洗至中性,加入10% AgNO3溶液不产生沉淀(即不含氯离子)为止。60 ℃烘至恒重后,取0.25 g,加入100 mL 15%的NaCl,搅拌均匀,缓慢滴加0.01 mol/L NaOH,并记录NaOH加入量和pH的变化。
1.3.10 膳食纤维对羟自由基清除能力的测定[8]
分别取0.1、0.2、0.3、0.4、0.5 g样品,依次加入9 mmol/L水杨酸-乙醇0.5 mL、9 mmol/L FeSO40.5 mL、蒸馏水3.5 mL、88 mmol/L H2O25.0 mL,摇匀后离心(4 000 r/min ,20 min),取上清液,在510 nm波长下测吸光度值OD1;0.5 mL蒸馏水代替9 mmol/L FeSO4溶液测得吸光度值为OD2;蒸馏水代替样品为空白对照测OD3。按式(4)计算羟自由基清除率(R)。
R=[1-(OD1-OD2)/OD3]×100%
(4)
1.3.11 膳食纤维水溶液黏度的测定[8]
将质量浓度为10、20、50、100、150、200 mg/mL的样品水溶液,分别采用0.5号转筒,在750 r/min、剪切速率850 s-1的条件下测定黏度。
1.4 数据处理
每组实验重复测定3 次,结果以x±s(平均值±标准差)表示,用Origin 9.0 绘制图像,采用SPSS进行单因素方差分析进行差异显著性比较,P<0.05 为显著性差异。
2 结果与分析
2.1 水溶性大豆皮膳食纤维的单糖单元
纤维素(cellulose)是由D-葡萄糖单元通过β-1,4苷键连接组成、直链的大分子多糖。半纤维素是由多种单糖构成的、不均一,且大多带有短支链的复合聚糖,其主链糖基有D-葡萄糖糖基、D-木糖糖基、D-半乳糖糖基、L-阿拉伯糖糖基和D-甘露糖糖基等。由表3可知,SDF-1、SDF-2、SDF-3分子的单糖单元中均含有葡萄糖、木糖、半乳糖和果糖,SDF-1还含有阿拉伯糖,说明它们源于半纤维素和纤维素。从含量上看,SDF-1和SDF-3的葡萄糖、木糖、半乳糖比较接近,SDF-3的果糖含量明显高于SDF-1,达61.01%;SDF-2果糖含量最低,但葡萄糖含量最高,为41.09%,说明水溶性大豆皮膳食纤维杂多糖可能会存在果糖聚合的支链或片段。结果表明,3种分子质量水溶性大豆皮膳食纤维的单糖单元不同,含量也不同,会对其性质和功能产生影响。

表3 SDF-1、SDF-2、SDF-3的单糖单元及质量分数/%
2.2 水溶性大豆皮膳食纤维的分子官能团、三螺旋结构、结晶和热稳定性
从图1可见,3种分子质量水溶性大豆皮膳食纤维均存在有典型的糖类特征吸收峰。3 414 cm-1处的吸收峰说明含有羟基[10];2 920 cm-1处的吸收峰说明甲基和亚甲基存在[11];1 731 cm-1处的吸收峰说明含有醛基[12];1 612 cm-1吸收峰说明存在羧酸根离子[13,14];在1 415 cm-1出现吸收峰说明存在羰基[15];1 071 cm-1处的吸收峰说明存在醚键[16];在890 cm-1处的吸收峰,说明存在β-型糖苷键[17]。在840 cm-1处的吸收峰说明存在α-型糖苷键[18]。
表4数据表明,SDF-1、SDF-2和SDF-3与刚果红试剂形成了络合物,最大吸收波长发生明显的升高并出现峰值,说明它们均具有三螺旋结构存在[19,20],这是因为膳食纤维中纤维素的分子虽然没有支链,但分子中链与链之间可借助分子间氢键像麻绳一样拧紧的螺旋结构[21],并可形成一定的结晶。峰值过后,SDF-1和SDF-2随着NaOH浓度增大,最大吸收波长开始下降,这是因为过量的NaOH或在强碱环境下,破坏了与刚果红试剂的络合及三螺旋结构,部分结晶也会遭到破坏,向无规则线团链转化[22],甚至会使糖链降解。但SDF-3最大吸收波长基本没有变化,说明膳食纤维分子质量的大小会影响其螺旋结构的紧密。分子质量大,则分子中链与链之间形成三螺旋结构和相互缠绕的机会更多,且更加紧密,不易被破坏。

图1 SDF-1、SDF-2、SDF-3傅里叶红外光谱图
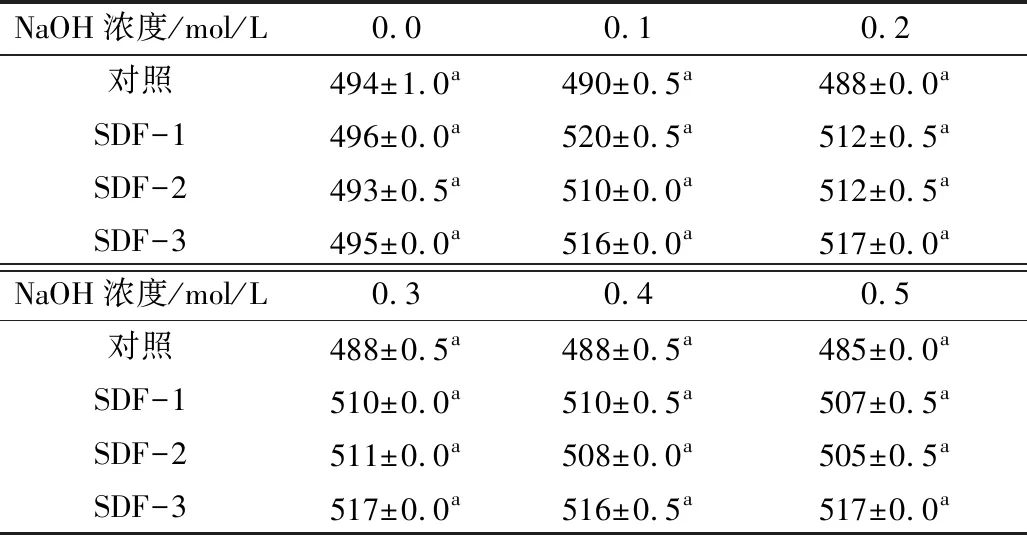
表4 SDF-1、SDF-2、SDF-3刚果红实验测定结果(最大吸收波长/nm)
由表5可见,SDF-2、SDF-3在17.36°存在一个弱衍射峰,即出现结晶区,而SDF-1没有出现衍射峰,属于无定形结构。说明分子质量大利于形成结晶,而SDF-1分子质量小,链短则链间利用氢键的形成的缠绕机会少且稳定性差,无法形成定型结构即结晶;SDF-2结晶区最大,可能与其葡萄糖单元含量最高,利于借助氢键形成链间稳定的螺旋缠绕[20]有关。同理,具有结晶和结晶区大的SDF-2的热稳定性也最强,见表6,而分子质量最小、无结晶的SDF-1的热稳定明显不如SDF-2和SDF-3。
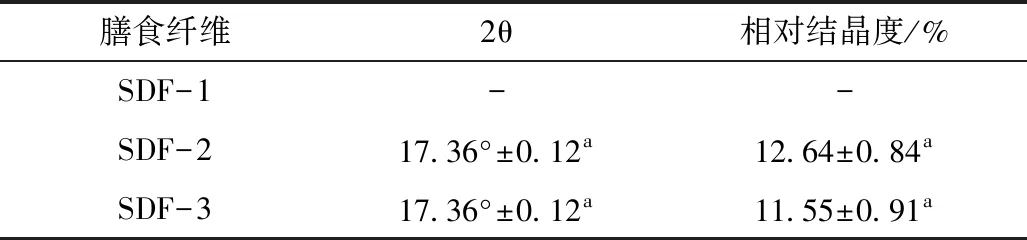
表5 SDF-1、SDF-2、SDF-3的X-衍射实验结果

表6 大豆皮水溶性膳食纤维的DSC分析结果
2.3 水溶性大豆皮膳食纤维性质
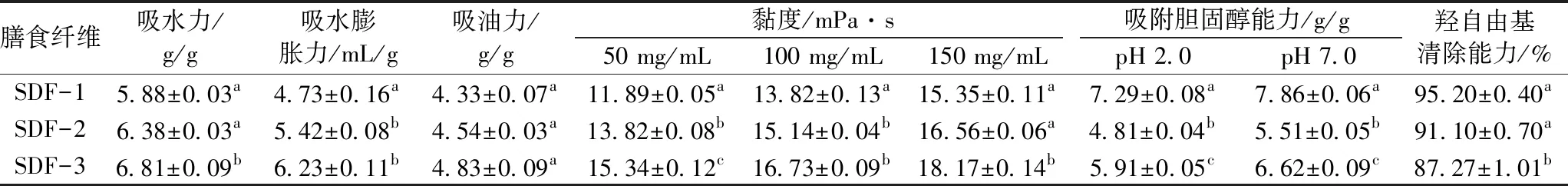
由表7可知,随着分子质量的增大,3种分子质量水溶性大豆皮膳食纤维的吸水力、吸水后的膨胀力、黏性增大,即SDF-1 当天然有机纤维与油料接触时,油分子首先通过物理作用附着在纤维和半纤维表面,然后通过毛细管作用进入纤维间隙,最后油分子聚集在纤维内部间隙里[24]。因此,3种分子质量水溶性大豆皮膳食纤维均具有吸附油脂的作用。但随着分子质量的增大,吸油量增大不明显,可能是由于静置时间仅1 h,物理吸附作用仅限于纤维表面,未能深入至纤维内部间隙中。 对于3种分子质量的水溶性大豆皮膳食纤维对阳离子的吸附作用比较来看,来源纤维素和半纤维素的SDF-1、SDF-2、SDF-3的分子中均含有较多羧酸根离子,明显表现出弱酸性,酸性多糖类膳食纤维具有较强的离子交换能力[25],即与阳离子螯合,呈现出一种能维持pH稳定的作用。从图2可见,随分子质量增大,弱酸性增强,因此,pH在碱性环境中上升也最慢,稳定作用最好。分子质量最小的SDF-1羧酸根离子相对少,但由于为无定形状态,羧酸根离子暴露容易,与阳离子螯合的空间障碍也小,因此,更容易与阳离子螯合并达到饱和,从而对维持pH稳定的作用有限。SDF-2、SDF-3分子质量大,羧酸根离子相对多,但因分子链间缠绕并形成部分结晶,须在NaOH浓度不断增大,使其缠绕和结晶被解析后,羧酸根离子逐步暴露,与阳离子螯合;另外,分子质量越大则空间障碍增大,也影响与与阳离子螯合,因此,随分子质量增大,膳食纤维与阳离子螯合不断随羧酸根离子的暴露而进行,从而起到维持pH稳定的作用。 图2 SDF-1、SDF-2、SDF-3的阳离子交换能力 由表7可见,3种分子质量水溶性大豆皮膳食纤维在pH2.0和7.0环境下,对胆固醇吸附能力均为SDF-1> SDF-3> SDF-2。膳食纤维对胆固醇吸附属于多层吸附,羰基是吸附胆固醇的活性基团[26],因此,纤维的孔密度和比表面积的大小,对吸附效果影响较大。分子质量小的SDF-1,比表面积最大,空间障碍最小,因此,吸附胆固醇的效果最好;SDF-3的吸附效果优于SDF-2,可能是同它们的单糖单元组成有关。由表2可知,葡萄糖、木糖、半乳糖、阿拉伯糖为醛糖,果糖为酮糖,SDF-2所含果糖含量最低,所具有的吸附胆固醇的活性羰基也最少,所以对胆固醇的吸附作用最小。 羟自由基由人体经过新陈代谢所产生,氧化能力很强,会引起组织细胞氧化损伤,从而导致机体膜过氧化和蛋白质交联变性等,对人体健康伤害较大。由表7可见,3种分子质量水溶性大豆皮膳食纤维对羟自由基的清除能力为SDF-1> SDF-2> SDF-3。膳食纤维多糖的羟基能够在氧化还原反应中提供电子或者氢原子[27],可终止氧化链反应,因此,3种分子质量膳食纤维均具有清除羟自由基的能力。 表7 SDF-1、SDF-2、SDF-3的性质测定结果 膳食纤维通过羧基与金属离子(阳离子)螯合[26],抑制了金属离子催化过氧化氢产生羟自由基的链反应,从而抑制了它在Fenton反应中的活性从而起到清除羟基自由基的作用[28]。从与阳离子交换能力来看,SDF-1能更易、更快地螯合金属离子(阳离子),另外,由X-射线衍射实验结果可以得知,SDF-1无结晶形态,属于无定形结构,羧基暴露多,空间障碍小,利于与羟自由基结合,所以大豆皮SDF表现出低分子质量组分清除能力显著好于高中分子质量组分现象,这与Kitts等[29]的研究一致。SDF-2和SDF-3,虽然分子质量较大,所含羧基更多,但因分子间缠绕更多、羧基无法暴露,空间障碍也大,因此,清除羟自由基的清除能力反而不如小分子质量的膳食纤维多糖。 本实验中水溶性大豆皮膳食纤维具有典型糖类结构特征基团,其分子借助氢键作用均可形成链间的三螺旋结构,且随分子质量增大,链间螺旋加缠绕更加紧密,可形成结晶部分,热稳定性也随之增强,分子质量最小的SDF-1,虽然分子间可以形成一定的三螺旋结构,但无法形成结晶。随分子质量增大,水溶性大豆皮膳食纤维中的羟基、羧基等极性基团增多,吸水力、吸油力、吸水膨胀力、黏度增大,与阳离子交换和清除羟自由基的能力减小。SDF-1因呈无定型状态,羧基等基团暴露充分、空间障碍小,与阳离子交换、清除羟自由基和吸附胆固醇的能力最强。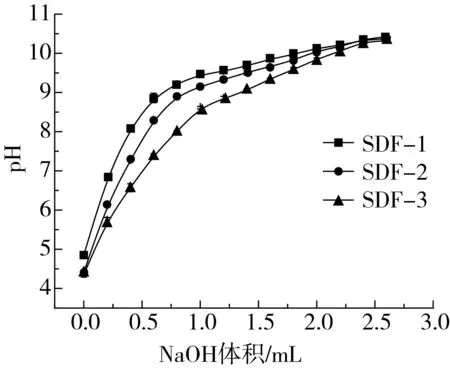
3 结论

