血清hs-CRP水平预测原发性高血压患者左心室肥厚的研究
申树娟
(郑州市金水区总医院内科,河南 郑州 450000)
原发性高血压(Essential hypertension,EH)是高血压的主要类型,多由遗传、环境因素诱发,占总高血压的95%以上。原发性高血压患者除了可引起高血压本身有关的症状以外,长期高血压还可成为多种心脑血管疾病的重要危险因素,并影响重要脏器如心、脑、肾的功能,最终可导致这些器官的功能衰竭。
随着病情进展,原发性高血压可导致心肌细胞肥大,引起左心室肥厚(Left ventricular hypertrophy,LVH)[1]。因此,LVH是EH的严重并发症之一。LVH是心血管疾病的独立危险因子,可导致冠状动脉血流储备下降,增加心肌耗氧量,进而诱发心肌缺血,且随病情进一步发展可引起严重的心律失常及心力衰竭,增加 EH患者不良预后风险。因此,早期明确EH患者LVH的发生情况,对指导早期对症干预,改善 EH预后尤为重要。
超敏 C反应蛋白(Hypersensitive C-reactive protein,hs-CRP)为机体组织损伤和全身炎症反应的标志物。研究发现,炎症反应所介导的内皮功能障碍是心血管事件发生的重要原因之一[2]。因此,结合血清hs-CRP水平与心血管事件的关系,推测血清hs-CRP水平可能对EH患者LVH的发生有一定预测价值。
鉴于此,本研究旨在探讨血清hs-CRP水平预测EH患者LVH发生的价值。
1 资料与方法
1.1 一般资料
经医院医学伦理委员会批准。选取2020年1月~2020年12月本院接收的80例EH患者作为研究对象,患者均签署知情同意书。
纳入标准:符合EH的诊断标准[3]。排除标准:既往心血管疾病史者;继发性高血压者;合并甲状腺疾病者;合并皮质醇增多症者;合并恶性肿瘤者。
1.2 方法
1.2.1 按照LVH分组
根据患者是否患LVH,将所有患者分为发生LVH组和未发生LVH组。
1.2.2 基线资料调查及实验室指标检查
(1)自制基线资料统计表,克伦巴赫系数α(Cronbach’s α)为 0.857,重测效度为 0.866,询问并记录EH患者相关基线资料,内容包括性别(男/女)、年龄、体重指数、病程、合并症[高脂血症(符合《中国慢性疾病防治基层医生诊疗手册—血脂异常防治》中相关标准)[4],糖尿病(符合《中国2型糖尿病防治指南(2013年版)》中相关标准)[5]]。
(2)实验室指标检查方法:患者入院后,抽取其空腹静脉血5 mL,以3000 rpm离心10 min分离出血清,血清尿酸水平以尿酸酶-过氧化物酶偶联法测定,血清hs-CRP水平以酶联免疫吸附法测定。
1.3 观察指标
1.3.1 LVH诊断
采用EPIQ 7C型超声诊断系统(飞利浦医疗)行超声心动图检测,连续检测3个心搏左室舒张末内径(Left ventricular end diastolic diameter,LVDd)、舒张末室间隔厚度(Left ventricular enddiastolic ventricular septal thickness,IVST)、舒张期左室后壁厚度(Posterior wall thickness,PWT)得出平均值,之后采用Deiereux的心室重量校正公式计算左心室重量,左心室重量=0.8×10.4×[(IVST+PWT+LVDd)3-LVDd3]+0.6,并进一步计算左心室重量指数(Left ventricular mass index,LVMI),LVMI=左心室重量/体表面积。当男性 LVMI>125g·m-2或女性 LVMI>120 g·m-2时,诊断为LVH。
1.3.2 EH患者发生LVH的影响因素
对比两组患者的基线资料调查及实验室指标检查,将对比有差异的病程、血清尿酸及hs-CRP水平作为自变量(连续变量,无需赋值),将EH患者的LVH发生状况作为因变量(1=发生,0=未发生),进行Logistic回归分析。OR> 1表示该变量可以促进LVH的发生,OR< 1表示该变量可以抑制LVH的发生。
1.3.3 LVH发生风险预测价值
绘制受试者工作曲线(Receiver operating characteristic curve,ROC),检验主要指标血清hs-CRP水平预测EH患者LVH发生风险的价值,以曲线下面积(Area Under Curve,AUC)评价,AUC≤0.50:无预测价值,0.50<AUC≤0.70:预测价值较低,0.70<AUC≤0.90:预测价值中等,AUC>0.90:预测价值较高。
1.4 统计学方法
所有数据采用SPSS 24.0软件进行统计学分析。计数资料以例数(%)表示,组间比较采用χ2检验;计量资料经正态分布检验后以均数±标准差(±SD)表示,组间用独立样本t检验.各指标与EH患者发生LVH的关系采用Logistic回归分析检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 EH患者LVH发生状况
纳入的80例EH患者中,有34例发生LVH,发生率为42.50%。
2.2 发生与未发生LVH的EH患者基线资料及主要实验室指标比较
发生LVH组病程长于未发生LVH组,血清尿酸及hs-CRP水平均高于未发生LVH组(P<0.05)。组间其他资料无明显差异(P>0.05)。见表1。
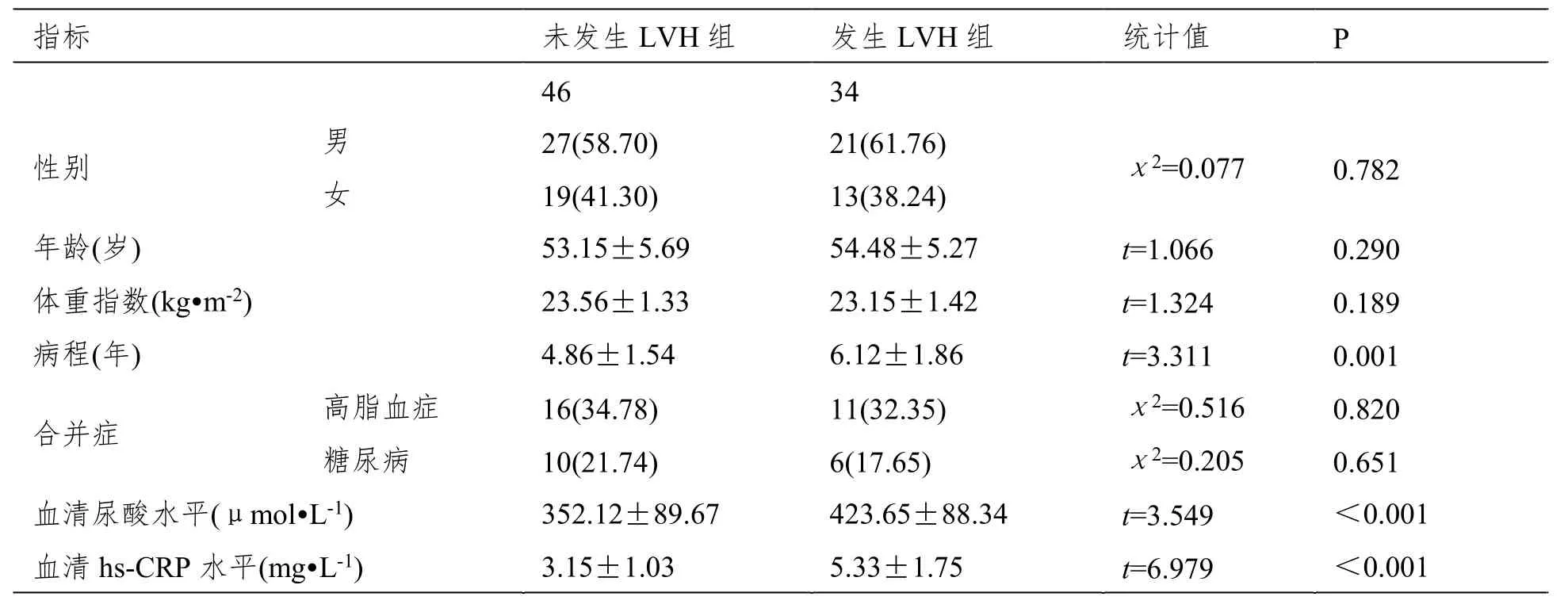
表1 发生与未发生LVH的EH患者基线资料及主要实验室指标比较
2.3 各指标与EH患者发生LVH的Logistic回归分析
结果显示,病程较长、血清尿酸及hs-CRP水平高与EH患者发生LVH有关(P<0.05)。见表2。

表2 各指标与EH患者发生LVH的Logistic回归分析结果
2.4 主要指标血清hs-CRP水平预测EH患者LVH发生风险的效能分析
将EH患者血清hs-CRP水平作为检验变量,将EH患者LVH发生状况作为状态变量(1=发生,0=未发生),绘制ROC曲线(见图1),结果显示,血清hs-CRP水平预测EH患者LVH发生风险的AUC 为 0.860(AUC 的 95%CI:0.773~0.947),预测价值较理想。在cut-off值为4.045(mg·L-1)下取敏感度和特异性,分别为0.882、0.739。

图1 hs-CRP水平预测EH患者LVH发生风险的ROC曲线图
3 讨论
LVH是EH的严重并发症之一,可导致冠状动脉血流储备下降,增加心肌耗氧量,进而诱发心肌缺血,且随病情进一步发展可引起严重的心律失常及心力衰竭,增加EH患者不良预后风险。因此,早期明确EH患者LVH的发生,对指导临床早期对症干预,改善EH患者预后尤为重要。
本研究结果显示,纳入的80例EH患者中,有34例发生LVH,发生率为42.50%。由此可见,探索可预测EH患者发生LVH的有效指标具有重要意义。研究指出,病程、尿酸与EH患者LVH的发生有关,且二者在本研究中也被证实与EH患者LVH的发生有关[6]。分析二者参与LVH发生机制为:病程较长的 EH患者由于外周血管阻力长期增加或血容量增加,导致左心室负荷较重,易引起代偿性增生,进而引发LVH。而因在尿酸形成过程中,伴有大量的过氧化氢、氧自由基等活性氧生成,这些活性氧可对内皮造成损伤,进而引起氧化应激,进而导致中性粒细胞炎性浸润,诱发炎症反应,刺激左心室使心肌肥大,进而引起LVH。但由于尿酸是嘌呤的最终代谢产物,嘌呤的摄入量对尿酸的检测水平有一定影响。因此血清尿酸水平受患者饮食的影响,在应用价值方面仍有局限,仍需进一步探索有效的预测指标。
hs-CRP是一种炎症因子,已被研究证实与血栓形成和动脉硬化病变有关,可增加EH患者心脏病、脑卒中发病率。本研究结果显示,发生LVH组血清hs-CRP水平均高于未发生LVH组,初步推测血清hs-CRP高表达可能与EH患者LVH的发生有关。
进一步经 Logistic回归分析,结果显示,血清hs-CRP水平高与EH患者发生LVH有关,分析hs-CRP导致EH发生LVH的可能机制为:hs-CRP在机体可与脂蛋白结合,使血管壁成分改变,对血管内皮造成损伤。而血管内皮受损后,hs-CRP可通过激活单核细胞,增加炎症介质分泌,如 C反应蛋白,其可对补体系统产生正反馈,加重内皮损伤程度[7]。同时,hs-CRP还可通过降低一氧化碳的生物效应,使鸟苷酸环化酶激活受抑制,进而导致舒缩张力紊乱,使血管收缩异常,导致心肌细胞肥大,引发LVH[8]。
此外,当一氧化碳受到抑制,还能够促进平滑肌细胞增殖,进而导致心肌肥厚,增加LVH发生风险。因此,当血清hs-CRP水平越高时,EH患者LVH发生风险越高。最后本研究对血清hs-CRP水平预测EH患者LVH发生风险绘制了ROC曲线,结果显示,血清hs-CRP水平预测EH患者LVH发生风险的AUC为0.860,预测价值较理想。
上述结果均提示,血清hs-CRP水平对EH患者LVH的发生有一定预测价值,未来临床可通过动态监测EH患者血清hs-CRP水平给予EH患者针对性的LVH防治措施,以延缓疾病进展,改善患者预后。
综上所述,血清hs-CRP水平对EH患者LVH的发生有一定预测价值,其高表达可能提示EH患者LVH的发生风险较高,临床可考虑通过定期检测EH患者血清hs-CRP水平给予对症干预。

