茶多酚对牛乳过敏原αs1-酪蛋白构象和抗原性的影响
郭红蕾,周胜云,丛艳君,*,闫文杰
(1.北京工商大学食品与健康学院,北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048;2.北京联合大学生物化学工程学院,北京 100023)
牛乳是国际公认的最常见的过敏性食物之一,牛乳过敏影响了全球2%~3%的幼儿,主要是一种免疫球蛋白E介导的超敏反应[1-2]。与婴儿和儿童相比,青少年和成人患病率更低,这是因为大多数儿童在达到学龄时都会产生耐受性,过敏发病率0.6%左右[3]。目前,牛乳过敏预防措施以避免摄入牛乳过敏原为主[4],研究有效的抗过敏方法很有必要。αs1-酪蛋白是牛乳中主要过敏原,研究αs1-酪蛋白构象与抗原性的关系具有重要意义[5]。
茶多酚是茶叶中所含的一类多羟基酚类化合物的总称,含量最多的是儿茶素类物质,约占茶多酚总量的60%~80%[6-7],并以4 种形式存在,分别为表儿茶素(epicatechin,EC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)及表没食子儿茶素(epigallocatechin,EGC)[8]。其中,EGCG含量约占儿茶素类物质总量的50%,并表现出很强的生物活性,EGC含量约占儿茶素类物质总量的15%~20%[9-11]。茶多酚具有提供质子的能力,具有极强的还原性,因此可以作为一种天然、高效的自由基清除剂,研究表明,茶多酚对人体健康也大有裨益[12-14],例如,其具有抗氧化、抗辐射、抗肿瘤、抑菌、增强机体抵抗力等多种生物活性,因此茶多酚被广泛应用于医药生产、日化、食品加工等领域[15-16]。
有研究表明,茶多酚含有很多活性位点,主要表现在与蛋白质的结合能力上,因此茶多酚和蛋白质的结合也是目前食品领域研究的热点[17]。利用茶多酚改善乳制品的功能特性和感官品质,也是基于茶多酚和乳蛋白的结合能力[18-23]。但是牛乳蛋白和茶多酚结合后,对过敏原的结构和抗原性的影响目前报道较少。本研究通过荧光光谱、同步荧光光谱、圆二色谱、间接竞争酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法及免疫印迹方法研究茶多酚中活性较高的EGCG和EGC对αs1-酪蛋白构象和抗原性的影响,揭示茶多酚的抗过敏机制。
1 材料与方法
1.1 材料与试剂
αs1-酪蛋白(纯度70%)、EGCG(纯度≥90%)、EGC(纯度≥90%)、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺、α-巯基乙醇、甘油、牛血清白蛋白、四甲基联苯胺(tetramethylbenzidine,TMB)、二甲基亚砜、氨基黑 美国Sigma公司;低分子质量标准蛋白 天根生化科技(北京)有限公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠免疫球蛋白G 北京友谊中联公司;抗血清(多克隆抗体)实验室自制;Tris、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、考马斯亮蓝、甲醇、醋酸、吐温-20、乙醇 国药集团化学试剂有限公司;浓盐酸 北京化学试剂公司;磷酸氢二钠、磷酸二氢钠、过氧化氢、碳酸氢钠 西陇化工股份有限公司。
1.2 仪器与设备
KHB ST-360酶标仪 上海科华实验系统有限公司;SHZ-C水浴恒温振荡器 上海龙跃仪器设备有限公司;BSA124S-CW电子天平 赛多利斯科学仪器(北京)有限公司;SH-2磁力搅拌器 北京东方开物科学器材有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;DYY-7C电泳仪 北京市六一仪器厂;CR22G离心机 日本Hitachi公司;F-7000荧光分光光度计日本日立公司;J-1500圆二色谱仪 日本Jasco公司。
1.3 方法
1.3.1 EGCG-αs1-酪蛋白、EGC-αs1-酪蛋白的制备
以0.1 mol/L、pH 7.0磷酸盐缓冲液(phosphate buffered saline,PBS)为溶剂,配制1 g/100 mLαs1-酪蛋白溶液、0.02 mol/L EGCG溶液,然后将二者等体积混合,分别于25、50、75、100 ℃温度下反应20 min,以不加EGCG的1 g/100 mLαs1-酪蛋白溶液为空白对照,反应结束后,将样品放置于4 ℃条件下用5 000 Da半透膜进行透析过夜,去除没有与αs1-酪蛋白结合的EGCG,样品置于-20 ℃冰箱中保存备用。
EGC-αs1-酪蛋白的制备方法同上。
1.3.2 荧光光谱和同步荧光光谱测定
通过荧光分光光度计检测EGCG和EGC与αs1-酪蛋白于不同条件下反应得到的产物荧光强度的变化情况。荧光分光光度计发射波长280 nm,扫描波长300~450 nm。同步扫描激发波长220 nm,扫描光谱280~400 nm,间距60 nm。同步扫描激发波长235 nm,扫描光谱250~400 nm,间距15 nm。
1.3.3 圆二色谱测定
用0.05 mol/L、pH 7.4 PBS将样品稀释至蛋白浓度1.0×10-6mol/L,25 ℃下测定其远紫外区的圆二色谱。每份样品测定6 次,取平均值。图谱经过仪器本底消除和溶液空白差减,利用杨氏算法得出αs1-酪蛋白、EGC-αs1-酪蛋白、EGCG-αs1-酪蛋白中α-螺旋、β-折叠、β-转角和无规卷曲等二级结构的含量。
1.3.4 抗αs1-酪蛋白多克隆抗体制备
参考Peng Juan[24]、Yeung[25]等的方法:取6 只体质量为20~25 g的C3H/He小鼠,将0.2 mL 0.5 mg/mL的αs1-酪蛋白与等体积的弗氏完全佐剂充分混合并乳化后,在小鼠背部皮下分6 点免疫;第22天,取0.1 mL 0.5 mg/mL的αs1-酪蛋白和等体积弗氏不完全佐剂乳化至混合物在水中不扩散,小鼠腹腔免疫;第36天,取0.1 mL 0.5 mg/mL的αs1-酪蛋白小鼠腹腔免疫;第50天,取0.2 mL 0.5 mg/mL的αs1-酪蛋白小鼠腹腔免疫;第60天,取6 只小鼠全血,离心制备血清备用。1 只未免疫的小鼠血清为阴性血清,作为对照。
1.3.5αs1-酪蛋白间接竞争ELISA抑制曲线的建立
优化酶标二抗稀释倍数、抗原稀释倍数、抗血清稀释倍数、包被抗原和抗血清反应温度和时间,在底物最佳反应条件基础上,按照间接竞争ELISA程序,于竞争抗原质量浓度0~1 400 ng/mL范围内建立间接竞争ELISA抑制曲线,作该质量浓度范围内的标准曲线。
在450 nm波长处用酶标仪读取光密度(OD450nm),根据OD450nm按照以下公式计算抑制率。

式中:B为梯度稀释的不同质量浓度αs1-酪蛋白作为竞争抗原测得的OD450nm;B0为无αs1-酪蛋白竞争体系测得的OD450nm;B1为未免疫小鼠血清作为一抗测得的OD450nm。
间接竞争ELISA步骤:以αs1-酪蛋白作为包被抗原,用0.05 mol/L、pH 9.6的碳酸盐缓冲液将αs1-酪蛋白稀释至5 μg/mL,100 μL/孔加入酶标板中,于4 ℃冰箱中过夜;αs1-酪蛋白抗原与一抗初级反应:在反应管中加入1∶1的αs1-酪蛋白抗原或待测样品(EGCG-αs1-酪蛋白和EGC-αs1-酪蛋白样品)和1∶4 000稀释的鼠多抗,不加αs1-酪蛋白抗原或样品的反应管作为无竞争反应体系,4 ℃冰箱中反应12 h;之后倾去酶标板孔内液体,用200 μL/孔PBST洗板3 次,每次5 min,甩干;加入添加1 g/100 mL牛血清白蛋白(bovine serum albumin,BSA)的PBST封闭液进行封闭,每孔100 μL,37 ℃放置1 h,200 μL/孔PBST洗板3 次,每次5 min,甩干;将抗原与一抗混合物以100 μL/孔加入酶标板内,于37 ℃温育2 h;用PBST洗板4 次,200 μL/孔,每次5 min,甩干;用含1 g/100 mL BSA的PBST将HRP-羊抗鼠IgG稀释5 000 倍,以100 μL/孔加入,加盖37 ℃反应1 h;用200 μL/孔PBST洗板3 次,200 μL/孔双蒸水洗板2 次,每次5 min,甩干;加入新鲜配制的TMB应用液100 μL/孔,常温暗处反应25 min,显示蓝色;加入50 μL/孔2 mol/L硫酸终止反应,颜色由蓝变黄,用酶标仪测定OD450nm[26-29]。
1.3.6 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析
12.5%分离胶、4.5%浓缩胶、胶联度为3.6%,进行垂直电泳,单板恒流10 mA。具体步骤为:αs1-酪蛋白抗原或样品溶液与电泳稀释液以体积比3∶1的比例混合,于沸水浴处理5 min,上样量10 μL。电泳结束后的分离胶用考马斯亮蓝R-250染色15 min,显现蛋白条带,以低相对分子质量标准蛋白为标准,用凝胶成像系统分析其相对分子质量。
1.3.7 免疫印迹鉴定
首先进行SDS-PAGE,然后将胶上的蛋白转印到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,将膜用加样梳、铅笔作标记,将PVDF膜剪裁,与SDSPAGE凝胶中分离胶大小一样,再将PVDF膜、滤纸和海绵一同浸泡于电极缓冲液(含20%甲醇的Tris缓冲溶液)中30~60 min。将电泳完毕的SDS-PAGE分离胶取下,放入电转缓冲液中平衡20~30 min,在干净、平整的实验台上按以下顺序从正极到负极铺于凝胶夹上:凝胶夹板→海绵→3 层滤纸→PVDF膜→凝胶→3 层滤纸→海绵→凝胶夹板(此过程中应避免气泡产生,用光滑的玻璃棒从一侧向另一侧慢慢滚动,赶出气泡),夹紧“凝胶三明治”插入转移电泳槽,灌满缓冲液。将PVDF膜端靠近正极,凝胶面靠近负极,打开电源,定流192 mA,电转移4.0 h。转印后的PVDF膜一式两份,1 份用氨基黑10B溶液染色5 min,脱色5 min,观察转印效果及蛋白质位置,另1 份用于免疫印迹。
将转印后的PVDF膜于大小合适的平皿中用dH2O洗涤5 min,再用TBST溶液(添加体积分数0.05%吐温-20的pH 7.4 Tris缓冲溶液)于37 ℃下漂洗4 次,每次15 min。加入10~20 mL封闭液平皿中,于37 ℃下孵育1 h,封闭PVDF膜,然后用dH2O洗涤5 min。将PVDF膜与1∶4 000稀释的多抗于37 ℃孵育2 h,再用dH2O洗涤5 min,用TBST溶液洗涤3 次,每次10 min。将PVDF膜与HRP标记羊抗鼠二抗(1∶5 000稀释)于37 ℃孵育1 h,再用dH2O洗涤5 min,TBST溶液洗涤3 次,每次10 min。将漂洗后的PVDF膜浸没在新鲜配制的0.05 mol/L 4-氯-1-萘酚底物溶液中,显色(37 ℃、35~40 min),待蛋白带显色清晰,即可用dH2O漂洗,终止反应。用dH2O冲净PVDF膜,置于双层滤纸中风干保存[30-31]。
1.4 数据处理
所有实验均做3 个平行,3 次重复。用Excel 2013软件绘制图表,SPSS 17.0软件进行数据分析,采用Duncan’s multiple range test方法进行显著性分析。
2 结果与分析
2.1 荧光光谱和同步荧光光谱分析结果
由图1可知,经EGC和EGCG处理的αs1-酪蛋白的荧光发射强度有所减弱,EGC和EGCG均对αs1-酪蛋白内部荧光有猝灭作用,EGCG几乎完全猝灭αs1-酪蛋白的内部荧光,EGC对αs1-酪蛋白内部荧光的猝灭效率低于EGCG。表明EGC和EGCG分别与αs1-酪蛋白相互结合,覆盖在αs1-酪蛋白的表面。

图1 EGC和EGCG对αs1-酪蛋白的荧光猝灭图谱Fig. 1 Fluorescence quenching effect of EGC and EGCG on αs1-casein
为深入探究αs1-酪蛋白与EGCG、EGC结合前后蛋白构象的变化,进一步通过同步荧光光谱进行分析。从同步荧光光谱图中可获得生色基团分子周围的结构情况。αs1-酪蛋白的荧光主要来自酪氨酸(tyrosine,Tyr)、色氨酸(tryptophan,Trp)和苯丙氨酸(phenylalanine,Phe)。当Δλ=15 nm时,只能得出Tyr荧光的特征光谱;当Δλ=60 nm时,只能得出Trp荧光的特征光谱,因此可以通过发射波长和扫描波长范围的改变推断Tyr和Trp残基周围结构的变化情况,进而推断出αs1-酪蛋白构象的变化[32]。
由图2可知,经EGC和EGCG处理的αs1-酪蛋白中Tyr的荧光发射强度有所降低,其最大发射峰发生蓝移(分别为2、5 nm),说明EGC和EGCG与αs1-酪蛋白结合后对αs1-酪蛋白中Tyr残基的周围结构有影响。且与αs1-酪蛋白结合后,EGCG相比EGC对αs1-酪蛋白中Tyr残基周围环境的影响更大。
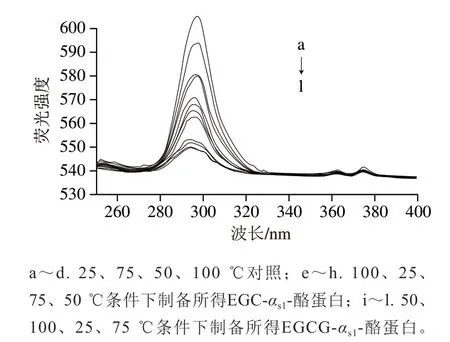
图2 EGCG和EGC结合αs1-酪蛋白在Δλ=15 nm时的同步荧光图谱Fig. 2 Synchronous fluorescence spectra of interaction of αs1-casein with EGCG and EGC at Δλ = 15 nm
由图3可知,经EGC和EGCG处理的αs1-酪蛋白中Trp的荧光发射强度有所降低,其最大发射峰发生红移(分别为1、2 nm),说明EGC和EGCG与αs1-酪蛋白结合后对αs1-酪蛋白中Trp残基的周围结构有影响。且与αs1-酪蛋白结合后,EGCG相比EGC对αs1-酪蛋白中Trp残基周围环境的影响更大。

图3 EGCG和EGC结合αs1-酪蛋白在Δλ=60 nm的同步荧光图谱Fig. 3 Synchronous fluorescence spectra of interaction of αs1-casein with EGCG and EGC at Δλ = 60 nm
荧光光谱和同步荧光光谱结果表明,随着EGCG和EGC与αs1-酪蛋白的结合,αs1-酪蛋白发光基团的荧光强度有所降低。EGCG和EGC结合到αs1-酪蛋白上对αs1-酪蛋白的Tyr和Trp残基均有影响,推测EGCG和EGC与αs1-酪蛋白的Tyr和Trp残基本身结合或者与Tyr和Trp附近的结构相结合[33],同时,其对Trp残基的影响强于Tyr残基,但是具体的结合位置需要深入探究。
2.2 圆二色谱分析结果
蛋白质的二级结构有α-螺旋、β-折叠、β-转角和无规卷曲4 种类型,不同类型所产生圆二色谱带吸收的位置和强弱不同。圆二色谱中,192 nm波长附近α-螺旋结构有1 个正特征峰谱带,波长208、222 nm附近有2 个负谱带,同时在波长222 nm附近的摩尔椭圆度(θ)绝对值越大,则蛋白中α-螺旋结构也越多;波长185~200 nm附近β-折叠有1 个正峰,波长216 nm附近有1 个负峰;波长206 nm附近β-转角有1 个正峰。因此,可以通过分析蛋白质样品的圆二色谱图,推测其二级结构组成。
由图4~5可知:样品的圆二色谱显示,在208~212 nm和218~222 nm附近有峰存在,这是α-螺旋结构的典型特征,说明有α-螺旋产生;在波长224~230 nm附近有微弱且较宽的谱带,说明存在β-折叠或富含L-脯氨酸序列的区域。EGCG-αs1-酪蛋白复合物和EGC-αs1-酪蛋白复合物在波长222 nm附近的θ绝对值比天然αs1-酪蛋白略大,表明EGCG和EGC结合αs1-酪蛋白后,αs1-酪蛋白中α-螺旋结构可能有所增加。整体而言,与天然αs1-酪蛋白的圆二色谱相比,EGCG-αs1-酪蛋白复合物的圆二色谱曲线变化比EGC-αs1-酪蛋白略大,表明EGCG结合后对αs1-酪蛋白二级结构的影响比EGC明显。
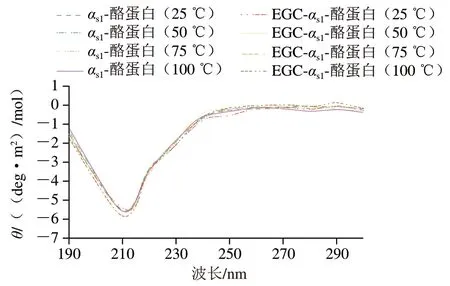
图4 不同处理的αs1-酪蛋白和EGC-αs1-酪蛋白的圆二色谱Fig. 4 CD spectra of free αs1-casein and EGC-αs1-casein
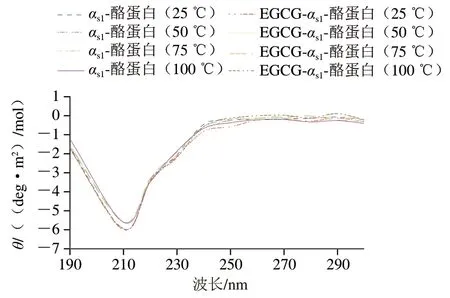
图5 不同处理的αs1-酪蛋白和EGCG-αs1-酪蛋白的圆二色谱Fig. 5 CD spectra of free αs1-casein and EGCG-αs1-casein
由表1可知,αs1-酪蛋白结合EGC和EGCG后其构象均有变化,α-螺旋和β-折叠含量略有增加,无规卷曲含量略有降低,并且EGCG对αs1-酪蛋白二级结构的影响比EGC略大。但是,EGC-αs1-酪蛋白和EGCG-αs1-酪蛋白较αs1-酪蛋白的二级结构变化并不显著。然而,因圆二色谱分析结果算法较多,且算法原理不同,导致结果有较大差异,圆二色谱的分析结果只能作为参考。Hasni等[34]发现,茶多酚的结合改变了牛乳酪蛋白的二级结构,导致无规卷曲和β-转角数量增加,而α-螺旋和β-折叠数量减少。

表1 αs1-酪蛋白、EGCG-αs1-酪蛋白和EGC-αs1-酪蛋白的二级结构含量Table 1 Secondary structure composition of free αs1-casein, EGCG-αs1-casein and EGC-αs1-casein %
2.3 αs1-酪蛋白间接竞争ELISA竞争抑制曲线
为进一步研究茶多酚对αs1-酪蛋白抗原性的影响,建立αs1-酪蛋白间接竞争ELISA方法。优化条件为酶标二抗稀释倍数1∶5 000、抗原稀释为质量浓度5 μg/mL、抗血清稀释倍数1∶4 000,包被抗原和抗血清37 ℃条件下反应2 h,底物最适反应条件为25 ℃、25 min。基于优化结果,绘制间接竞争ELISA抑制曲线。由图6可知,竞争抗原(αs1-酪蛋白)质量浓度0~1 400 ng/mL范围内,抑制率与竞争抗原质量浓度具有较好的线性关系,曲线方程为y=-0.019 5x+93.938 0(R2=0.989 2)。
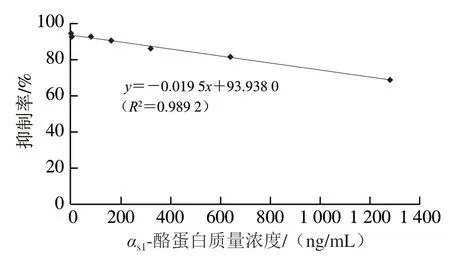
图6 αs1-酪蛋白间接竞争ELISA竞争抑制曲线Fig. 6 Competitive inhibition curve of ic-ELISA for αs1-casein
2.4 间接竞争ELISA检测结果
通过间接竞争ELISA检测不同反应温度下得到的EGCG-αs1-酪蛋白、EGC-αs1-酪蛋白复合物的αs1-酪蛋白残留量。由图7可知,αs1-酪蛋白与EGCG分别于25、50、75、100 ℃反应20 min,所得复合物的αs1-酪蛋白残留量差异极显著(P<0.01),其中αs1-酪蛋白残留量最高的条件为25 ℃处理20 min,为(3 720.39±0.93) ng/mL,残留量最低的条件为100 ℃处理20 min,为(3 589.72±0.61) ng/mL。αs1-酪蛋白与EGC分别于25、50、75、100 ℃反应20 min,所得复合物的αs1-酪蛋白残留量差异极显著(P<0.01),其中αs1-酪蛋白残留量最高的条件为25 ℃处理20 min,为(3 979.27±0.97) ng/mL,残留量最低的条件为100 ℃处理20 min,为(3 895.44±1.53) ng/mL。另外,αs1-酪蛋白分别与EGCG、EGC于25、50、75、100 ℃反应20 min,所得复合物的αs1-酪蛋白残留量差异均极显著(P<0.01),并且其中αs1-酪蛋白残留量最低的条件均为与EGCG发生反应,分别为(3 720.39±1.04)、(3 643.96±0.49)、(3 710.53±0.93)、(3 589.72±0.61)ng/mL,未经茶多酚处理的αs1-酪蛋白残留量最高。因此可以得出,αs1-酪蛋白经EGCG和EGC接枝后,其免疫原性减弱。
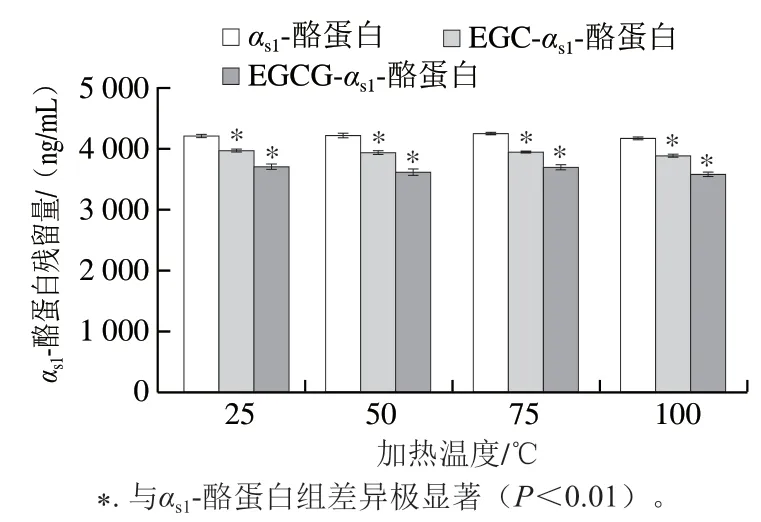
图7 EGCG和EGC对αs1-酪蛋白残留量的影响Fig. 7 Effects of EGCG and EGC on the residual quantity of αs1-casein
茶多酚与牛乳蛋白可通过氢键、疏水键和范德华力等结合,形成多酚-蛋白质偶联物[35]。因此推测本研究EGCG、EGC与αs1-酪蛋白结合后,可能修饰了αs1-酪蛋白作用表位的氨基酸结构,进而降低了免疫原性。吴序栎[36]通过EGCG和EGC接枝β-乳球蛋白,结果显示,β-乳球蛋白分别与EGCG、EGC结合后,二者与多克隆抗体的结合能力均有所降低,且EGCG的效果比EGC明显,与本研究结论较一致。
2.5 SDS-PAGE结果
由图8可知,αs1-酪蛋白分别与EGCG和EGC于不同温度下反应相同时间,得到的复合物分子质量没有变化,这与EGCG和EGC为小分子化合物有关。

图8 茶多酚接枝αs1-酪蛋白电泳图Fig. 8 Electrophoretogram of αs1- casein grafted with tea polyphenols
2.6 免疫印迹鉴定结果
由图9可知,阴性血清与经茶多酚接枝后的αs1-酪蛋白未发生反应,表明小鼠多克隆抗体与经茶多酚接枝后的αs1-酪蛋白发生特异性免疫反应。

图9 αs1-酪蛋白及其复合物免疫印迹谱图Fig. 9 Western blot patterns of αs1-casein and its complexes
3 结 论
茶多酚中的EGCG、EGC与αs1-酪蛋白接枝后,对αs1-酪蛋白内部荧光有猝灭作用,与EGCG相比,EGC对αs1-酪蛋白内部荧光的猝灭效率低于EGCG;对αs1-酪蛋白的Tyr和Trp残基均有影响,对Trp残基荧光的影响强于Tyr残基,但是具体的结合位置需要深入研究;αs1-酪蛋白的α-螺旋和β-折叠含量略有增加,无规卷曲含量略有降低。间接竞争ELISA方法发现,EGCG、EGC均使αs1-酪蛋白的抗原性显著降低,但是免疫印迹实验中小鼠多克隆抗体依然与EGCG-αs1-酪蛋白、EGC-αs1-酪蛋白复合物发生特异性免疫反应,建议进一步通过动物实验揭示其致敏机制。本研究结论可以为低致敏乳制品开发提供重要的理论依据和思路。

