计算机软件模拟α-乳白蛋白与皂苷的分子对接
胡嘉伦,姜瞻梅
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
皂苷是在许多植物中发现的次生化合物,在肥皂水等溶液中形成稳定的泡沫,因此得名“皂苷”。皂苷广泛分布于中药植物和一些海洋动物中,含有多种生物活性物质,这些物质是由三萜或非极性甾体苷元通过糖苷醚或酯键连接到亲水寡糖的一个或多个部分组成的[1]。皂苷的分类方法有很多种,根据皂苷配基的结构将皂苷分为甾体皂苷和三萜皂苷。甾体皂苷大部分由27 个碳原子组成,其配基是螺甾烷的衍生物,主要存在于豆科、远志科、天南星科等植物中;三萜皂苷大部分由30 个碳原子组成,其配基为三萜的衍生物,主要存在于薯蓣科、百合科等植物中。皂苷具有多种药理作用,包括保护心脑血管疾病、抗炎、抗病毒、免疫调节等[2]。此外,最近有研究报道称,皂苷分子可以通过诱导细胞凋亡或促进细胞分化来减轻化疗后的副作用[3]。
α-乳白蛋白(α-lactalbumin,α-LA)是乳清蛋白中的一种重要蛋白质,占乳清蛋白总量的20%~25%。作为一种钙结合蛋白,α-LA广泛分布于人类和其他哺乳动物的乳中,在牛乳中的质量浓度为1.0~1.5 g/L(约占牛乳总蛋白的3.4%)[4]。除此之外,α-LA作为一种球状蛋白,主要含有α-螺旋结构,包括4 个主要的α-螺旋和3 个小的β-折叠。α-LA由于其高营养价值、功能特性和高生物相容性,在食品工业加工中发挥着关键作用[5]。
分子对接是运用计算机技术和理论模型相结合,在线上对分子间的结合过程进行模拟,将小分子和蛋白质的作用结果直观展现出来。分子对接原理主要基于受体理论(“锁钥模型”)和“契合学说”[6]。分子对接技术通过不断优化小分子化合物的空间位置、构象、分子可旋转的二面角和受体氨基酸残基侧链和骨架,根据软件相应的打分函数,筛选出小分子与靶向大分子结合的最佳构象并进行分析[7]。目前,分子对接技术可以直观反映配体与受体的相互作用信息,已发展成为一种预测分子间相互作用结合位点的新方法。Chen Wei等[8]比较α-LA与3 种脂溶性维生素的相互作用,并利用分子对接技术说明其作用机理;Bagheri等[9]通过荧光光谱法、紫外可见光谱法、傅里叶变换红外光谱法和分子建模法研究α-LA与索拉非尼相互作用时的结合特性和构象变化;Shi Ruijie等[10]通过多光谱分析,结合计算机模拟方法,阐明了α-LA和甘草酸在中性和酸性条件下被静态猝灭,同时结合亲和力的递减顺序为pH 7.0>4.5>2.5;同时,Shi Ruijie等[11]还采用多光谱、分子对接和分子动力学模拟等方法,系统研究了α-LA与甘草酸和人参皂苷在pH 7.0条件下的结合行为机制和发泡性能。
近年来,α-LA由于其特有的空间构象引起各国学者关注。皂苷与蛋白质的相互作用可以改变食品的发泡和乳化能力、使溶液形式发生变化、增加蛋白质变性等。与蛋白质发生以上反应是因为皂苷中存在各种不同基团。同时,皂苷对蛋白质不同的作用取决于蛋白质中不同的空间结构和氨基酸组成。皂苷小分子与蛋白之间的相互作用可能是由于疏水键、氢键、分子间作用力等或几种作用力的共同作用。正常小分子进入体内以游离态存在,与靶细胞结合后发挥作用。而皂苷属于结合能力较弱的药物小分子,因此,将皂苷包埋在蛋白里可以有效减少皂苷小分子的游离,使其到达靶细胞处释放,提高其药效,实现了蛋白与结合态及游离态皂苷的动态平衡。本研究主要利用计算机分子模拟技术,在“锁钥模型”和结合能量最优理论基础上,探究不同皂苷小分子与α-LA的相互作用。通过对皂苷小分子和α-LA进行模拟分子对接,利用对接软件SYBYL可以更加全面、清晰地了解二者相互作用的状态。部分皂苷可以明显猝灭蛋白的内源荧光,从而导致发色团周围的疏水性减弱、部分肽链延伸、分子极性增强等。除此之外,通过模拟对接的情况,将对接结果与目前成熟的研究结果对比,可以更加深入讨论不同小分子与蛋白质之间相互作用的热力学本质,进一步探究皂苷小分子的结构及其猝灭蛋白发光基团荧光之间的规律。
1 材料与方法
1.1 结构查询
人参皂苷Rb1、酸枣仁皂苷A、绞股蓝皂苷、大豆皂苷Ⅰ、三七皂苷R1、苜蓿皂苷P1、白头翁皂苷D、山茶花皂苷C2的分子结构由有机小分子生物活性数据库(PubChem)获得;α-LA的三维结构由蛋白质结构数据库(PDB)获得。
1.2 实验软件
本研究采用Sybyl 2.0模拟软件运算药物小分子皂苷与α-LA的可视化对接。生物蛋白受体与小分子相互结合时,通常使用方法为计算机分子模拟(Sybyl 2.0版本),包括“计算化学”和“分子模拟”,Sybyl可以研究大分子或小分子的结构性能。除此之外,Sybyl中的Surflex-Dock对接模式,可以更好地针对分子的柔性状态进行限制性对接。在分子模拟中,蛋白活性位点口袋通过利用Protomol(原型分子)标记。原型分子是在形状和性能方面能够与受体蛋白的结合口袋较好匹配的臆想分子结构。如果蛋白质中有配体小分子,可以通过小分子来确定结合口袋;如果没有已知小分子,则可通过软件自动搜索或通过文献确定蛋白质活性口袋中的关键残基,从而分析对接信息。
1.3 分子对接
1.3.1 皂苷单体的结构查询
打开PubChem后,输入对应皂苷的编号(人参皂苷CID 9898279、大豆皂苷CID 122097、三七皂苷CID 449134、苜蓿皂苷CID 190920、白头翁皂苷CID 11650910、山茶花皂苷CID 44202125、绞股蓝皂苷CID 102600811、酸枣仁皂苷CID 51346169),在PubChem下载这些小分子的二维结构后,另存为PDB模式,运行Sybyl对小分子进行优化处理后保存。
1.3.2α-LA的结构查询
打开PDB后,输入α-LA的编号(ID:1F6S,牛源),在PDB将其三维结构下载后,用Sybyl进行加氢、去金属离子、去水分子等预处理后保存。
1.3.3 皂苷与α-LA的分子对接
利用Sybyl中Surflex-Dock模块进行对接。在Sybyl中输入蛋白结构与皂苷结构后运行此模块,将蛋白与皂苷分子进行整合,通过Surflex-Dock的精确对接程序运算,对接后的蛋白与皂苷分子的结构将显示在Sybyl界面,并出现一系列Surflex-Dock打分。
将对接好的结果导入Pymol和Ligplot软件中,进行角度的旋转、键长键能的显示、结构的美化等一系列处理后保存,得到最终的可视化处理结果。分子对接流程示意图如图1所示。
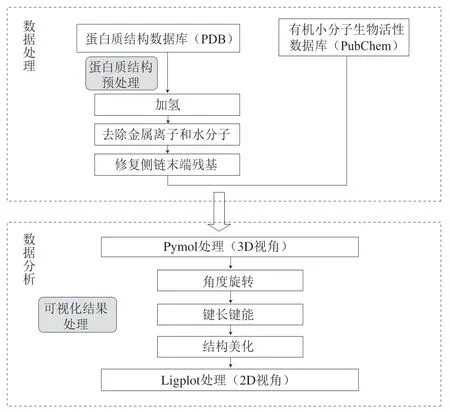
图1 分子对接流程示意图Fig. 1 Schematic diagram of the molecular docking process
2 结果与分析
2.1 α-LA的预处理
在计算分子模拟对接过程中,受体物质(蛋白质)的预处理一般包括如下几个方面:1)根据能量最低原则和蛋白分子与皂苷小分子几何互补的评价标准来筛选蛋白活性口袋;2)通过Sybyl确定蛋白质与皂苷分子的高精确结合模式;3)通过Sybyl上的动力学模块对受体蛋白进行预处理,如去配体、加磁场、能量优化等。除此之外,通过软件的柔性对接方法可以让蛋白质氨基酸残基的侧链和骨架在某一程度上发生改变[12]。具体如图2所示。
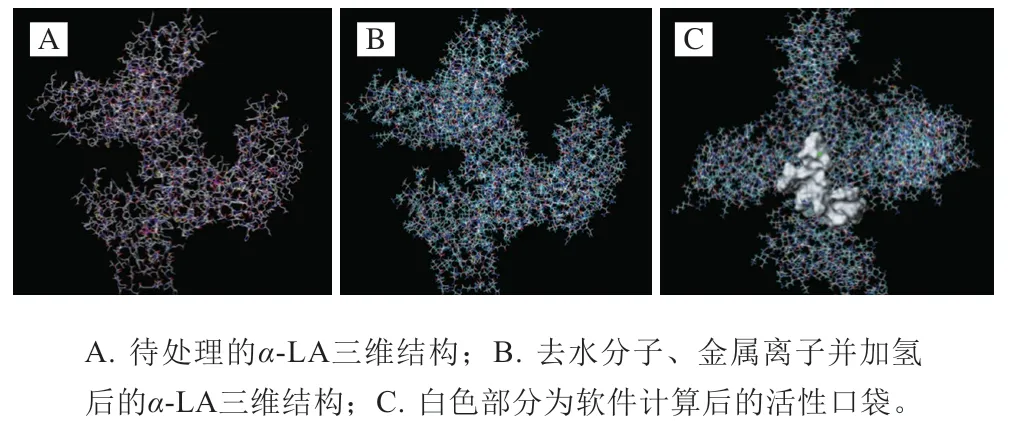
图2 导入处理的α-LA结构Fig. 2 Three-dimensional structure of α-LA before and after pretreatment
2.2 皂苷小分子的预处理及Surflex-Dock打分
当利用分子模拟软件Sybyl对蛋白质和小分子进行对接时,软件会选择结构最佳的小分子进行对接。由于程序运算和寻找的方式具有随机性,在Sybyl对接模块中,程序会根据药物分子结构的能量模式是否与蛋白质进行最优结合进行打分。因此,在对接前需将药物小分子皂苷进行能量最小化处理。Surflex-Dock的对接结果以打分形式表现。总分显示了二者对接结果的好坏;配体和受体之间的不适当渗透一般为负值,接近零更好;二者形成的复合物中的氢键作用和静电作用,分数越高,作用越强。由表1可知,大豆皂苷Ⅰ、苜蓿皂苷P1、酸枣仁皂苷A和人参皂苷Rb1与α-LA亲和力较强,结合程度相对较好,且它们与α-LA之间形成的氢键作用和静电作用较强。
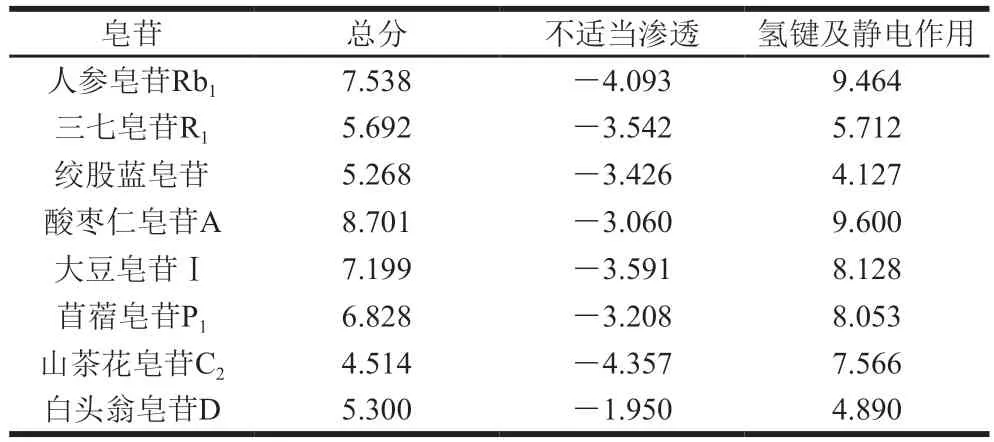
表1 Surflex-Dock对接结果打分Table 1 Results of Surflex-Dock docking
除此之外,运用Pymol和Ligplot将对接结果进行可视化处理。
2.3 达玛烷型三萜皂苷与α-LA间相互作用
达玛烷型皂苷为四环三萜型皂苷,其结构由全椅式构象从环氧鲨烯形成达玛烷骨架,羟基取代在C3、C12、C20位,β-构型的角甲基存在于C8位。除此之外,β-H连在C13位,β-CH连在C10位,β-侧链在C17位。现有的研究表明,达玛烷型皂苷可有效预防和治疗糖尿病[13]。人参皂苷Rb1是含有4 种糖的人参三醇,可以改善新生幼鼠的肺损伤[14],其结构式如图3A所示;三七皂苷R1是从三七中分离得到的主要成分,具有抗炎等作用[15],其结构式如图3B所示;绞股蓝皂苷具有多种生物活性,如抗脂质活性、抗炎、预防心脑血管疾病[16]等功能,其结构式如图3C所示;酸枣仁皂苷A是从酸枣仁中提取的一种中草药活性成分,其在痴呆小鼠模型中具有神经保护作用,可以对抗氧化应激[17],其结构式如图3D所示。


图3 不同达玛烷型皂苷的分子结构Fig. 3 Structures of different dammarane-type saponins
人参皂苷Rb1、三七皂苷R1、绞股蓝皂苷和酸枣仁皂苷A与α-LA的相互作用过程中,二者之间相互作用模式和在结合过程中涉及的主要氨基酸残基分别如图4~5所示,疏水作用和氢键参与了达玛烷型皂苷与α-LA之间的相互作用。
由图4A和5A可知,Leu105、Ala106、Thr33、Val142、Gly35、Ser34、Phe31、Leu110和Ala109参与了人参皂苷Rb1与α-LA结合时的疏水作用。人参皂苷Rb1与His32上的羰基、Arg10上的氨基、Lys122上的羰基、Lys13上的氨基相结合,共形成6 个氢键,这是维持二者之间稳定结合的重要作用力,左天等[18]也通过分子模拟手段证明人参皂苷分子与蛋白质活性口袋内的氨基酸残基可以通过疏水作用、氢键作用及静电作用结合。由图4B和5B可知,氨基酸残基Ser34、Asp37、Gly37、Ala106、Thr33、Leu105、Trp104、Tyr103、Phe53、Glu49、Gln54、Val42和Ala140参与了三七皂苷R1与α-LA相互结合的疏水作用。三七皂苷R1与Ile41上的氨基和羰基、Phe31和His32上的羰基相结合,形成的3 个氢键维持二者的稳定结合。由图4C和5C可知,绞股蓝皂苷与Leu105、Ala109、His32和Phe31上的羰基相结合,形成4 个氢键,维持二者之间的稳定结合。何丽君等[19]通过荧光光谱方法证明绞股蓝皂苷与牛血清白蛋白主要靠疏水作用和静电引力结合,与计算机模拟结果相似。由图4D和5D可知,酸枣仁皂苷A与Phe31上的羰基、Gly35上的羰基、Lys98上的氨基、Ile41上的氨基和羰基相结合,共形成7 个氢键,使酸枣仁皂苷A与α-LA稳定结合。

图4 经过Pymol可视化处理后达玛烷型皂苷与α-LA相互作用细节图Fig. 4 Schematic of the interaction between dammarane-type saponins and α-LA after Pymol visualization
由上述4 种皂苷与α-LA相互作用的比较可知,达玛烷型皂苷与α-LA复合物的主要相互作用力为疏水相互作用和氢键作用,范德华力微弱。α-LA中氨基酸残基Ser34、Gly35、Thr33、Glu49、Gln54、Val42和苯丙氨酸(Phe)、亮氨酸(Leu)和丙氨酸(Ala)最容易形成疏水口袋,Ile41、Phe31、His32和赖氨酸(Lys)容易与小分子皂苷形成氢键。
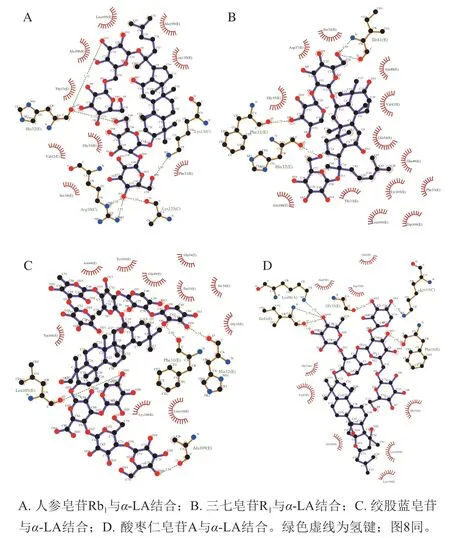
图5 Ligplot显示达玛烷型皂苷与α-LA相互作用的二维平面图Fig. 5 Two-dimensional plot of the interaction between dammaranetype saponins and α-LA
2.4 齐墩果烷型五环三萜皂苷与α-LA间相互作用
齐墩果烷型又称β-香树脂烷型,其基本骨架为多氢蒎的五环母核。A/B、B/C、C/D为反式,D/E为顺式,有8 个甲基存在其母核上,11位和12位一般为双键。大豆皂苷是近些年才被人们所熟知的皂苷,因其具有明显的溶血作用而被视为抗营养因子[20],其结构如图6A所示。苜蓿皂苷P1为紫花苜蓿的次生代谢主要成分,其β构型的羟基或苷化存在3位,苷化的羧基一般连在28位[21],其结构如图6B所示。白头翁皂苷D均为五环三萜类皂苷,其在抗炎方面有显著效果[22],其结构如图6C所示。山茶属于山茶科山茶属植物,山茶花皂苷C2具有抗菌[23]等作用,其结构如图6D所示。
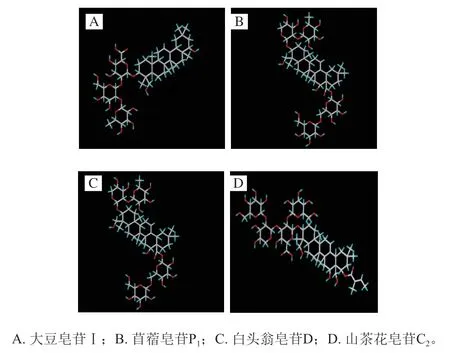
图6 不同齐墩果烷型皂苷的分子结构Fig. 6 Structures of different oleanane-type saponins
大豆皂苷Ⅰ、苜蓿皂苷P1、白头翁皂苷D和山茶花皂苷C2与α-LA的相互作用过程中,二者之间相互作用模式和在结合过程中涉及的主要氨基酸残基分别如图7~8所示,疏水作用和氢键参与了齐墩果烷型皂苷与α-LA的相互作用。
由图7A和8A可知,大豆皂苷Ⅰ与Lys62上的氨基、Glu49上的羰基、Leu105上的氨基、Thr33上的羰基和Tyr103相互结合,共形成6 个氢键,保证二者稳定结合。由图7B和图8B可知,苜蓿皂苷P1与His32上的羰基、Tyr103上的羰基、Leu105上的氨基、Glu49上的羰基和Asn44上的氨基相互结合,一共形成8 个氢键来维持二者稳定结合。由图7C和8C可知,白头翁皂苷D与Phe31上羰基、His32上的羰基、Glu49上羰基相互作用,形成3 个氢键,在白头翁皂苷D与α-LA相互作用形成的复合物中起主要作用。由图7D和8D可知,山茶花皂苷C2与Asp64上的羰基、Asn44上的氨基、Asn44上的羰基、Glu49上的羰基、Tyr103上的羰基和Ala106上的氨基相互结合,共形成8 个氢键,保证二者相互作用稳定。


图7 经过Pymol可视化处理后齐墩果烷型皂苷与α-LA相互作用细节图Fig. 7 Schematic of the interaction between oleanane-type saponins and α-LA after Pymol visualization

图8 Ligplot显示齐墩果烷型皂苷与α-LA相互作用的二维平面图Fig. 8 Two-dimensional plot of oleanane-type saponins and α-LA interaction
由4 种皂苷与α-LA相互作用的比较可知,齐墩果烷型皂苷与α-LA相互作用形成的复合物中主要存在疏水相互作用和氢键作用,范德华力较弱。其中参与疏水口袋形成的氨基酸残基有Val42、Trp104、Ala40、Ser34、Gly35、Thr33和天冬酰胺(Asn)。氨基酸残基Glu49、Tyr103最容易与齐墩果型皂苷形成氢键;除此之外,氨基酸残基Asn44一般与齐墩果型皂苷同时形成3 个氢键。
通过上述比较,发现达玛烷型皂苷与α-LA的疏水相互作用和氢键作用中参与的氨基酸残基多于齐墩果型皂苷与α-LA相互作用时参与的氨基酸残基。可能是因为达玛烷型皂苷具有环戊烷骈多氢菲的结构,C8有β-CH3,C13有β-H,C20构型不定(R型或S型)[24],而齐墩果烷型皂苷只有E环为六元环,D/E为顺式,E环上二甲基均位于C20,为偕二甲基[25]。从结构上分析,达玛烷型皂苷更复杂,可以提供更多的结合位点[26]。
3 结 论
通过计算机模拟分子对接方法,进行不同结构三萜皂苷与α-LA相互作用的模拟,证明小分子三萜皂苷与α-LA之间相互作用力主要为疏水相互作用和氢键作用,除此之外,可能还存在范德华力。在选取的达玛烷三萜皂苷中,酸枣仁皂苷A与α-LA结合效果最好,氢键作用和静电作用最强;在选取的齐墩果型三萜皂苷中,大豆皂苷Ⅰ与α-LA结合效果最好,氢键作用和静电作用最强;但相比之下,达玛烷型三萜皂苷与α-LA的结合效果比齐墩果烷型皂苷要好。因此,在之后进行功能性食品设计、小分子皂苷包埋时,选择达玛烷型皂苷在一定程度上可以提高包埋效率,在增强功能性食品的效果应用上有一定意义。

