ABCB1 基因多态性对阿托伐他汀降脂疗效与肝功能异常不良反应的影响*
申利娜,许铭娟,姬利红
(鹤壁市人民医院药学部,河南 鹤壁 458030)
阿托伐他汀是一种羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,通过抑制羟甲基戊二酰辅酶A(HMG-CoA)还原酶的活性而减少胆固醇的合成,从而使血浆中甘油三酯、胆固醇、低密度脂蛋白水平降低,高密度脂蛋白水平轻度升高,广泛用于高脂血症患者的治疗及心脑血管疾病的预防[1-3]。随着心脑血管发病率的变化,阿托伐他汀使用日益增加,且该类患者用药种类较多,使其不良反应增加,其中肝功能异常是其常见的不良反应[4]。但不同个体服用阿托伐他汀在疗效和不良反应上存在很大差异,引起该差异的因素有患者的性别、年龄、合并疾病、肝肾功能和药物相互作用等,此外,参与药物代谢的酶、转运蛋白及药物受体等的基因多态性同样会影响疗效与不良反应[5]。阿托伐他汀及其代谢产物的消除主要通过ABCB1(编码p-糖蛋白或MDR1)介导的从肝脏到胆汁的转运[6]。ABCB1 基因突变通过影响药物在体内的代谢,进而可能影响阿托伐他汀的降脂疗效和不良反应[7]。目前关于ABCB1 基因多态性与阿托伐他汀引起的肝功能异常的相关性的研究较少,既然研究认为ABCB1 基因多态性会影响阿托伐他汀的转运,进而影响血药浓度,此外不同种族与地区人群ABCB1 基因多态性存在差异,且目前关于ABCB1(2677T >G)基因多态性对阿托伐他汀降脂疗效的影响的研究结果存在一定的争议[8-9]。本研究主要探讨我国人群ABCB1(2677T >G)基因多态性对阿托伐他汀降脂疗效和肝功能的影响,以期为个体化给药提供依据。
1 资料与方法
1.1 一般资料
选 择2018 年12 月—2020 年12 月 鹤 壁 市人民医院住院高脂血症患者110 例作为研究对象,其中男性69 例,女性41 例,平均年龄(65.05±13.47)岁。入选标准:根据《中国成人血脂异常防治指南(2007 年版)》中高血脂症的诊断标准:TC ≥5.18 mmol/L 或TG ≥1.70 mmol/L或LDL-C ≥3.37 mmol/L 或HDL-C <1.04 mmol/L;连续服用阿托伐他汀治疗3 个月;用药前两周内未服用其他调脂药物及影响阿托伐他汀代谢的药物。排除标准:合并严重系统疾病者;临床资料不完善者。
1.2 方法
抽取患者外周静脉血2~3 ml 放置于抗凝管中,从中移取血液200 μl 置含1.0 ml NH4Cl 预处理液的EP 管中,静置3 min,经3 000 rpm 离心5 min,弃去上清液,保留下层白细胞,加入1 ml 0.9%生理盐水混匀,再次离心(3 000 rpm,5 min),弃去上层液体,向富集有白细胞的EP 管中加入30 μl PHARM-GENE 01 SNP 分析保存液,静置30 min,移取样本1.8 μl 加至相应的分析样本处理试剂中,通过荧光检测仪检测基因型并应用Microseq 微测序程序分析。
1.3 统计方法
选用SPSS 22.0 统计软件进行数据分析,符合正态分布的计量资料用(±s)表示,组间差异比较行t检验;计数资料用[n(%)]表示,组间差异比较行χ2检验;通过χ2检验分析ABCB1(2677T >G)基因型的分布是否符合Hardy-Weinberg平衡,以P>0.05 表明具有群体代表性。
2 结果
2.1 基因型分布频率
对110 例患者进行ABCB1(2677T >G)基因分型检测,基因型分布见表1。110 例患者中ABCB1(2677T >G)基因频率分别为GG(60例)54.55%、 GT(26 例)23.64%、TT(24 例)21.82%,基因突变频率为78.18%,基因型分布符合Hardy-Weinberg 平衡定律(χ2检验:P>0.05),表明本研究人群各基因型分布达到遗传平衡,具有群体代表性。

表1 ABCB1(2677T >G)基因型分布(n,%)
2.2 ABCB1(2677T >G)基因型对阿托伐他汀降脂疗效的影响
经阿托伐他汀药物治疗3 个月后,结果显示携带ABCB1 2677GG 基因型的患者TC、LDL-C 水平低于其他基因型患者(P<0.05);不同基因型患者TG、HDL-C 比较,差异无统计学意义(P>0.05),见表2。
表2 不同基因型用药后血脂变化[(±s),mmol/L]
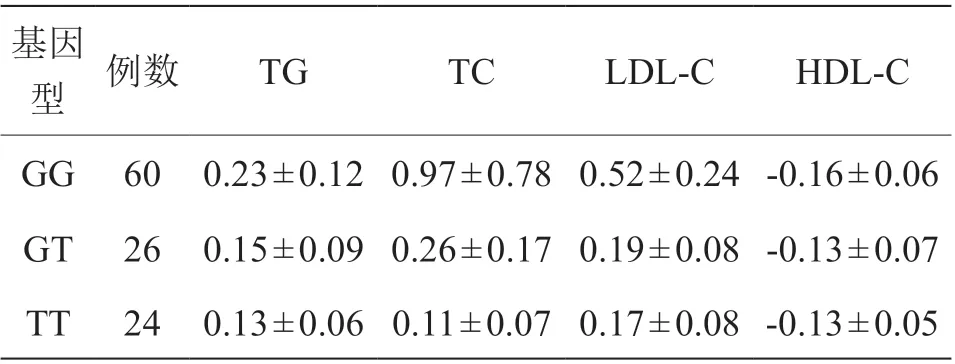
表2 不同基因型用药后血脂变化[(±s),mmol/L]
基因型 例数 TG TC LDL-C HDL-C GG 60 0.23±0.12 0.97±0.78 0.52±0.24 -0.16±0.06 GT 26 0.15±0.09 0.26±0.17 0.19±0.08 -0.13±0.07 TT 24 0.13±0.06 0.11±0.07 0.17±0.08 -0.13±0.05
2.3 ABCB1(2677T >G)基因型对服用阿托伐他汀前后肝功能的影响
经阿托伐他汀药物治疗3 个月后,携带ABCB1 2677GG 基因型的患者ALT、AST 水平高于其他基因型患者,且肝功能异常不良反应发生率高于其他基因型(P<0.05),见表3、表4。
表3 不同基因型用药后肝功能变化[(±s),U/L]
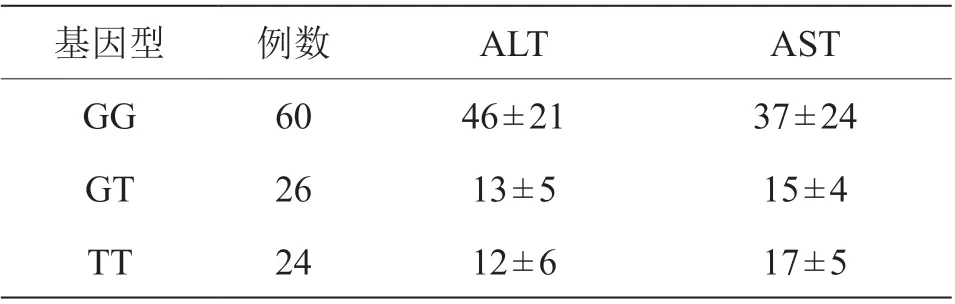
表3 不同基因型用药后肝功能变化[(±s),U/L]
基因型 例数 ALT AST GG 60 46±21 37±24 GT 26 13±5 15±4 TT 24 12±6 17±5

表4 各基因型服药后肝功能异常情况(n,%)
3 讨论
3.1 ABCB1(2677T >G)基因多态性与阿托伐他汀降脂疗效的相关性
本研究结果显示,携带ABCB12677GG 基因型的患者TC、LDL-C 水平显著降低,有较好的降脂疗效,这可能因为G2677T 位点为ABCB1 基因常见的非同义编码SNPs,当基因T 突变为G 时,药物的转运及代谢发生改变[10]。ABCB12677GG基因型对阿托伐他汀的转运能力强,服用常规剂量时,即可达到有效浓度,发挥降血脂作用。相反,如果患者基因型为ABCB12677TT,可加快阿托伐他汀的清除,降低药效[10]。Thompson JF 等[11]研究发现,使用阿托伐他汀治疗的患者中,ABCB1 2677G >T/A 位点GG 型患者LDL-C 水平降幅比TT 型患者高3%,TC 水平的降幅比TT 型患者高2%。张天栋等[10]在我国人群中发现阿托伐他汀对携带ABCB1 2677GG 型患者LDL-C 的调节作用显著高于携带同一位点的其他基因型。汪宝军等[12]研究阿托伐他汀和瑞舒伐他汀降脂疗效与ABCB1 G2677T 基因多态性的相关性,发现两者降脂疗效均与ABCB1 G2677T 基因多态性相关,携带TT 等位基因的患者选用瑞舒伐他汀降脂疗效较好,同样证实携带TT 等位基因的患者不宜选用阿托伐他汀。
3.2 ABCB1(2677T >G)基因多态性与阿托伐他汀引起肝功能异常的相关性
肝毒性为阿托伐他汀常见的不良反应。Fukunaga K 等[6]研究发现,ABCB1 基因多态性与阿托伐他汀引起的肝毒性相关。有研究认为[13],ABCB1 基因多态性会影响阿托伐他汀的代谢,进而影响血药浓度,血药浓度的变化可能与阿托伐他汀引起“肝功能异常”相关。本研究结果表明,携带ABCB1 2677GG 基因型的患者接受阿托伐他汀治疗时,对肝功能影响较大,肝功能异常发生率较高,这可能是因为ABCB12677GG 基因型对阿托伐他汀的转运能力强,血药浓度高,进而引起肝功能的变化较大。
3.3 总结及不足
ABCB1 基因多态性对阿托伐他汀降脂疗效和肝功能有显著影响,该研究为我国人群基因多态性与阿托伐他汀降脂疗效及肝功能的影响提供数据支持,为个体化给药提供依据。但因研究纳入的样本量较少,且易受其他因素的影响,因此该结论仍需大样本、前瞻性研究进一步证实。

