直肠癌短程放疗联合序贯化疗所致急性骨髓抑制的相关因素分析
余富强,黄维,李英
重庆医科大学附属第一医院肿瘤科,重庆 400016
前言
直肠癌是消化系统最常见的恶性肿瘤之一,对于局部晚期的直肠癌,放疗联合序贯化疗后手术治疗是其标准治疗模式[1]。其中放射治疗包括长程放疗(50 Gy/25 F)和短程放疗(25 Gy/5 F)两种方式[2]。与长程放疗相比,短程放疗直肠癌患者在更短的治疗时间内获得了相似甚至更好的总生存率及无病生存率,因此短程放疗联合序贯化疗后手术成为NCCN指南中局晚期直肠癌推荐治疗方案之一,广受临床欢迎[3-4]。但短程放疗联合序贯化疗的直肠癌患者中,仍有一部分患者出现中重度骨髓抑制反应,以至于延迟甚至中断后续的抗肿瘤治疗,从而可能降低其疗效。因此,如何降低短程放疗联合化疗直肠癌患者骨髓抑制发生率的问题仍亟待解决。目前,关于直肠癌放化疗过程急性骨髓抑制相关因素分析很多[5-9],但这些研究多是关于长程放疗,而短程放疗相关急性骨髓抑制影响因素的研究却鲜有报道。因此,本研究旨在分析直肠癌短程放疗联合序贯化疗中对急性骨髓抑制影响的临床因素与放疗相关物理因素,试图以此预测并控制直肠癌患者短程放疗联合化疗中急性期骨髓抑制的发生。
1 资料与方法
1.1 病例资料
收集2016年1月~2021年4月于重庆医科大学附属第一医院肿瘤科接受短程放疗联合序贯化疗的直肠癌患者45 例,其中,男38 例,女7 例;年龄27~77岁,平均年龄59 岁;按TNM 分期标准进行临床分期,II期7例,III期23例,IV期15例。纳入标准:(1)患者一般情况可,KPS≥70;(2)经病理诊断为直肠腺癌,肿瘤下缘距肛门边缘<12 cm;(3)主要脏器(包括心、肝、肾功能)功能良好;(4)原始骨髓功能良好(血红蛋白>10g/dL,中性粒细胞≥1.8×109/L,血小板≥100×109/L;白细胞≥3.5×109/L);(5)短程放疗后联合序贯XELOX 方案化疗;(6)完成预定放疗。排除标准:(1)患有中枢神经系统疾病、心理疾病;(2)非黑色素瘤皮肤癌或原发直肠癌以外的第二原发肿瘤;(3)患有严重、无法控制的感染。本研究得到医院伦理委员会批准。
1.2 方法
1.2.1 化疗方案 所有患者选择放疗结束2 周后开始联合序贯XELOX 方案化疗[卡培他滨1 000 mg/m2(2 次/d,第1~14 天)+奥沙利铂130 mg/m2(1 次/3周)],总化疗4周期,其中,所有患者在急性期90 d内共计化疗3次。
1.2.2 放射治疗 患者取平卧位,采用热塑膜技术固定,使用静脉注射碘造影剂增强后,应用LightspeedRT CT机(美国GE公司)进行盆腔扫描,扫描结果经局域网传输至Eclipse13.5(美国Varian 公司)系统完成靶区勾画。临床靶区勾画(Clinical Target Volume, CTV)范围为上界达腹主动脉分叉为左、右髂总动脉处;下界达肛提肌插入外括约肌处,包括骶前区淋巴结、直肠系膜区淋巴结、髂内淋巴引流区、闭孔淋巴引流区、直肠病灶等区域。计划靶区(Planning Target Volume,PTV)由CTV 外扩0.5 cm 获得。所有患者均选用6 MV X 射线进行治疗。其中,39例使用容积旋转调强技术,使用Unique加速器(美国Varian 公司)进行治疗。另外,有6 例患者使用固定野调强技术在21EX加速器(美国Varian公司)上进行治疗。PTV 处方剂量为25 Gy/5 F,所有患者PTV覆盖处方剂量均达到95%。
1.2.3 骨盆勾画 骨盆勾画的上界为第五腰椎上缘,下界为股骨小转子下缘,包括椎骨、骶骨、尾骨、髂骨、坐骨、股骨结构[10-11]。同时将骨盆划分为3 个子区域:(1)腰骶骨:包含在PTV 内的椎骨(通常L5)及整个骶骨;(2)髂骨:股骨头上缘延伸到髂嵴;(3)骨盆下部由坐骨、髋臼及双侧股骨头及股骨上段组成,范围从股骨头上缘至坐骨结节下缘。
1.2.4 评估参数 临床因素包括患者性别、年龄、肿瘤临床分期与放疗技术;物理因素指患者骨盆及其3个子区域接收>5、10、15、20、25 Gy 剂量照射的体积百分比(V5、V10、V15、V20、V25),最大剂量(Dmax)及平均剂量(Dmean)。
1.2.5 急性骨髓抑制的评定 从放疗开始至90 d内每周复查血常规,评估血液相关不良反应。所有患者急性期骨髓抑制程度遵循美国肿瘤放射治疗协作组织(RTOG)分级标准[12],记录患者白细胞、血红蛋白、血小板及中性粒细胞最低值。若患者发生≥2 级骨髓抑制则暂停化疗,使用短效粒细胞刺激因子/重组人血小板生成素等对症处理,待血象恢复正常后继续治疗。
1.3 统计学方法
使用SPSS 25.0软件对数据进行统计学分析。临床因素相关数据采用χ2检验方案;物理因素相关数据中,符合正态分布的计量数据以均数±标准差表示,采用t检验方案,不符合正态分布的计量数据以M(Q1,Q3)表示,采用Mann-whitneyU检验方案,并使用岭回归法对存在多重共线性的物理参数进行修正。应用Logistic 回归模型进行多因素分析。采用受试者工作特征曲线(ROC)判断骨髓抑制的剂量体积临界值。P<0.05为差异有统计学意义。
2 结果
2.1 急性骨髓抑制情况
全组发生0 级急性骨髓抑制16 人(16/45,35.56%);发生1级急性骨髓抑制11 人(11/45,24.44%);2级急性骨髓抑制12人(12/45,26.67%);发生3 级急性骨髓抑制5 人(5/45,11.11%);发生4 级急性骨髓抑制1 人(1/45,2.22%)。其中发生≥2 级骨髓抑制共18人(18/45,40%)。
2.2 急性骨髓抑制单因素分析
2.2.1 临床因素 临床因素与患者≥2级急性骨髓抑制的单因素分析详见表1。在患者所有临床因素(年龄、性别、临床分期、放疗技术)中,未发现对短程放疗序贯化疗的直肠癌≥2 级骨髓抑制的发生具有显著影响的临床因素(P>0.05)。
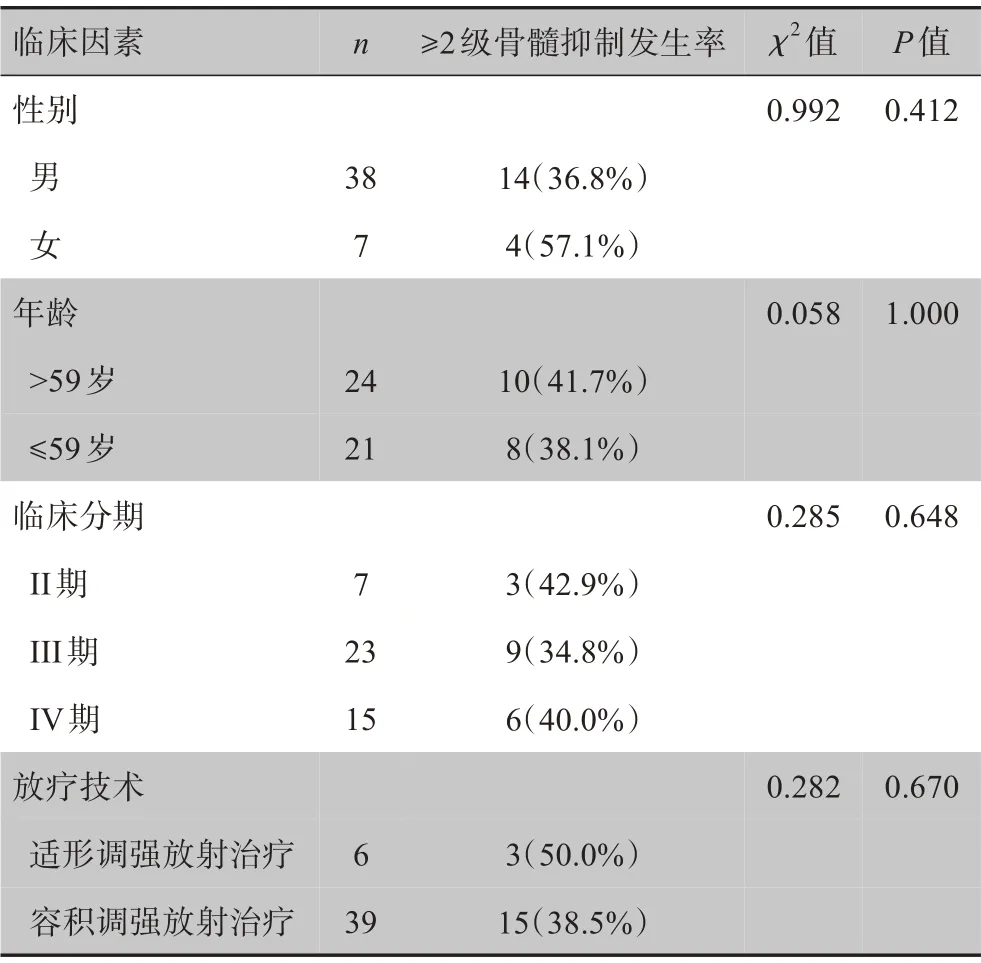
表1 临床因素与≥2级骨髓抑制的单因素分析Table 1 Univariate analysis of clinical factors on incidence of≥grade 2 bone marrow suppression
2.2.2 物理因素 物理因素与患者≥2级急性骨髓抑制的单因素分析详见表2。其中,全骨盆V10、Dmean,腰骶骨V5、V10、V15、V20、V25、Dmean,髂骨V5、V10、Dmean与急性骨髓抑制的发生相关(P<0.05)。使用岭回归法排除存在多重共线性的物理参数后,获得与≥2 级急性骨髓抑制相关的高数值稳定性的物理因素为全骨盆V10、腰骶骨V10、V25(P<0.05)证实长程放化疗患者与短程放疗联合序贯化疗在3年总生存期及无病进展生存期方面比较差异没有统计学意义(P>0.05)。而最新的研究表明相比长程同步放化疗患者,短程放疗联合序贯化疗患者在3年总生存率、3年无病生存率上甚至表现更佳(86.5%vs75.1%,P<0.05;64.5%vs62.3%,P<0.01),且两种放疗方式在局部复发率及无转移生存率差异无统计学意义(P>0.05)[3]。但研究同时指出,短程放疗序贯化疗患者≥3 级急性毒副反应(包括急性骨髓抑制、呕吐、腹泻、疲劳、厌食、恶心、手足综合征、膀胱炎、肛周疼
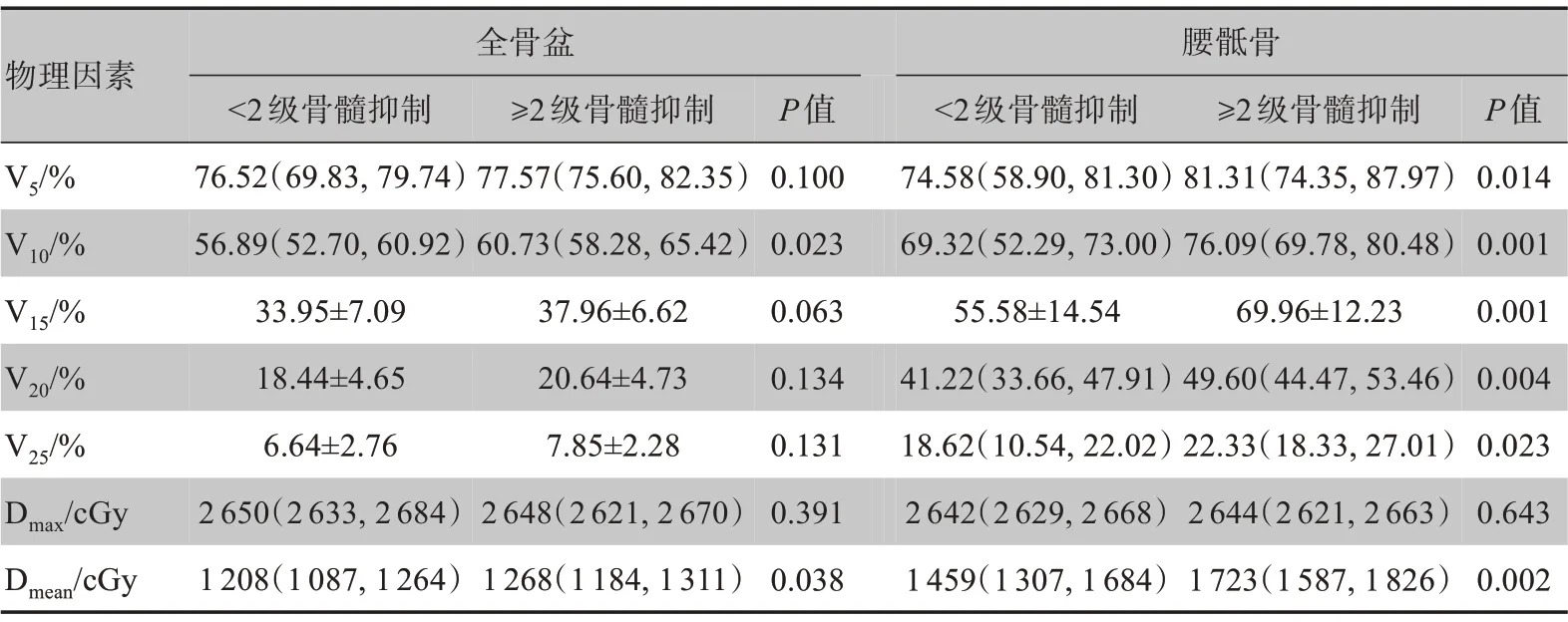
表2 物理因素与≥2级骨髓抑制的单因素分析Table 2 Univariate analysis of physical factors on influence of ≥grade 2 bone marrow suppression
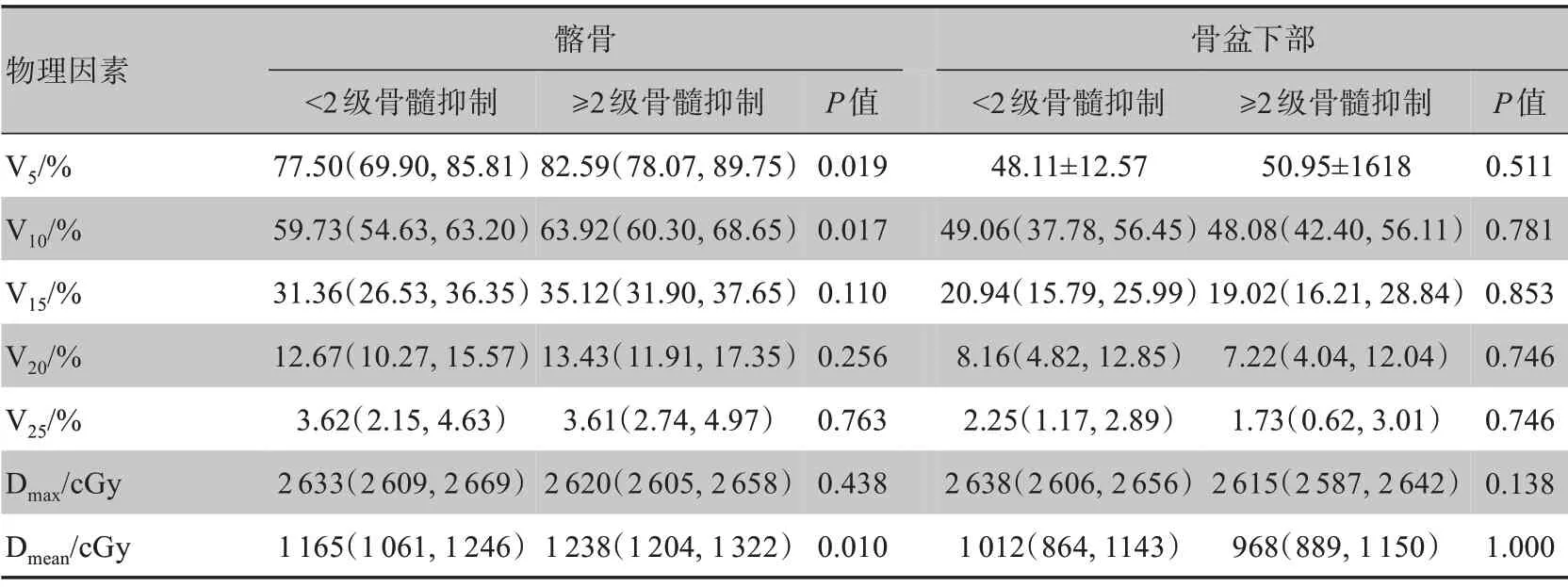
续表2
2.2.3 急性骨髓抑制多因素分析 采用Logistic 回归模型分析单因素分析中有统计学意义的参数(全骨盆V10、腰骶骨V10及V25)与患者急性骨髓抑制的关系,结果见表3。研究分析发现,腰骶骨V10与≥2级骨髓抑制发生呈显著相关(P<0.05)。
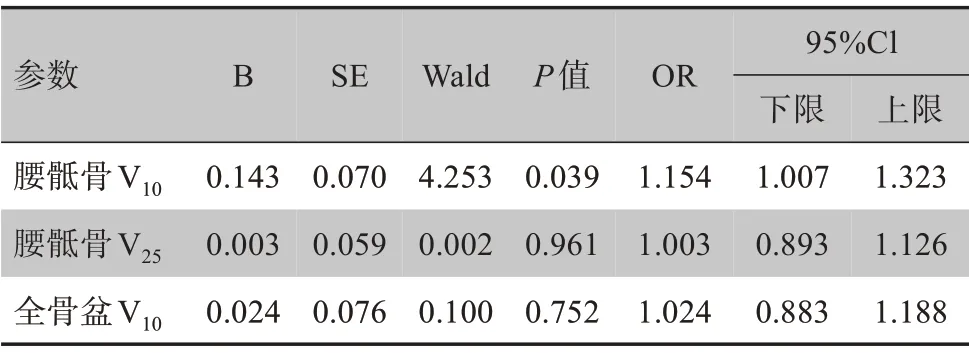
表3 除外多重共线性的各项影响因素对≥2级骨髓抑制的Logistic多元回归分析Table 3 Multivariate Logistic regression analysis of influencing factors on ≥grade 2 bone marrow suppression after excluding multicollinearity
2.2.4 ROC 曲线分析 对腰骶骨V10进行ROC 曲线分析详见图1,结果显示曲线下面积为0.798,根据判断标准预测以灵敏度与特异度之和最大为标准找到腰骶骨V10界值为74.90%(灵敏度为0.667,特异度为0.889)。进一步分析,腰骶骨V10<74.90%患者30 例,发生2级以上急性骨髓抑制6例(20.00%);腰骶骨V10≥74.90%患者15 例,发生2 级以上急性骨髓抑制12例(80.00%)。提示当腰骶骨V10≥74.90%时,超过2级骨髓抑制的发生率明显增加。
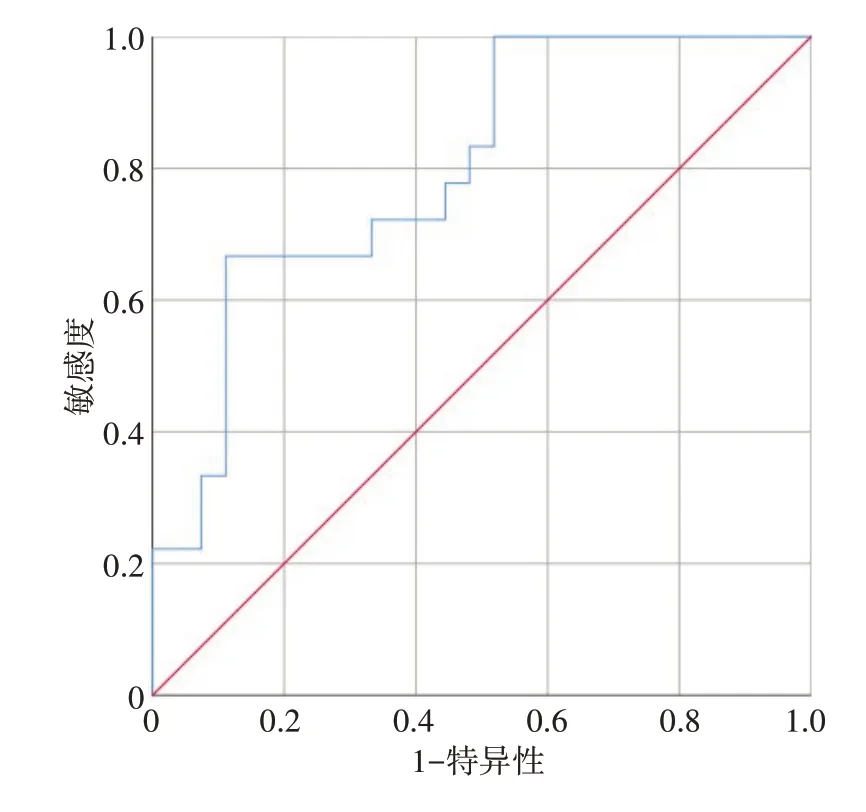
图1 腰骶骨V10的ROC曲线Figure 1 ROC curve of lumbosacral V10
3 讨论
短程放疗与序贯化疗的联合应用是近年来局部晚期直肠癌治疗策略优化的热门选项[3,13-14]。几项关于直肠癌放化疗的多中心、随机III 期临床研究[13-14]痛和肛周皮炎)发生率明显高于长程同步放化疗患者(26.5%vs12.6%,P<0.001),其中急性骨髓抑制反应表现最为明显(15.8%vs2.0%,P<0.001)。严重骨髓抑制急性骨髓抑制可导致感染风险增加和延长治疗期[15],从而导致疾病控制率的降低。因此,在局晚期直肠癌患者短程放疗联合序贯化疗的治疗中,减少急性骨髓抑制发生成为临床工作中不可忽视的问题。
造血干细胞对辐射有着极高的敏感性[16-17],直肠癌的放疗区域(包括髂骨、股骨近端和腰椎)聚集了成年人体内超过50%的活性骨髓[18],而这些活性骨髓组织内的造血干细胞在射线作用下会发生病理性改变[19-20],进而抑制红细胞、白细胞及血小板的再生,引起骨髓抑制[21]。目前关于直肠癌放疗所致急性骨髓抑制相关研究多聚焦于常规长程放疗相关因素,国内外暂未发现有关短程放疗所致急性骨髓抑制的相关因素的研究。多项研究表明,接受长程同步放化疗(50 Gy/25 F)直肠癌患者骨盆骨髓的剂量体积参数与急性骨髓抑制的发生有关,控制骨盆骨髓受照剂量是降低急性骨髓抑制的重要途径[7-9,22-25]。Yang 等[22]对120 例接受新辅助盆腔放疗和卡培他滨同步化疗的直肠癌患者进行研究,发现控制腰骶椎骨髓V45<51%可以减少急性骨髓抑制的发生;王健仰等[23]一项回顾性研究表明腰骶椎骨髓V40>60%的患者较V40≤60%患者更容易产生急性骨髓抑制;黄维等[24]对62 例直肠癌患者进行回顾性分析,发现髂骨骨髓V30是急性骨髓抑制的高危因素,阈值为44%。而最新的研究表明控制全骨盆骨髓V10≤85%、V20≤65%、V30≤45%时,可在不损伤靶区剂量覆盖及增加其他危及器官受量的前提下,有效降低常规长程同步放化疗直肠癌患者≥2级急性骨髓抑制发生率[25]。
本研究结果表明,物理因素中,全骨盆V10、腰骶骨V10、V25对≥2 级急性骨髓抑制的发生有显著影响(t=-2.615、-3.729、-2.279,P<0.05)。经Logistic 回归分析发现腰骶骨V10是≥2 级急性骨髓抑制的独立高危因素(P<0.05)。采用ROC 曲线确定腰骶骨V10最优剂量学取值为74.90%。当腰骶骨V10>74.90%时,全组≥2 级急性骨髓抑制的发生率有明显增加。而在临床因素方面,本研究对45 例直肠癌短程放疗联合序贯化疗患者的临床因素(性别、年龄、临床分期、放疗技术及是否手术)进行分析,未发现对急性骨髓抑制的发生有显著影响的临床因素。其中值得注意的是,女性直肠癌患者发生急性骨髓抑制的概率大于男性患者,但差异无统计学意义(P>0.05)。这符合孙荣刚等[5]、Voort等[6]研究中直肠癌长程同步放化疗的女性患者相比男性患者发生血液系统不良反应概率较高的结论。然而,本研究仍存在一定局限性:(1)收集的病例数较少,这可能导致统计分析结果存在略微偏差,因此后期研究仍需要进一步增加病例数以提高统计的精度;(2)本研究是回顾性研究,本研究结论仍需在后续前瞻性研究中得到进一步证实。
综上所述,腰骶骨V10是影响短程放疗联合序贯化疗的局晚期直肠癌患者发生≥2 级急性骨髓抑制的高危因素,其阈值为74.90%。因此,在直肠癌患者进行短程放疗联合序贯化疗时,建议限制腰骶骨V10在74.90%以下,以减少≥2级急性骨髓抑制的发生率,降低抗肿瘤治疗过程患者受到不良影响的风险。

