基于Auto-Planning技术的肺癌容积旋转调强放疗计划评估
李慧君,王琳婧,王锐濠,周露,彭莹莹,廖煜良,张书旭
广州医科大学附属肿瘤医院放疗中心,广东广州 510095
前言
目前,肺癌高居全球癌症发病率首位[1],放射治疗作为肺癌最常用的治疗方法,能够有效改善肿瘤控制率和总体生存率[2-4]。计划设计是放射治疗实施的重要环节,其质量是影响放疗疗效的关键因素[5]。常规计划设计主要依赖放疗物理师的知识储备和经验,所获取的计划质量往往存在显著差异。因此,如何减少人为依赖,提高放疗计划有效性,实现放疗计划的自动设计,成为当前众多学者的研究重点[6-9]。Auto-Planning 是一种基于渐进式自动优化算法的新方法,它将以往的先验经验融入到计划优化中,由计划系统自动生成剂量成形结构(Dose Shaping Structure, DSS),并根据限量条件反复优化目标函数,使其无限接近最优解[10-12]。在常规调强放射治疗(IMRT)中,基于Auto-Planning 技术的自动计划在无需物理师外加干预的情况下,即可得到临床可用的放疗计划,对此作者已得到验证[13]。近年来,由于容积旋转调强放射治疗(VMAT)能够获得更好的靶区覆盖度和剂量均匀性,其逐渐取代IMRT 成为主流的放疗手段[14-17],因此评估基于Auto-Planning技术的肺癌VMAT 计划性能显得至关重要。本研究随机选取25 例肺癌患者,分别设计基于Auto-Planning 技术的自动计划(AP-VMAT)和物理师手动计划(MVMAT),通过对比分析两组计划的剂量学差异,探讨Auto-Planning技术在肺癌VMAT计划中的可行性。
1 资料与方法
1.1 临床资料
随机选取2020年10月~2021年3月在广州医科大学附属肿瘤医院接受放射治疗的肺癌患者25 例,其中右肺癌13 例,左肺癌10 例,中央型肺癌2 例,年龄44~73 岁,中位年龄62 岁,TNM 分期为T2-T3、N1-N2、M0患者。纳入标准选择PTV 处方剂量为60 Gy、分割次数为30 次的临床治疗患者,选取病例均具有明确放疗适应证。
1.2 CT模拟定位及靶区勾画
所有患者均采用仰卧位,热塑膜进行体位固定。应用荷兰Philips16 排大孔径定位CT 进行扫描。扫描过程中患者保持双臂上举,自主平静呼吸。扫描范围包括下颌至全胸廓所有区域。扫描层厚设置为5 mm。扫描结束后将CT 图像传至Pinnacle3V9.10计划系统。
参考ICRU 报告,由经验丰富的临床医生进行靶区和危及器官(OARs)勾画。其中肿瘤靶区(GTV)包括肺内原发灶、纵膈淋巴结和转移肺门;临床靶区(CTV)由GTV 向肺部及转移淋巴结外放获得;计划靶区(PTV)考虑摆位误差及器官运动范围,由CTV外放6 mm 获得。相关的OARs 包括双侧肺组织、脊髓和心脏。
1.3 计划设计
应用Pinnacle3V9.10 计划系统对25 例肺癌病例分别进行AP-VMAT 和M-VMAT 设计。两组计划均基于医科达Synergy 直线加速器模型,采用6 MV X线,射野起始角度、剂量限制条件和迭代次数完全相同。射野起始角度根据肿瘤位置设置为双全弧(中央型肺癌)或双半弧(左、右肺癌),迭代次数设置为100 次。AP-VMAT 计划采用自动优化引擎,利用系统中自带的Technique 模块对靶区和OARs 进行处理后并自动优化,优化过程中由系统依据相应目标函数,使用反复减少冷点和热点的迭代优化方法实现自动剂量成型。若AP-VMAT 计划偏离目标明显仍需调整,则人为干预次数不超过2次。M-VMAT计划由本院5年以上工作经验的物理师手动完成,物理师首先根据靶区和OARs相对结构设置剂量限制条件,然后根据初始剂量分布反复调整、补充限量函数最终实现剂量成型。
1.4 计划评估
应用剂量体积直方图(DVH)比较和分析两种计划靶区和OARs的剂量分布差异,剂量学参数包括:
(1)靶区:受照最大剂量(D2)、受照平均剂量(Dmean)、受照最小剂量(D98)、均匀性指数(HI)[18]和适形度指数(CI)[19]。其中HI、CI计算公式如下:
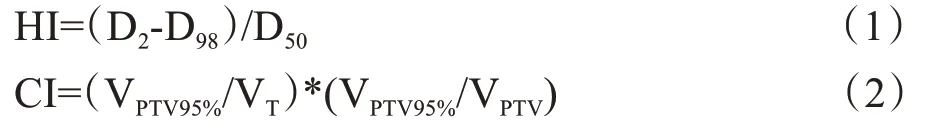
其中,D2为2%靶区体积所受到的辐射剂量,一般代表最大剂量,D98为98%靶区体积所受到的辐射剂量,一般代表最小剂量。HI 值越接近0 代表靶区剂量越均匀。VPTV95%为95%处方剂量曲线覆盖PTV的面积,VT为95%处方剂量曲线覆盖的全部面积,VPTV为PTV靶区体积。CI值越接近1(范围为0~1)代表靶区适形度越好。
(2)危及器官:脊髓受照最大剂量(Dmax)和平均剂量(Dmean);双肺特定剂量受到的照射体积V30、V20、V5和受照平均剂量(Dmean);心脏特定剂量受到的照射体积V40、V30和受照平均剂量(Dmean)。
1.5 统计学处理
采用SPSS20.0 统计学软件,数据以均数±标准差表示,对两种计划的各项剂量学参数行配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 靶区剂量参数比较
AP-VMAT和M-VMAT计划的等剂量曲线分布如图1所示,两种计划处方剂量均能覆盖95%靶区体积,靶区适形度均满足临床要求。如表1所示,两种计划的D2均控制在110%处方剂量内,Dmean均略高于处方剂量。与M-VMAT计划相比,AP-VMAT计划的靶区D98略高于手动计划(t=2.193,P=0.039),HI略优于手动计划(t=-2.422,P=0.023),且CI显著优于M-VMAT 计划(t=11.712,P<0.01)。两种计划的靶区D2和Dmean差异无统计学意义(P>0.05)。
表1 两种计划的靶区剂量参数比较(± s)Table 1 Comparison of dosimetric parameters of the target area between two groups of plans(Mean±SD)

表1 两种计划的靶区剂量参数比较(± s)Table 1 Comparison of dosimetric parameters of the target area between two groups of plans(Mean±SD)
剂量参数D2/cGy Dmean/cGy D98/cGy HI CI AP-VMAT 6 374.83±72.82 6 182.70±37.82 5 933.30±22.97 0.065±0.024 0.768±0.046 M-VMAT 6 404.26±85.53 6 185.60±47.09 5 919.30±40.86 0.072±0.027 0.592±0.094 t值-2.052-0.376 2.193-2.422 11.712 P值0.052 0.710 0.039 0.023<0.01

图1 肺癌患者两种计划剂量分布Figure 1 Dose distributions in two plans of a patient with lung cancer
2.2 OARs剂量参数比较
AP-VMAT和M-VMAT计划涉及到的OARs剂量参数比较见表2。两种计划所有OARs受量均能满足临床剂量限制要求。与M-VMAT计划相比,AP-VMAT计划中脊髓受到的Dmax减少约467.21 cGy(t=-4.378,P=0.0002)、Dmean减少约125.42 cGy(t=-3.070,P=0.0052)。AP-VMAT 计划中心脏V40减少3.74%(t=-5.018,P=0.00004),V30减少3.75%(t=-4.137,P=0.000037),Dmean减少264.8 cGy(t=-5.026,P=0.000 039)。AP-VMAT计划中双肺V30减少0.81%(t=-4.355,P=0.00021),Dmean减少约32.21 cGy(t=-4.269,P=0.00027)。两种计划双肺V20和V5差异无统计学意义(P>0.05)。
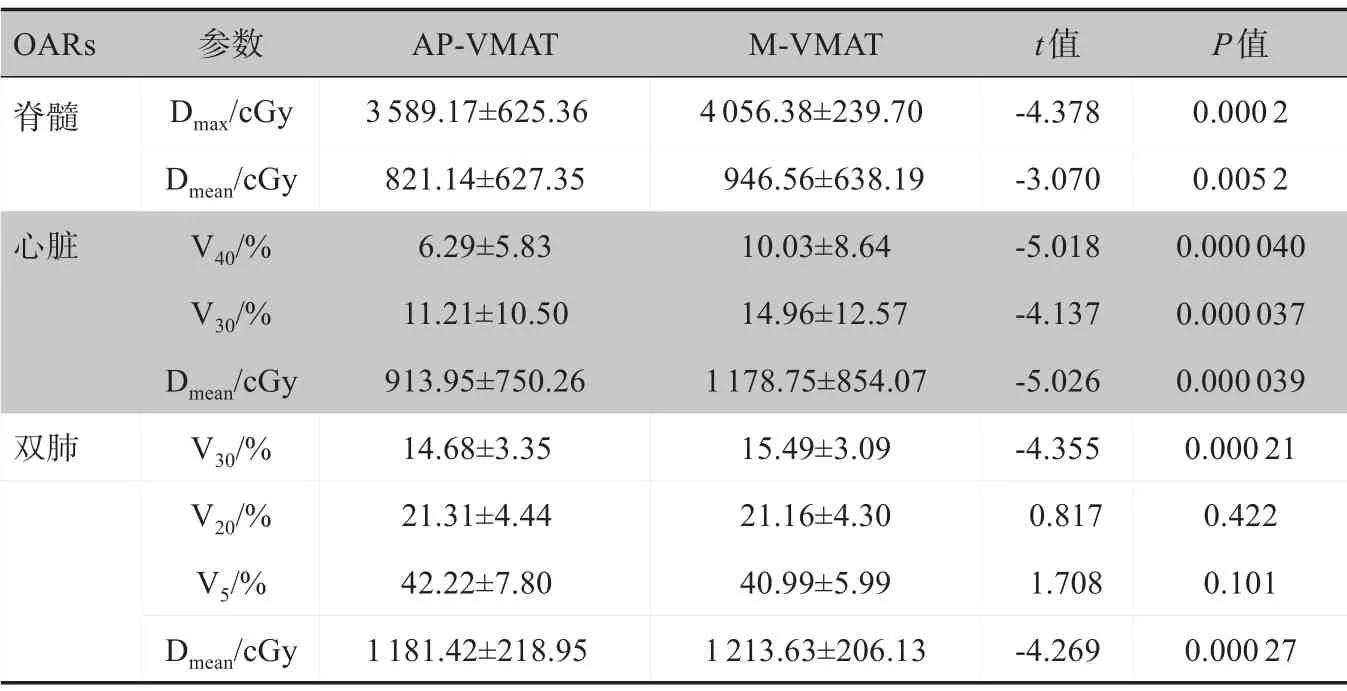
表2 两种计划的OARs剂量参数比较Table 2 Comparison of dosimetric parameters of organs-at-risk between two groups of plans
3 讨论
随着放疗技术的发展,由于VMAT 能够获得更好的靶区覆盖度和剂量均匀性,其逐渐取代IMRT 成为肺癌放疗中最主流的手段[20-21]。一般而言,肺癌VMAT 计划设计的本质即根据DSS 目标函数逆向优化子野形状和权重,以期求得接近最优解的剂量分布。手动计划中,物理师首先根据靶区和OARs结构关系手动生成DSS 结构并设定满足临床要求的限量条件,然后根据剂量分布情况反复补充DSS、调整限量条件,最终使得剂量成型。由于优化程序只能根据给定的DSS 限量条件求解最优射野参数,如果在手动计划中未创建相应DSS,则可能导致靶区适形度差、脊髓等OARs出现剂量“套圈”现象。相对手动计划,基于Auto-planning 的自动计划模块能根据剂量分布是否无限接近最优解,不断自动生成DSS 结构并给出限量条件,反复减少冷点和热点,从而权衡靶区和OARs最终实现高质量剂量分布[22-24]。
本研究关于AP-VMAT 和M-VMAT 的剂量学比较结果证实了上述论断。AP-VMAT 在满足临床要求的同时,靶区适形度显著优于M-VMAT,同时在OARs 保护方面,AP-VMAT 有效控制了脊髓的Dmax和Dmean,对心脏高剂量受照体积(V40、V30)和Dmean方面更具有明显优势。虽然与M-VMAT 相比,APVMAT 双肺特定剂量的受照体积V20、V5无统计学差异,但V30减少了约0.81%,而且AP-VMAT 在一定程度上降低了双肺的Dmean。上述研究结果表明,基于Auto-planning 的自动计划模块在肺癌VMAT 优化时能对靶区和OARs的权重进行最大限度的调节,在保证靶区覆盖率及剂量均匀性的基础上,尽可能地收紧对OARs的剂量限制,大大改善计划的总体质量。
基于Auto-planning 的肺癌VMAT 计划通常无需人工干预即可满足临床需求,对于某些病例,还可以在自动计划基础上进一步实施人工优化,以期获得更高质量的计划。本研究中个别肺癌患者自动计划的初始结果显示双肺的V5略高于设置值,为了降低双肺低剂量的受照体积,可以手动增加V5限量条件进一步降低双肺受照体积,有效提高计划质量。
综上所述,手动计划往往是物理师根据经验执行的人工试错性优化,这对寻求最优的治疗计划,尤其是保护OARs 造成很大的不确定性。基于Autoplanning 的肺癌VMAT 计划能够模拟物理师的设计思维反复优化目标函数,最大限度地调节靶区和OARs 的权重,在保证靶区覆盖率的前提下寻求近似最优解,从而提高放疗计划设计效率,有效降低经验不足的影响,保证计划质量的高水平和一致性,改善肿瘤治愈率以及病人生存质量。

