基于术前增强CT构建列线图模型预测胰腺导管腺癌R0切除
李政晓,李昇霖,薛彩强,刘苏卫,孙嘉晨,任铁柱,周俊林
1.兰州大学第二医院放射科,甘肃兰州 730030;2.兰州大学第二临床医学院,甘肃兰州 730030;3.甘肃省医学影像重点实验室,甘肃兰州 730030;4.医学影像人工智能甘肃省国际科技合作基地,甘肃兰州 730030
前言
胰腺导管腺癌(Pancreatic Ductal Adenocarcinoma,PDAC)是消化系统预后最差的恶性肿瘤之一,发现时多为晚期,是癌症相关死亡的第四大原因[1]。目前,有效延长PDAC患者远期生存的方法是手术达到完全切除(R0切除),并辅助放化疗[2-4]。然而多数患者发现时已为晚期,如侵犯肠系膜上动脉、门静脉、肠系膜上静脉则增加R0切除的风险和难度。有研究表明手术切缘阳性(R1)是肿瘤侵袭性的标志,预示着更差的生存率[5-7]。因此,术前通过影像学检查评估PDAC的R0切除对于临床术前方案至关重要。增强CT扫描是临床常用的术前检查手段,但较少研究分析影像征象结合临床特征评估肿瘤R0切除[8]。本研究旨在分析PDAC患者的术前增强CT特征及临床特征,构建列线图模型以预测PDAC肿瘤R0切除,从而辅助临床更好地制定术前治疗方案。
1 资料与方法
1.1 一般资料
回顾性收集2015年1月至2021年11月在兰州大学第二医院就诊的经手术病理证实的186 例PDAC患者。纳入标准:(1)切缘状态经手术病理证实;(2)患者术前临床资料完整;(3)患者术前CT 平扫、增强资料完整。排除标准:(1)术前肿瘤相关化疗病史;(2)存在CT 图像伪影(如运动或金属相关的伪影)影响肿瘤观察;(3)术前CT检查与手术病理证实PDAC时间>30 d。186 例PDAC 患者中,39 例临床资料不全,15 例术前化疗,26 例图像不全;最终纳入106 例PDAC患者,R1切除组22例,R0切除组84例。
1.2 仪器与CT检查方法
使用256 排螺旋CT 扫描仪(GE, Revolution CT,美国)或128 排螺旋CT 扫描仪(GE, Discovery 750HD CT, 美国)。所纳入的106 例患者均术前行CT平扫与CT增强扫描。CT扫描前,患者禁食6~8 h。CT 扫描参数:平扫管电压120 kV,自动毫安秒技术,管电流100~600 mA,准直器宽度0.625 mm,机架速度0.6 s/rot,间距0.983:1,重建层厚和层间距均为1.25 mm。CT增强扫描采用碘克沙醇(320 mgI/mL),经肘前静脉用高压注射器注射,流速3.5~4.0 mL/s,剂量1.0 mL/kg,腹主动脉监测的触发阈值为50 HU,触发后,动脉期扫描8 s,静脉期扫描30 s,延迟期扫描120 s。
1.3 图像分析方法
所有病例CT 征象由两名分别在腹部疾病影像诊断方面具有10年和15年经验的副主任医师在PACS 系统上对图像进行分析。在术前增强CT 图像上,在PDAC 肿瘤实性区域上绘制大约40~60 mm2的感兴趣区域(Region of Interest, ROI),通过ROI 获得肿瘤三期增强CT值(HU),观察并测量肿瘤与周围血管的最大夹角(T/动脉夹角、T/门静脉夹角、T/肠系膜上静脉夹角),观察瘤周脂肪间隙是否清晰,有分歧时,经讨论后达成一致意见。
1.4 统计学方法
由R 软件(Version 4.1.2, https://www.r-project.org/)完成统计学分析。连续性变量表示为均值±标准差或四分位间距(IQR),分类变量表示为百分比。R1 切除组和R0 切除组的对比分析中,连续性变量采用t检验或Wilcoxon秩和检验,分类变量使用χ2检验或Fisher确切概率。Kappa检验分析两位观察者的一致性,Kappa值≤0.20~0.40表示一致性一般、0.41~0.60为一致性中等、0.61~0.80为高度一致性、0.81~1.00为几乎完全一致。通过单因素和多因素Logistic 回归模型筛选具有统计学意义的影像特征和临床特征作为预测因子。然后构建预测PDAC患者R0切除列线图模型。受试者工作特征(ROC)曲线和校准曲线用于评估模型的AUC 值、敏感性和特异性。之后采用Bootstrap方法对样本重复采样1 000次进行模型内部验证,并利用拟合优度检验(Hosmer-Lemeshow)评价模型的判别性能。
2 结果
2.1 PDAC患者术前临床基线资料
入组的106例PDAC患者中,男性69例,女性37例;年龄29~78岁,平均(57.56±9.89)岁;R0切除84例,R1切除22例。对比分析患者术前临床基线资料发现,R0与R1切除在CA199、CEA、CA125术前肿瘤标志物的测定上,差异有统计学意义(P<0.05),见表1。
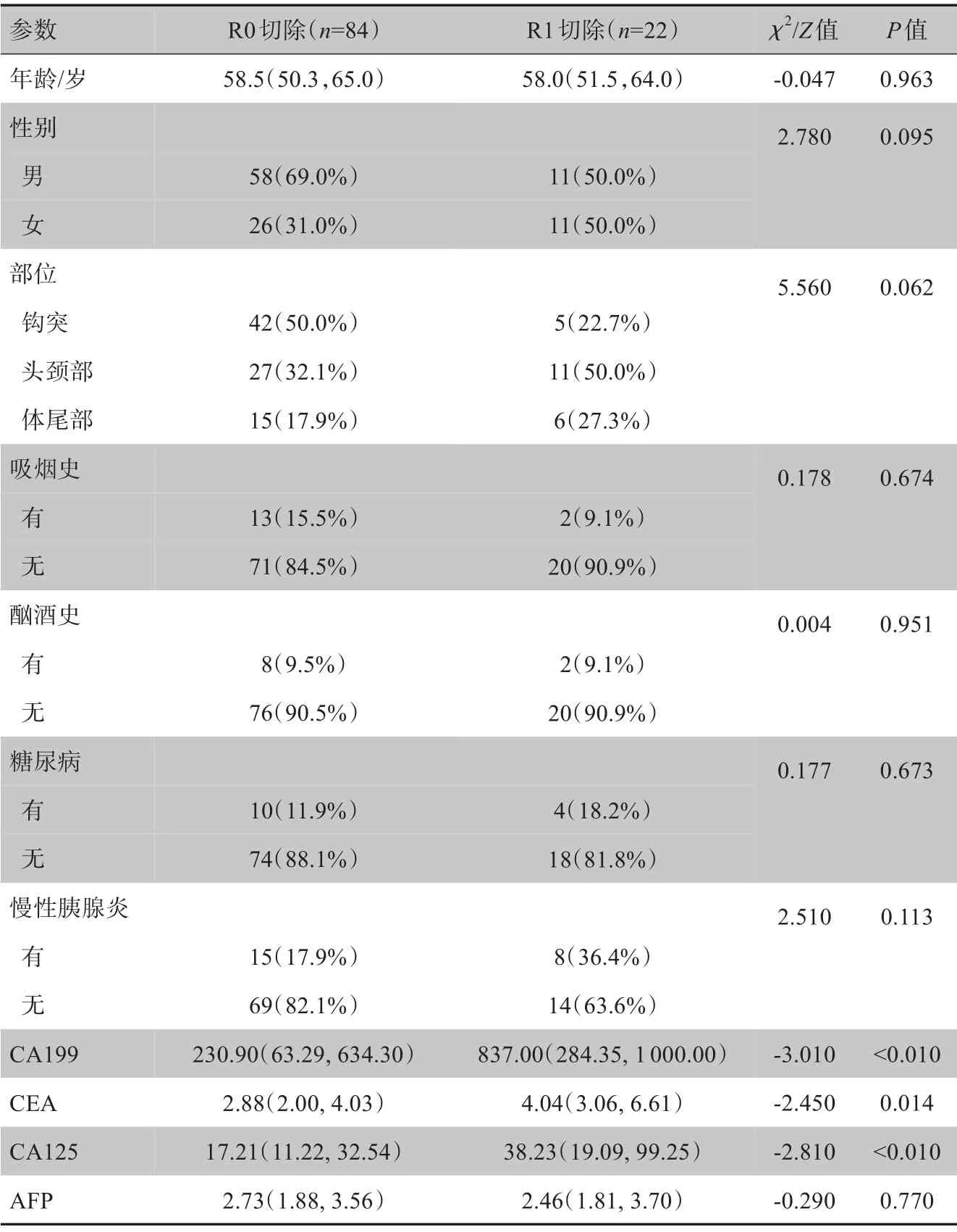
表1 PDAC患者R0与R1切除术前临床基线资料比较Table 1 Comparison of clinical baseline data before R0 and R1 resections in PDAC patients
2.2 PDAC患者的术前CT特征
Kappa检验表明两位放射科医师对于增强CT 特征的判读具有较好的一致性(Kappa值>0.75,P<0.05)。通过对R0 与R1切除的PDAC 患者术前增强CT 特征分析发现,肿瘤横径、T/动脉夹角、T/门静脉夹角、T/肠系膜上静脉夹角、淋巴结转移在两组之间的差异有统计学意义(P<0.05),见表2。
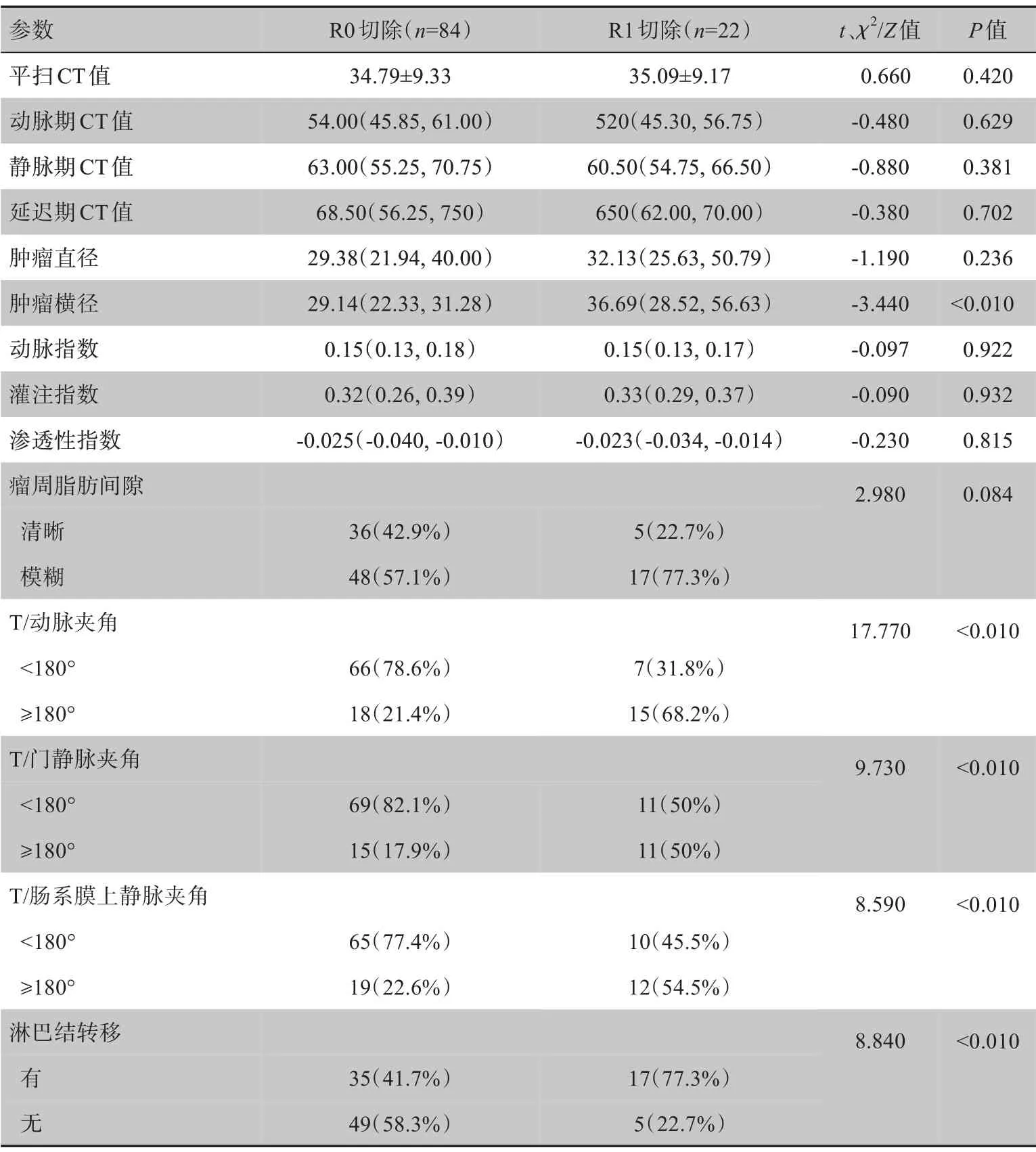
表2 PDAC患者R0与R1切除术前CT特征比较Table 2 Comparison of CT features before R0 and R1 resections in PDAC patients
2.3 多元Logistic回归分析
通过单因素筛选R0 与R1 切除患者的术前临床基线资料和增强CT 特征,将单因素具有统计学意义的因子线性拟合多元Logistic 回归分析,发现淋巴结转移[OR:0.205(CI:0.043-0.972),P=0.046]、T/动脉夹角[OR:0.085(CI:0.017-0.434),P<0.010]、T/门静脉夹角[OR:0.155(CI:0.031-0.783),P=0.024]、肿瘤横径[OR:1.073(CI:1.004-1.146),P=0.037]、CA199[OR:1.003(CI:1.001-1.005),P<0.010]是R0 切除的独立危险因子,见表3。

表3 多元Logistic回归分析R0与R1切除的相关因子Table 3 Multivariate Logistic regression analysis on the factors related to R0 and R1 resections
2.4 构建列线图模型
使用多元Logistic 纳入的因子构建列线图模型以预测PDAC 的R0 切除,列线图上分配给每个因素的值范围从0 到100 的赋值。通过将每个因素的分数相加得到总分,即Total points。基于总分,通过将分数投影到底部数轴上反映PDAC 的R0切除的概率值,见图1。
2.5 模型性能评估及验证
构建的列线图模型需要进行模型的性能评估和校准,使用ROC 曲线反映列线图模型的AUC 值、敏感性、特异性分别为0.906、86.4%、86.9%,见图2。然后使用校准曲线表明模型预测概率与实际发生概率相符,拟合优度检验P=0.054>0.05,表明模型预测性能稳定,见图3。
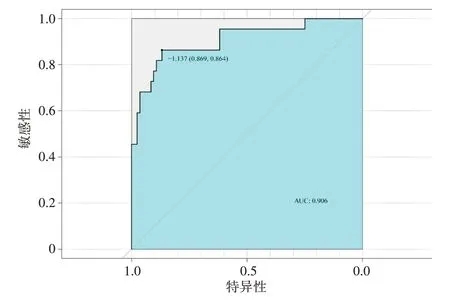
图2 列线图模型的ROC曲线Figure 2 ROC curve of the nomogram model
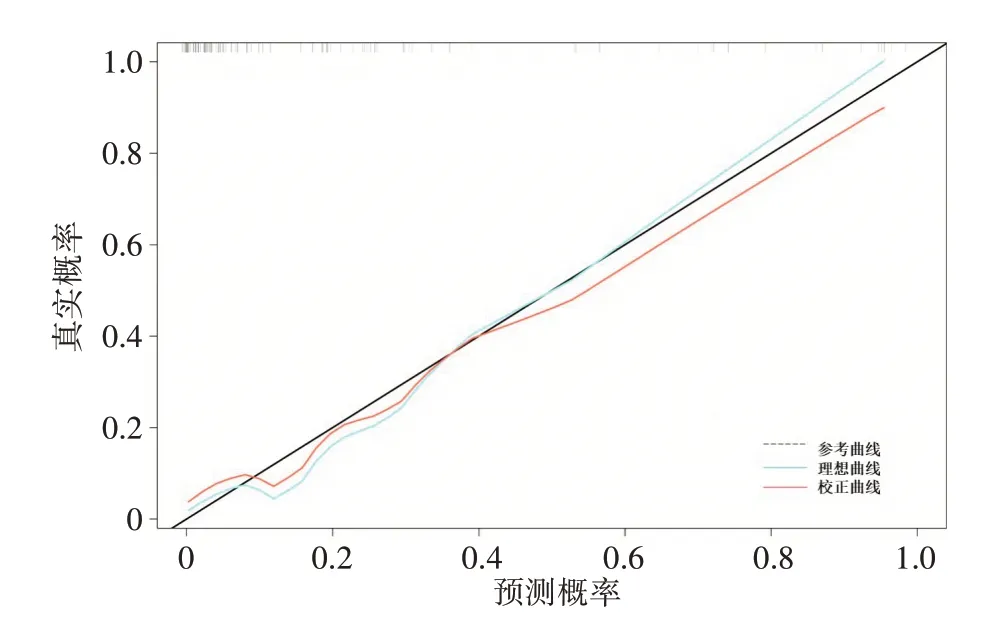
图3 列线图的校准曲线Figure 3 Calibration curve of the nomogram
3 讨论
PDAC占胰腺癌的80%以上,具有高度致死性,预后极差[8-9]。手术切缘阳性(R1)即有残余肿瘤时是PDAC患者不良预后的独立风险因素[10],因此,术前有效评估PDAC是否能达到R0切除对于患者远期预后预测至关重要。本研究通过多因素Logistic回归分析筛选PDAC患者术前临床和CT影像特征变量发现术前肿瘤标志物CA199、T/动脉夹角、T/门静脉夹角、肿瘤横径及淋巴结转移是预测PDAC患者R0切除的独立预测因子。
CA199是一种黏蛋白型糖类蛋白标志物,为细胞膜上的糖脂质,是PDAC最有效的生物标志物和异常糖基化的指标,通过糖基化蛋白与E-选择素结合,增强血管生成并介导免疫反应来加速PDAC的进展,目前已被证明其在预测胰腺肿瘤分期、可切除性、总生存期和患者对治疗的反应中起到一定作用,但其敏感性、特异性较低,需与其他肿瘤标志物联合检测(如癌胚抗原CEA、糖类抗原CA125)[11-13]。另有研究表明CA199在检测级别更高、预后更差的PDAC 的敏感性从76.1%上升到87.2%[14]。本研究结果显示R1切除较R0切除的CA199水平高,较高水平的CA199提示肿瘤恶性潜能高,预后差,在实现肿瘤R0切除上难度大、风险高;CA199还可以检测肿瘤的复发,可用于评估晚期PDAC患者的治疗效果和生存预后[8,15]。因此,术前测定CA199水平或许在预测PDAC肿瘤R0切除中有一定提示意义。
术前增强CT检查手段作为PDAC生存预后重要的依据需要提供更多的肿瘤和瘤周的细节征象。T/动脉夹角、T/门静脉夹角、T/肠系膜上静脉夹角即周围血管与肿瘤的周向接触程度,最大夹角<180°时,肿瘤侵犯血管的可能性小,恶性程度低,实现R0切除的潜能大;当夹角≥180°时,瘤细胞更易侵犯到周围组织的神经和血管,肿瘤达到R0切除的可能性小[16]。本研究结果中,血管与肿瘤的最大夹角<180°时,肿瘤的R0切除率明显增高,T/动脉夹角、T/门静脉夹角、T/肠系膜上静脉夹角<180°时的R0切除率分别为78.6%(66/84)、82.1%(69/84)、77.4%(65/84)。然而,以往对于PDAC的研究很少关注到肿瘤周围环境的特征,如周围血管组织,由此可见,肿瘤与血管的最大夹角(周向接触程度)对于预测PDAC肿瘤达到R0切除上有意义。此外,肿瘤横径在R0切除与R1切除中存在显著差异,达到R0切除的PDAC的肿瘤横径较小。有研究发现当胰腺肿瘤横径小于1 cm时,局限于导管上皮的肿瘤患者的5年生存率可达到100%,意味着肿瘤横径越小,较横径大的肿瘤其生存率好,达到R0切除的可能性大[17]。目前,淋巴结转移状态是影响PDAC患者预后的主要因素之一,也是预测PDAC肿瘤R0切除的独立风险因素,特别是短径超过10 mm的大淋巴结转移[18-19]。Ramacciato等[20]发现对于存在淋巴结转移的PDAC患者来说,清扫的淋巴结数目、淋巴结转移率(LNR)、阳性淋巴结对数比(LODDS)是影响患者预后的独立危险因素。在此基础上,任虎等[18]发现N分期、LNR分级、LODDS分级是PDAC肿瘤R0切除的独立预测因子。此外,PDAC肿瘤患者R0切除后淋巴结浸润较少,这强调了R0切除的重要性,可实现肿瘤控制[21]。本研究中,淋巴结转移的患者获得R1切除达到77.3%,表明存在淋巴结转移状态的PDAC患者R0切除率低、生存期短、预后差。由此可见,淋巴结转移及淋巴结转移相关指标在预测R0切除方面有一定临床参考意义,存在淋巴结转移预示着PDAC更差的生存预后,达到R0切除的困难加大、风险更高,提示淋巴结转移状态在预测PDAC肿瘤R0切除方面有一定价值。本研究是小样本的单中心研究,特别是R1切除病例数量较少,未来需要更大规模、更多数据来验证模型的性能。
综上所述,本研究通过术前增强CT 影像特征结合临床特征构建的列线图模型对于PDAC 患者R0切除的预测具有较高、较好性能,其中术前CA199 水平、T/动脉夹角、T/门静脉夹角、肿瘤横径及淋巴结转移在一定程度上可以预测PDAC 患者R0 切除,可作为R0 切除的预测因子,在患者临床治疗方案的选择及肿瘤预后评估方面具有一定的应用价值。

