14例副肿瘤性周围神经病临床特征分析
刘 举,潘佳丽,杨晓艳,魏芷桦,陈 敏,刘洪波 (郑州大学第一附属医院神经内科,河南 郑州 450052)
副肿瘤性神经综合征(paraneoplastic neurological syndrome,PNS)是一种恶性肿瘤相关的免疫介导的神经系统疾病[1]。经典PNS包括脑脊髓炎、边缘性脑炎、亚急性小脑变性、感觉神经病、慢性肠梗阻、Lambert-Eaton肌无力综合征等[2]。其中,感觉神经病为副肿瘤性周围神经病(paraneoplastic peripheral neuropathy,PPN)最常见的类型[3]。PPN诊断需要合理排除感染、代谢、中毒、退行性、转移性、医源性、自身免疫性疾病等其他非副肿瘤性原因,而上述大多数疾病比PNS更为常见。最近的一项流行病学研究显示约300例恶性肿瘤患者中才有1例出现PNS[4]。因而,在对PPN诊断过程中易出现一些漏诊、误诊、过度诊断等情况,导致治疗不当。此外,由于不断发现新的PNS抗体以及不断明确抗体肿瘤关联程度,促使PNS诊断标准得以更新。本文基于2021年最新的PNS诊断标准,回顾性分析PPN患者的临床资料,探讨其临床特征以指导临床诊疗。
1 资料与方法
1.1 研究对象纳入郑州大学第一附属医院2015年1月至2021年6月收治的PPN患者。入组标准:1)符合2021年PNS诊断标准(表1)[2];2)以周围神经病变为主要表现。排除标准:1)其他临床表型PNS患者;2)感染、代谢、中毒等其他病因所致周围神经病变;3)临床资料记录不完整者。2021年诊断标准基于PNS-Care评分系统,提出了3个诊断水平(确诊、很可能和可能PNS),综合考虑了高或中风险临床表型、高或中风险抗体和恶性肿瘤3个层面[2]。

表1 PNS诊断标准
1.2 研究方法详细记录纳入患者性别、发病年龄、临床表现、PNS抗体、合并肿瘤、肌电图、脑脊液、风湿免疫等检查结果。
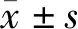
2 结果
2.1 诊断分层共纳入14例PPN患者, 5例为高风险临床表型(3分),9例为中风险表型(2分),均存在高风险抗体(3分),8例合并恶性肿瘤(4分)。因而,8例诊断为确诊PNS(2例10分,6例9分),3例诊断为很可能的PNS(6分),3例诊断为可能的PNS(5分)。见表2。
2.2 一般情况男9例,女5例,发病年龄37~71(55.9±11.3)岁,发病至确诊时间1~24(7.0±8.0)个月,病程4~76(41.4±20.8)个月。见表2。
2.3 主要临床症状及表型5例为感觉神经病,9例为感觉运动神经病,均亚急性或慢性起病。9例表现为四肢麻木无力,3例表现为四肢麻木,2例表现为双下肢麻木,5例出现躯干或肢体疼痛,2例出现言语不清、吞咽困难、声音嘶哑等延髓麻痹症状,1例伴便秘、尿频自主神经症状。见表2。
2.4 血清PNS抗体筛查5例抗Hu抗体阳性,1例抗Hu、GD1a及GM2抗体多重阳性,1例抗Hu、CV2(CRMP5)抗体双阳性,1例抗Hu、SOX1抗体双阳性,3例抗Amphiphsin抗体阳性,2例抗Yo(PCA1)阳性,1例抗CV2(CRMP5)阳性。见表2。
2.5 合并肿瘤情况活检证实,病例1、2、3、4、7等5例于周围神经病诊治过程中发现小细胞肺癌(small cell lung cancer,SCLC),病例6因下腹部包块查出SCLC并腹腔转移,同时伴有肢体麻木无力,病例5于3 a前发现B淋巴母细胞淋巴瘤,2 a前行造血干细胞移植术;病例8于2 a前发现乳腺癌,并行手术治疗。余6例中,5例随访时间27~71个月,未发现肿瘤,1例失访。见表2。
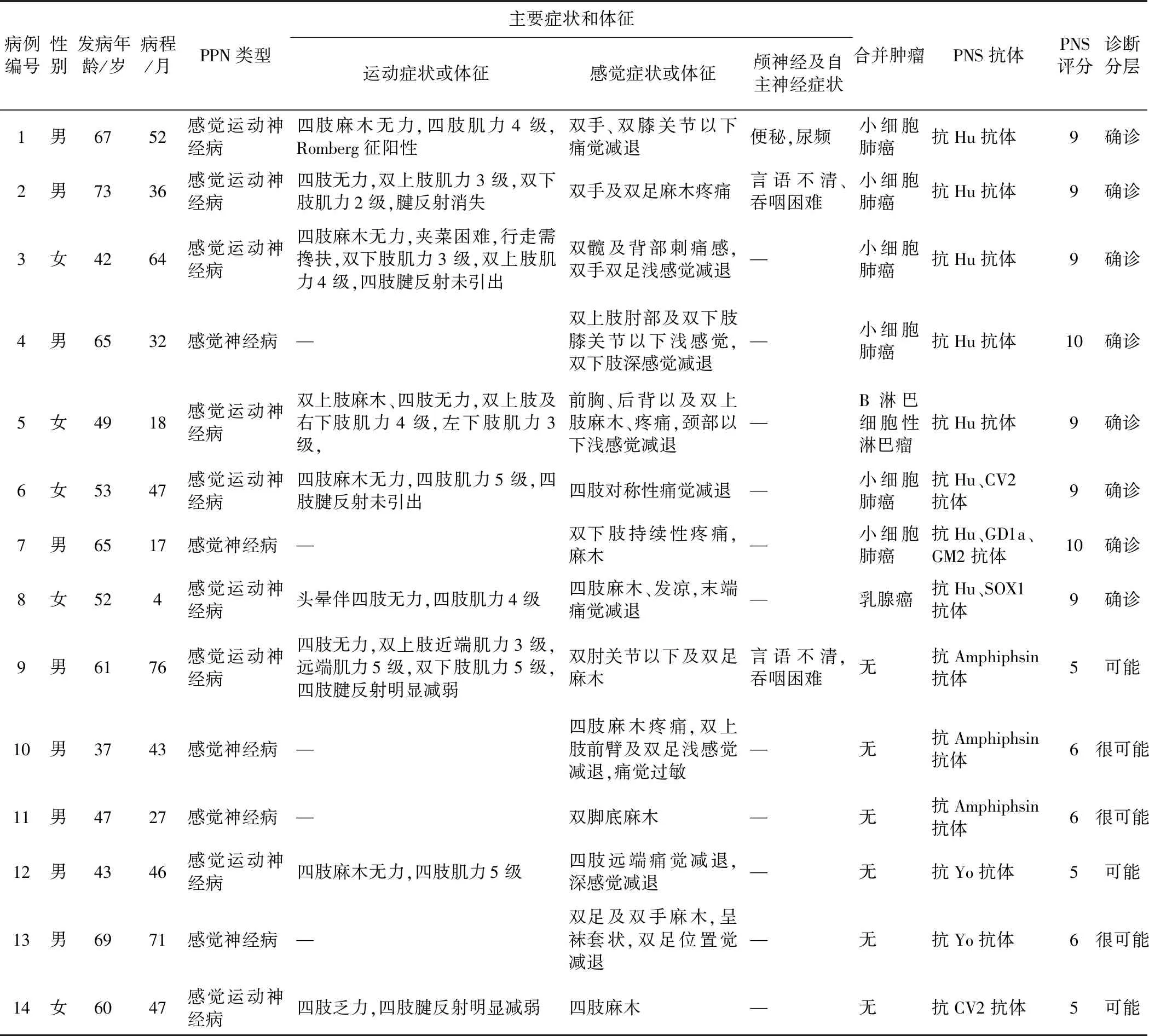
表2 14例PPN患者的临床特征
2.6 神经电生理学检查情况肌电图示:5例为感觉神经病变,9例为感觉运动神经病变;8例以轴突损害为主,6例以脱髓鞘病变为主。
2.7 实验室检查及脑脊液检查情况脑脊液白细胞数为(4.3±4.6)×106个/L,蛋白量为(627.8±204.1)mg/L,病例8脑脊液OB阳性(Ⅱ型)。病例1神经元特异性烯醇化酶32.8 μg/L,抗核抗体(ANA)1:320;病例4 ANA 1:100;病例5 ANA 1:320,抗Ro52抗体强阳性,抗中性粒细胞细胞质抗体弱阳性;其余患者肿瘤标志物、结缔组织病全套、免疫固定电泳、糖化血红蛋白、甲状腺功能等检查均未见明显异常。
2.8 治疗和预后8例明确合并肿瘤者:6例接受化疗,1例免疫抑制治疗,1例激素冲击治疗,其中病例1、2、3、4、6、7接受了化疗,病例5给予免疫抑制治疗,病例8给予激素冲击治疗,且均给予营养神经及对症治疗。经治疗后,病例1、2分别于发病4 a和2 a后死于SCLC,病例3失访,病例5经营养神经对症治疗及病例6经化疗后肢体麻木无力症状明显缓解,病例4经化疗后症状无缓解,目前需推车才能行走,病例7肢体麻木无力加重,且出现了脑转移。6例未明确合并肿瘤者:均给予营养神经及对症支持治疗,病例10失访,病例11、12、13基本恢复正常或症状明显缓解,病例9因球麻痹症状,营养不良,病情逐渐加重死亡,病例14肢体麻木无力症状无缓解,且出现小脑萎缩和痴呆表现。14例患者中,2例失访,3例死亡,4例无缓解或加重,5例缓解。
3 讨论
既往研究[4]表明,PNS发病率为0.89/10万人年,有逐年上升趋势,而PNS的患病率为4.37 / 10万,其中8%的PNS患者为PPN,次于边缘性脑炎(31%)、小脑变性(28%)和脑脊髓炎(20%)。本研究纳入患者依据2021年最新的PNS诊断标准诊断[2]。2004年国际专家小组曾确定了一套PNS诊断标准,并广泛应用于临床和研究[5]。随着PNS的研究进展,既往诊断标准部分已经过时,比如典型或不典型综合征不合并肿瘤时特征性抗体阳性即可确诊,而2021年诊断标准中确诊PNS(评分≥8)包括同时存在高或中风险表型、高或中风险抗体以及恶性肿瘤[2]。新标准使PNS诊断更加确定,为临床及基础研究提供更为可靠资料。
本研究纳入PPN患者男性居多,中老年占绝大多数,最近的一项研究表明PNS中位年龄为68(26~90)岁[4],两者基本一致。也有文献[6]报道抗Hu抗体阳性PNS患者中75%为男性。本研究中感觉神经病约占1/3,感觉运动神经病约占2/3,亚急性或慢性起病,可伴有颅神经和自主神经症状。感觉神经病为PNS经典副肿瘤综合征或高风险表型,而感觉运动神经病类型为非经典综合征或中风险表型[2, 5]。PPN以感觉神经病最为常见,是指由背根神经节感觉神经元受累引起的一种表型,可伴有运动症状[7]。本研究中所有患者均存在感觉神经损害,多数以轴突损害为主。感觉神经病的诊断(不管病因如何)也需遵循一定标准[8]。有研究[9-10]表明,感觉神经病肌电图表现是感觉神经动作电位的严重和弥漫性改变、轴突损害为主或混合型轴突和脱髓鞘损害。此外,本研究中患者脑脊液常规基本正常,脑脊液蛋白量轻度增高,可呈现蛋白细胞分离现象,容易误诊为急性格林-巴利综合症或慢性炎症性脱髓鞘性多发性神经病,若疗效不佳,需进行PNS抗体筛查。
本研究中抗Hu抗体阳性者最多,其次是抗Amphiphysin抗体、抗Yo抗体、抗CV2阳性。既往研究[6, 11-12]表明,感觉神经病最常见的是抗Hu抗体,其次是抗CV2和抗amphiphysin抗体。抗Hu抗体被称为抗神经核抗体1型(ANNA-1),于1985年首次被描述,以2例患者的姓氏的首字母命名,2004年由Graus等[5]归类为PNS特征性抗体。抗Hu抗体阳性者以SCLC患者居多(>85%)[6]。本研究中8例恶性肿瘤患者均抗Hu抗体阳性,6例患SCLC,1例患乳腺癌,1例患淋巴瘤。抗Hu抗体的致病机制目前仍不清楚,通常被认为不直接致病,T细胞介导的细胞免疫才是PNS致病机制[13]。
不同于抗Hu抗体,既往研究[9]表明抗CV2抗体可导致轴突和脱髓鞘混合型损害的感觉运动神经病,并且约50%抗CV2抗体阳性者可出现小脑性共济失调等表现。与之一致,病例14除了感觉运动神经病之外,还伴有进展性小脑性共济失调及认知功能减退。此外,有研究[14]报道,抗Yo抗体见于感觉神经病,抗Amphiphysin抗体可导致感觉运动神经病[15],然而,本研究结果显示抗Yo、Amphiphysin抗体可导致感觉神经病或感觉运动神经病,需扩大样本量总结。抗amphiphysin、Yo、 CV2抗体阳性者随访2 a以上均未发现肿瘤,需继续随访。
此外,3例患者出现多重抗神经元抗体阳性。病例7血清抗Hu抗体阳性,同时抗GD1a、GM2抗体阳性,脑脊液蛋白轻度增高,病程4月,表现为双下肢持续性麻木疼痛,存在SCLC,临床表型为高风险临床综合征,综合考虑为确诊PNS。神经节苷脂抗体在PNS发病机制中的作用尚不明确,需进一步阐明[16]。另外,1例抗Hu、CV2抗体阳性,1例抗Hu、SOX1抗体阳性。既往研究[17-18]表明联合检测血清肿瘤标志物或非血清淀粉样蛋白A联合肿瘤标志物检测能显著提高肺癌辅助诊断的敏感性和阳性率,同样,以上3例多重抗体阳性患者均合并恶性肿瘤(SCLC或乳腺癌),提示多种抗体并存对肿瘤的预警监测、早期发现意义重大,涉及的病理机制也更加复杂。
纳入患者8例合并恶性肿瘤,以SCLC为主,其余6例随访2 a以上均未发现肿瘤。有研究[4]表明PNS最常见的原发性肿瘤是SCLC(17%)和乳腺癌(16%),其次是淋巴瘤(12%)。本研究结果提示PPN中合并SCLC比例较PNS要更高一些。PNS的症状通常出现在发现恶性肿瘤之前。恶性肿瘤是最新诊断标准确诊PNS的必要条件,不合并恶性肿瘤者仅诊断为可能或很可能,非确诊PPN有助于肿瘤早期诊断和治疗,是降低死亡率和复发率的关键所在。
在治疗方面,有研究[19]报道,感觉神经病的治疗窗口期不超过2~3个月。一些研究[20]尝试了免疫调节或免疫抑制剂治疗,包括大剂量激素冲击治疗、血浆置换、环磷酰胺、利妥昔单抗等。其中一些研究表明轻微改善或稳定,但总体而言,无肯定结论,只提供Ⅳ类证据[21]。一项大样本抗hu抗体阳性患者的回顾性研究[6]表明,肿瘤早期治疗是唯一与神经功能稳定显著相关的因素。此外,神经病理性疼痛等对症治疗不可忽视[22]。
总之,由于恶性肿瘤和周围神经病变均比较常见,两者可能在很多患者偶然并存,PNS抗体非PNS充分条件,在临床实践或科研中,需要采用更为严格的2021年PNS诊断标准。本研究中PPN患者表现为感觉神经病或感觉运动神经病,以抗Hu抗体阳性者和SCLC最多见,可采用免疫抑制剂治疗,早期治疗原发肿瘤,少数可缓解症状,但总体预后不佳。

