肿瘤浸润淋巴细胞在cT1N0M0期乳腺癌淋巴结转移中的预测价值
赖灿辉 罗丽云 刘琦 林志敏 张江灵
作者单位:362000 泉州 中国人民解放军联勤保障部队第910医院1肿瘤科;2甲乳外科
腋窝淋巴结是乳腺癌早期转移的常见部位,其转移状态是评估早期乳腺癌预后的重要因素。前哨淋巴结活检(sentinel lymph node biopsy,SLNB)是一种能够准确检测腋窝淋巴结转移的微创手术,其检测的前哨淋巴结是原发肿瘤转移的第一站淋巴结[1-2]。在早期乳腺癌患者中,目前研究报道前哨淋巴结转移(sentinel lymph node metastasis,SLNM)发生率高达18.8%~29.6%[3-7],但也有研究在早期乳腺癌和无法触及腋窝的患者中使用超声,表明前哨淋巴结活检本身可能代表腋窝超声阴性患者的手术过度治疗[8]。因此,寻找早期预测SLNM的指标具有重要意义。由癌症相关成纤维细胞、血管生成细胞和浸润性免疫细胞组成的肿瘤微环境与癌症侵袭和转移密切相关,而肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)是一种从肿瘤组织中分离出的浸润淋巴细胞,是肿瘤微环境一个有价值的指标[9]。既往研究显示,TIL可作为早期胃癌淋巴结转移的预测因子[10]。一项基于澳大利亚黑色素瘤研究所数据库的研究发现,有明显TIL浸润的患者预后良好,且TIL分级是生存和前哨淋巴结(sentinel lymph node,SLN)状态的独立预测因子[11]。在乳腺癌中,CAZIUC等[12]也发现TIL是早期和局部晚期患者淋巴结状态有效的预测因素。但目前TIL在cT1N0M0期乳腺癌SLNM中的预测价值尚不明确。本研究旨在探讨TIL在cT1N0M0期乳腺癌患者SLNM预测中的价值,以明确TIL在乳腺癌中的作用,并为术前评估SLNM状态提供新方法。
1 资料与方法
1.1 研究对象
选择2008年1月至2016年12月在本院术前诊断为cT1N0M0期后接受手术作为一线治疗的乳腺癌患者为研究对象。纳入标准:⑴乳腺癌均通过芯针活检(CNB)或真空辅助活检(VAB)进行病理诊断;⑵接受了乳房切除术或保乳手术者;⑶年龄>18岁者;⑷cT1N0M0期乳腺癌患者。排除资料不完整者。本研究根据《赫尔辛基宣言》进行。研究方案经本院伦理委员会批准(批准号:200801210345),所有患者均提供了书面知情同意书。
1.2 数据收集
采用本院电子病历系统收集患者的一般资料及临床资料包括年龄、肿瘤大小等。免疫组化检测癌组织中雌激素受体(ER)、孕激素受体(PgR)、人表皮生长因子受体2(HER2)和Ki67的表达水平。根据免疫组化染色结果将乳腺癌分为以下亚型:HER2 enriched乳腺癌(ER-、PgR-和 HER2+);三阴性乳腺癌(ER-、PgR-和 HER2-);激素受体(HR)+HER2+乳腺癌(ER+和/或 PgR+,HER2+);HR+HER2-乳腺癌(ER+和/或PgR+,HER2-)。根据既往研究,Ki67的临界值定义为14%[13]。
1.3 TIL密度评估
在活检标本中进行TIL密度的组织病理学评估。TIL的定义和评估基于国际TILs工作组2014年指南,该指南随机选择5个视野中肿瘤基质内浸润淋巴细胞计算平均密度[14]。将TIL密度分为0~3分:TIL密度>50%记为3分,TIL密度介于10%~50%记为2分,TIL密度<10%记为1分,TIL密度为0记为0分。
1.4 SLNM鉴定
对影像学诊断怀疑腋窝淋巴结转移的患者进行腋窝淋巴结清扫,否则行SLNB。根据既往研究[15-16],使用放射性同位素和染料方法组合鉴定SLN。SLNs切成2 mm厚的切片,并通过病理诊断是否转移[17-18]。根据第八版AJCC分期系统[19]对SLNM进行分类。宏转移:淋巴结内存在一个以上>2 mm的肿瘤病灶;微转移:0.2 mm<肿瘤病灶最大径≤2 mm;孤立肿瘤细胞:单个细胞或最大径≤0.2 mm的小细胞簇。
1.5 统计学方法
采用SPSS 16.0进行数据分析。计量资料采用均数±标准差描述,组间比较采用独立样本t检验;分类资料采用n(%)描述,组间比较采用χ2检验或Fisher精确概率法。采用单因素和多因素logistic回归分析影响cT1N0M0期乳腺癌患者发生SLNM的因素,计算优势比(OR)及其95%可信区间(CI)。采用受试者工作特征(ROC)曲线评估TIL密度预测SLNM的价值。本研究以双侧P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
本研究共招募213例患者,经排除标准排除60例后,共153例患者纳入分析,平均年龄为(58.4±11.0)岁;其中SLNM 30例(19.6%),包括宏转移22例,微转移8例。其余特征详见表1。

表1 cT1N0M0期乳腺癌患者的一般资料Tab.1 Baseline characteristic of patients with cT1N0M0 breast cancer
2.2 TIL密度与cT1N0M0期乳腺癌患者临床病理特征的相关性
根据TIL密度评分将患者分为0~1分组和2~3分组,并分析TIL密度与cT1N0M0期乳腺癌患者临床病理特征的关系,结果显示,TIL密度与ER状态(P<0.001)、PgR 状态(P=0.003)、HER2状态(P=0.029)、Ki67表达(P=0.025)、核分级(P=0.026)相关,见表2。
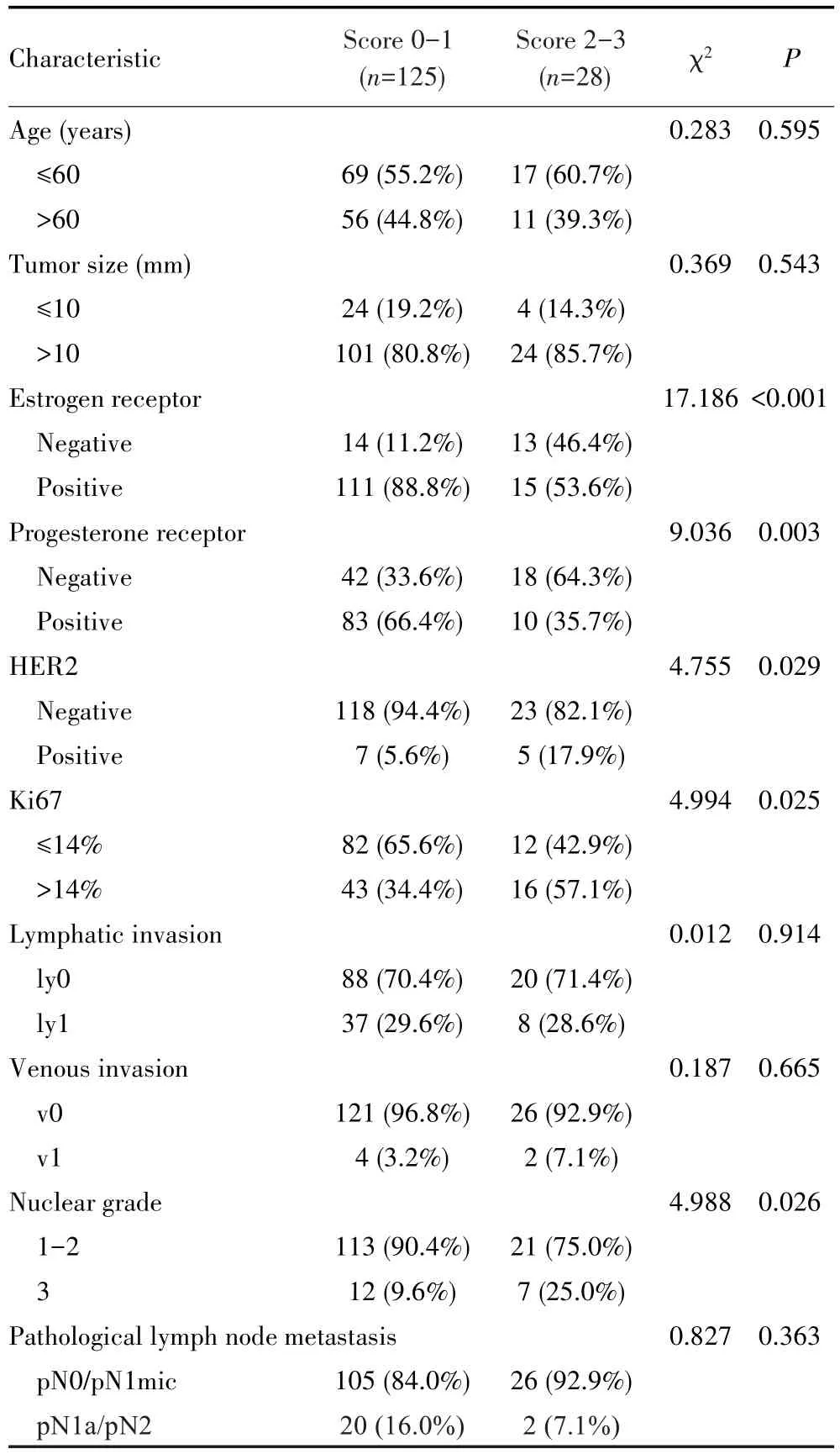
表2 TIL密度与cT1N0M0期乳腺癌患者临床病理特征的关系Tab.2 Relationship between TIL density and clinicopathological characteristics in cT1N0M0 breast cancer patients
2.3 影响cT1N0M0期乳腺癌前哨淋巴结转移的因素
单因素logistic回归分析显示,肿瘤大小(OR=2.09,95%CI:1.22~3.56,P=0.007)、淋巴侵袭(OR=2.53,95%CI:1.14~5.59,P=0.022)、TIL密度(OR=1.50,95%CI:1.22~1.83,P<0.001)与 cT1N0M0 期乳腺癌SLNM有关;进一步多因素logistic回归显示,肿瘤大小(OR=1.87,95%CI:1.09~3.23,P=0.024)、淋巴侵袭(OR=1.72,95%CI:1.09~2.73,P=0.020)、TIL密度(OR=1.40,95%CI:1.15~1.71,P=0.001)均是影响 cT1N0M0期乳腺癌SLNM的独立因素,见表3。

表3 单因素和多因素logistic回归分析cT1N0M0期乳腺癌患者前哨淋巴结转移的因素Tab.3 Univariable and multivariable logistic analysis with sentinel lymph node metastasis for cT1N0M0 breast cancer
2.4 TIL密度预测cT1N0M0期乳腺癌SLNM的价值
采用ROC曲线评估TIL密度预测cT1N0M0期乳腺癌SLNM的价值,结果显示,AUC为0.755(95%CI:0.680~0.830,P<0.001)、灵敏度为0.694(95%CI:0.588~0.801)、特异度为0.702(95%CI:0.605~0.800),最佳截断值为41.7%,表明TIL密度预测SLNM的效能良好,见图1。

图1 TIL密度预测cT1N0M0期乳腺癌前哨淋巴结转移的ROC曲线Fig.1 ROC curve of TIL density predicting sentinel lymph node metastasis in cT1N0M0 breast cancer
3 讨论
本研究在术后cT1N0M0期乳腺癌患者中探讨TIL与淋巴结转移的相关性以及TIL在预测SLNM中的价值,发现术后cT1N0M0期乳腺癌患者的SLNM发生风险较高,发生率达19.6%。同时还发现TIL密度是影响SLNM的独立因素。因此,深入探索两者的关系有助于指导患者的精准治疗并改善预后。
目前影响SLNM的因素已有较多报道,如年龄、病理类型、ER阳性、PgR阳性、HER2阳性等,其中淋巴浸润是最常报道的预测因素之一[1-3,5,12,20]。本研究发现高TIL密度评分的患者其ER阳性率、PgR阳性率、HER2阳性率、Ki67>14%的比例以及病理核分级更高,提示高TIL密度患者的复发和转移风险更高。关于TIL密度与SLNM的关系,CAZIUC等[12]纳入172例早期和局部晚期乳腺癌患者,其中76例首先接受手术患者和96例接受术前化疗的患者,发现两组患者中TIL与淋巴结状态均存在相关性。该研究不仅评估了SLN,还评估了由于SLNM导致额外腋窝淋巴结清扫的情况下的腋窝淋巴结,但没有对可能影响TIL密度的亚型进行分析,也没有分析TIL与临床病理因素的关系。本研究进一步分析了影响SLNM的因素,结果在单因素和多因素logistics回归分析中证实TIL密度是影响cT1N0M0期乳腺癌SLNM的独立因素。同时,采用ROC曲线评估TIL预测SLNM的效能,结果显示其AUC为0.755,灵敏度为0.694,特异度为0.702,证实TIL密度在评估SLNM中具有较高的诊断效能。
本研究存在一定的局限性。⑴本研究作为小样本单中心回顾性研究,有关结论仍需通过大规模的临床研究进行验证。⑵未分析TIL密度对患者预后的预测效能,后期研究将进一步完善生存数据分析。⑶本研究纳入的HER2阳性和三阴性乳腺癌患者例数较少,且排除了部分远处转移以及原发病灶<20 mm的患者,可能限制了研究结论的普适性。
综上所述,TIL与cT1N0M0期乳腺癌患者ER状态、PgR状态、HER2状态、Ki67表达以及核分级相关,且高TIL密度是SLNM的危险因素,在SLNM预测中也表现出了较高的诊断效能,因此TIL密度有望作为预测指标用于指导早期乳腺癌患者的个体化治疗以及预后评估。

