三种厚朴叶绿体基因组的比较研究
张 敏, 尹彦棚, 周罗静, 任 波, 王 丽, 时小东, 侯飞侠, 彭 成, 高继海*
( 1. 成都中医药大学 药学院 西南特色中药资源国家重点实验室, 成都 611137; 2. 四川省林业科学研究院, 成都 610065; 3. 成都大学, 成都 610106 )
厚朴()、凹叶厚朴(subsp.)及日本厚朴()均为木兰科药材两用经济林阔叶树种,广泛分布于韩国、日本和中国等地区,具有水土保持、绿化、美化环境和药用等多种应用价值(彭梦婕,2020)。目前三种厚朴的相关研究主要集中在化学成分、临床应用及资源调查等方面(胥爱丽等,2021)。然而,日本厚朴非我国原产资源,生长于相对低温环境中,具备许多优于另两者的生物学性状,如其耐寒能力相比于其他木兰属植物更强(Kwon & Oh, 2015),生长速度和成熟率都比同类植物更快,尤其是在生长幼期,以每年60~90 cm的速度成长(Oguchi et al., 2017),是解析和培育厚朴类物种优良性状的理想材料。然而,日本厚朴的分子遗传学研究资料匮乏,且三种厚朴的生长速度和抗寒能力差异的形成原因缺乏分子生物学机制研究,进而影响了厚朴类优良品种的选育。
叶绿体是植物细胞中必不可少的细胞器,在光合作用、固碳以及氨基酸的合成中起到重要作用,其全基因组包含大量遗传信息,结构高度保守,被广泛应用于植物分子进化及系统发育研究,并在药用植物的遗传转化、基因工程和分子选育等方面发挥着重要作用(赵祺等,2021)。目前,厚朴和凹叶厚朴已有叶绿体基因组报道,而具有更多生物特性的日本厚朴却缺乏叶绿体基因组的研究。鉴于此,本研究利用Illumina HiSeq高通量测序技术,对日本厚朴进行了叶绿体基因组测序,与既有的厚朴、凹叶厚朴叶绿体基因组比对,筛选出了诸多差异的核苷酸序列,破译三种厚朴之间的亲缘关系,找出三种厚朴具有更强生长发育能力和耐寒性等功能的相关基因,在一定程度上为以更强的生长速度和抗寒能力为优良性状的目标物种提供了依据。
1 材料与方法
1.1 材料及预处理
日本厚朴新鲜、幼嫩、健康的叶片于2019年10月10日采自四川省成都市温江区成都中医药大学药用植物园(30°42′ E,103°49′ N),经国家中药种质资源库专家高继海副教授鉴定所有样品均来源于木兰科木兰亚属日本厚朴()。三种厚朴的命名参考于中国植物物种信息数据库(http://db.kib.ac.cn/)。叶片使用无菌水擦拭干净,迅速冻存备用。凭证标本(馆藏序列号为ZYC190910)保存于成都中医药大学中医药传统文化博物馆。
叶绿体提取步骤如下:新鲜叶片于液氮中研磨后悬于一定量A液(50 mmol·LTris,25 mmol·LEDTA,1.25 mol·LNaCl,0.25 mmol·LVc,1.5% PVP,pH 3.6)中,4层纱布过滤,4 ℃下200离心20 min,取上清,加入常温缓冲液B(50 mmol·LTris,25 mmol·LEDTA,1.25 mol·LNaCl,0.25 mmol·LVc,1 mmol·LDTT,0.1%牛血清蛋白BSA,pH 8.0),常温静置,4 ℃下2 000离心10 min,弃上清,叶绿体沉淀于4 ℃保存备用。
1.2 叶绿体基因组提取和测序
针对叶绿体材料,采用改良的CTAB法(Matthes et al., 2020)分离提取DNA。DNA经检测合格后,先用超声波机械打断,再进行片段纯化、末端修复、3′端加A、连接测序接头,进行PCR扩增形成测序文库,最后使用高通量测序平台Illumina HiSeq PE150 进行测序。测序得到的原始测序序列(Raw Reads),里面含有带接头的、低质量的Reads,为了保证信息分析质量,对Raw Reads进行过滤、质控,得到Clean Reads,用于后续信息分析。数据过滤的主要步骤如下:(1)去除带接头的Reads;(2)过滤N含量超过10%的Reads;(3)去除质量值低于10的碱基超过50%的Reads。对过滤后的高质量数据随机抽取2 000条 Reads数据,通过BLAST软件比对NT库检测样品是否受到污染。
1.3 叶绿体基因组的组装和注释
原始序列上传于国家生物信息中心数据库(序列号PRJCA004348)。先利用Galaxy在线平台(https://usegalaxy.org)对日本厚朴叶绿体基因组测序结果进行组装(Yan et al., 2015),且下载厚朴(., NC_020316)和凹叶厚朴(subsp, JN867581)的叶绿体基因组FASTA文件,合并后作为日本厚朴的参考基因文件。再通过CPGAVAS2在线平台(http://www.herbalgenomics.org/cpgavas2)完成厚朴、凹叶厚朴、日本厚朴叶绿体基因组的注释。
1.4 聚类分析
除厚朴、凹叶厚朴外,又于NCBI数据库中下载荷花玉兰(, JN867584)、星花玉兰(, NC_039941)、望春玉兰(, KY085894)、武当玉兰(, JX280401)、玉灯玉兰(‘Lamp’, JN227740)、宝华玉兰(, MH607378)、紫玉兰(, JX280397)、天女木兰(, NC_041435)、云南拟单性木兰(, KF753638)、鹅掌楸(, NC_030504)、北美鹅掌楸(, NC_008326)共11种木兰科植物的叶绿体基因组数据,其中包括2种鹅掌楸属植物和其他9种木兰科植物。利用MEGA X软件,基于邻接法(NJ法)构建日本厚朴在内的14种木兰科植物的系统发育树,观察并分析它们之间的亲缘关系(Yan et al., 2015)。
2 结果与分析
2.1 叶绿体基因组信息
通过Illumina HiSeq高通量测序平台测序共获得日本厚朴叶绿体19 816 708 条原始数据,移除接头和低质量的Reads,共获得Clean Reads 19 791 019条,Q30为91.33%。通过在线组装发现日本厚朴全长160 051 bp,符合目前已知的木兰类植物叶绿体基因组大小范围(159 429~160 183 bp),厚朴叶绿体拥有目前已知木兰类植物的最大基因组(160 183 bp),而凹叶厚朴的叶绿体基因组为160 099 bp。
三种厚朴叶绿体基因均具有典型的四分区域结构,其中LSC分别为88 210 bp(厚朴)、88 145 bp(凹叶厚朴)和 88 156 bp(日本厚朴),SSC分别为18 843、18 832和18 771 bp,2段反向互补重复的IR区(IRA和IRB)分别为26 565、26 566和26 562 bp。三种厚朴IR、LSC和SSC区域的GC值存在一定的差异,其中GC含量最高的区域都为IR区,分别为43.2%、43.1%和43.2%,LSC区次之,均为37.9%,而SSC区域的GC值最小,仅分别为34.2%、34.3%和34.3%。与其他物种叶绿体基因组相似的是,三种厚朴的1也跨越了SSC和IRA区,其中位于IRA区域长度均为1 279 bp,厚朴、凹叶厚朴位于SSC区域长度为4 311 bp,比日本厚朴长51 bp。除此之外,日本厚朴特有的1基因还跨越了SSC和IRB区,其序列长度分别为29、1 279 bp。
通过基因组结构比较,发现三种厚朴叶绿体的rRNA和tRNA数量相同(表1)。在基因数量方面,凹叶厚朴相比厚朴多2个单拷贝基因,而两者又较日本厚朴分别少了4个和6个。在编码区数量方面,凹叶厚朴与厚朴相比多2个编码区,而日本厚朴数量最多,比前两者分别多8个和10个。这揭示了厚朴与凹叶厚朴的叶绿体基因组可能存在较小的结构和功能差异,而日本厚朴的叶绿体基因组结构和功能可能较其他两者更为丰富。
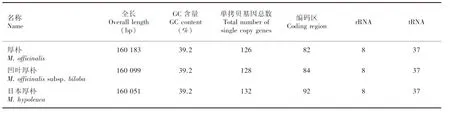
表 1 三种厚朴叶绿体基因基本信息Table 1 Basic chloroplast genes information of three Magnolia species
2.2 叶绿体内含子、外显子比较
对三种厚朴的叶绿体基因组注释文件进行分析,发现在近百个木兰类叶绿体基因组编码基因中,19个存在内含子、外显子的差异而3个基因的内含子、外显子数量和长度完全一致(表2)。在这19个差异片段中,厚朴与凹叶厚朴的差异主要表现在11个,其中9个片段的差异区在I类内含子(In I,核苷酸数量差异在20以内),2个在Ⅱ类内含子(InⅡ,核苷酸数量差异在2以内),还有1个差异片段存在Ⅱ类外显子(2的EPⅡ,40 bp,此区域也为厚朴、凹叶厚朴叶绿体基因组差异最大的区域)。相较于前两个厚朴物种,日本厚朴存在更多差异,尤其是-基因的I类内含子比前两者多920个核苷酸,甚至还多了三种全表达的功能基因(22、1-和15,)(表2),这些结果再次显示厚朴与凹叶厚朴的叶绿体基因组之间的差异较小,而日本厚朴的叶绿体基因组在结构和功能方面较其他两者更为丰富。
在三种厚朴叶绿体的2个12基因中,一个正常含有3个外显子,而另一个缺失了I类外显子,无法正常表达,可能为假基因。植物叶绿体基因普遍具有保守性与突变性(转移或损失等)并存的现象,其转录涉及到复杂的反向剪接等过程,本研究发现三种厚朴中12的几个外显子为反向排列,且为非顺序式。核糖体小亚基基因的假基因转化在物种进化过程中起到重要作用(Liu et al., 2020),因此12核苷酸序列的差异可为厚朴类亲缘关系研究提供重要参考。三种厚朴叶绿体差异最大的3基因,其差异区域数达4个(I类、Ⅱ类内含子和I类、Ⅲ类外显子),日本厚朴的I类外显子增加了102个核苷酸。此外,与木兰类植物的叶绿体基因组条形码-、等相似,本研究针对三种厚朴的比较分析发现-、16、1、、、2等基因的变异位点率、信息位点率较高,也具备开发为少数木兰植物鉴定条形码的潜力。

表 2 三种厚朴叶绿体基因组内含子、外显子比较Table 2 Comparison of introns and exons of three Magnolia species chloroplast genomes
2.3 叶绿体功能基因比较


表 3 三种厚朴叶绿体的功能基因比较Table 3 Comparison of chloroplast functional genes of three Magnolia species
综合本文内含子与外显子、功能基因的结构分析结果, 三种厚朴叶绿体基因组的差异主要分布于LSC区和IR区,涉及核糖体大亚基、核糖体小亚基和未知功能基因类群,尤其是诸多未知功能的基因,而木兰属中这类疑似非功能基因的结构特征、变异原因,以及与适生环境差异的关联性,有待进一步深入研究。
2.4 部分木兰科植物的亲缘关系
由图1可知,在14种近缘物种叶绿体基因组构建的NJ发育树(节点支持率均在75%以上)中,鹅掌楸属和其他属是木兰科中的两个独立的谱系,这与之前报道的结果一致(陈凯,2019)。在其他属的2个次级类群中,三种厚朴、天女木兰、荷花玉兰聚类在一起,其中日本厚朴与凹叶厚朴亲缘关系最为密切,其次是厚朴。其他属中另外一个次级类群包括云南拟单性木兰、玉灯玉兰、紫玉兰、武当玉兰、望春玉兰、星花玉兰、宝华玉兰,它们与三种厚朴亲缘关系由近及远。

图 1 部分木兰科物种系统发育树Fig. 1 Phylogenetic tree of partial Magnoliaceae plants
3 讨论与结论
本研究使用全基因组测序来组装和比较三种厚朴的叶绿体基因组,以此来推测三种厚朴之间多种生物学性状差异的形成原因。低温环境下,植物最先受到抑制的生理代谢过程是光合作用,低温能显著降低光合效率、CO同化作用和光系统Ⅱ活性,从而影响植物的正常生长发育(王璐等,2020)。通过三种厚朴叶绿体的功能基因比较,发现日本厚朴基因在数量上较另两者增加了一个,这可能缘于基因的自我复制。和是光合系统Ⅱ的关键基因,例如小麦成熟叶绿体psbC蛋白的合成发生于含序列的转录本上,形成-复合物,它们的转录水平受到光诱导, 通过增强光合系统Ⅱ亚基的合成和维持能力,提高叶绿体的合成速度(Gamble et al., 1988; Gamble & Mullet, 1989),从而提高叶绿体的光合作用强度,进而加快植物的生长发育。此外,-基因协同转录的mRNAs可以翻译产生D2和CP43蛋白,与反应中心D1、CP47、放氧复合体蛋白及捕光复合体Ⅱ等蛋白,共同参与叶绿体光合系统Ⅱ的光合电子传递,在强光条件下维持光合系统Ⅱ的功能(庄焜扬,2020)。-复合体直接参与光合系统Ⅱ亚基的形成,在生长旺盛和存在颜色差异的叶片中发挥着保护光合系统、减少强光伤害的作用(Adachi et al., 2012),这在花叶矢竹叶等光合系统Ⅱ中基因的研究中也得到证实(许冰清等,2015)。因此,日本厚朴叶绿体增加的基因表明其具备合成更多-复合体与D2蛋白的潜力,这可能是日本厚朴生长速度更快、适应较北纬度地区低温和强光胁迫环境的原因之一。
在高变异位点率的功能基因中,22为日本厚朴中特有,其位于LSC区,属于基因表达相关功能基因,可用于物种鉴定(Feng et al., 2019)。此外,本研究发现三种厚朴的差异基因主要分布于22所属的基因簇中,它们组成23操纵子的大转录单元,翻译为核糖体大蛋白亚基。本研究发现,此操纵子在三种厚朴中存在显著的结构差异:23-2-19-22(日本厚朴)-3(凹叶厚朴、日本厚朴)-16-14-8--36-11-。通过三个物种的亲缘关系可知,凹叶厚朴、日本厚朴与厚朴分化的过程中,该操纵子19-16之间原有的核苷酸空隙逐次被3、22基因填充,同时造成操纵子中多个功能基因的内含子、外显子核苷酸发生了增减(减少为主),功能蛋白的数量和活性也发生了改变。植物叶绿体除了光合作用外,还部分参与氨基酸、核苷酸、脂类和淀粉等各类成分的生物合成,支撑起该植物的生物学性状(Namgung et al., 2021),日本厚朴具备更丰富的核糖体基因簇,这无疑形成了其更丰富的生物学特性。
tRNA作为核酸信息水平和蛋白质功能水平的适配器,在蛋白质翻译中起着核心作用,其结构修饰影响植物体的温度适应能力(Lorenz et al., 2017)。本研究发现日本厚朴tRNA-ALA比其他两种厚朴多3个,具有快速转运和积累丙氨酸的潜力,而游离态的丙氨酸能抵抗多种外界环境刺激(Mustroph et al., 2014),如寒冷因子。除了数量因素外,三种厚朴叶绿体中tRNA对应的氨基酸种类也不同。日本厚朴为本属植物中分布较为北端(如千岛群岛)的物种,其生境中弱光和低温信号交叉影响着植物的生长发育,在这种光温胁迫条件下,tRNA可能一方面积累更多的游离丙氨酸,另一方面降低正常蛋白质翻译速率,将正常蛋白质合成转向应激反应蛋白质的合成(冯德江等,2002),最终使得植株具备更强的耐寒性,这又为厚朴优良品种的分子筛选和培育提出了参考。

