海南主要陆域自然保护地兰科植物多样性与生境的关联分析
周 康, 张 哲, 宋希强, 李大程, 陈枳衡, 张中扬, 李霖明
( 海南省热带特色花木资源生物学重点实验室/海南大学 林学院, 海口 570228 )
兰科植物一般分布于温暖、湿润、通风且具散射光的环境中,生境特点决定了其地理分布的不均匀性,水平方向主要集中在热带及亚热带地区,垂直方向上以山地为分布中心,而低海拔平原地区则零星分布(Crain & Melania, 2020)。此外,兰科植物拥有高等植物中最全的生活类型,在大范围上,种类丰富且分布广泛;但在小尺度上,由于独特的生活型、生活史特征和特殊的生境需求(Michae & Mark, 2009; Schödelbauerova et al., 2009),多以小种群或小区域分布,较其他植物类群更容易遭受生境退化与丧失的威胁(Nigel & Kingsley, 2009)。
生存环境的差异,导致不同区域的兰科植物种类组成和数量多寡有显著的差别,简单的分析推测对野生兰花资源的保护极其不利。因此,系统全面地分析兰科植物多样性与具体生境因子的关系将有助于了解影响其多样性变化的关键因素,进而提出更有针对性的保护策略。近年来,探索影响植物多样性的关键因子的研究逐渐成为热点,其中区域面积、隔离程度、地形地貌、气候等因子成为主要研究对象(Traxmandlová et al., 2018)。研究表明,在大尺度水平上,区域面积是物种数量的决定性因素,其次是隔离程度、温度和降水,但针对某一特定类群,植物多样性的驱动因素可能会偏离这样的模式(Kreft et al., 2008)。有学者指出,物种分布面积本身不太可能驱动物种的形成,地理隔离程度被认为是主要驱动因素(Price & Wagner, 2004; Kisel & Barraclough, 2010; Franklin et al., 2013),也就是说面积本身或生境地多样性是驱动物种与面积关系的主要因素(Triantis et al., 2003)。在岛屿兰科植物多样性与生境的关系研究中,面积与气候和地形预测因素的高度解释力以及这些变量之间的强相关性表明,随着面积的增加,由气候和地形地貌共同组成的生境多样性的增加可能是物种与面积关系的主要驱动力(Keppel et al., 2016)。越来越多的证据指出,生境多样性驱动了兰科植物多样性的变化,在小尺度水平上将各生境因素细化,比较各因素之间的相对重要性成为研究兰科植物多样性生境驱动因素的重要方向(Triantis et al., 2012)。目前,研究最深入的生境因子是海拔(Traveset et al., 2014; Zhang et al., 2015),而全球性的开放数据库的建立使得地形地貌和气候因子同样易于量化获取,二者也成为研究热点(Stein et al., 2014)。上述研究共同促成了更加精细化的兰科植物多样性与生境多样性的相关关系,为野生兰科植物资源的保育提供了颇具实际意义的信息。
海南野生兰科植物资源多样性研究指出,绝大多数兰花都分布在岛屿的中部和南部山区,通常集中生长于海拔500~1 500 m潮湿的热带森林中(Hu et al., 2015)。有研究者运用除趋势对应分析(DCA)等方法,对霸王岭林区不同森林类型中的附生兰科植物的多样性和分布情况进行了研究,比较分析发现分布海拔范围相近的森林类型中的附生兰相似性更高,山地常绿林和山顶矮林附生兰科植物的相似性高达88.9%,较高海拔的3种森林类型(山地雨林、山地常绿林、山顶矮林)中,附生兰科植物的丰富度和多度均显著高于较低海拔的3种森林类型(热带季雨林、低地雨林、热带针叶林),这表明海拔和森林类型的变化对该地区附生兰科植物多样性具有显著影响,同时也反映了二者的显著相关性(刘广福等,2010)。宁瑶(2018)结合3S技术和MaxEnt物种分布模型,初步探究了珍稀濒危种华石斛()对部分气候和地形地貌因子的适应性,并以此预测出其潜在适宜分布地为较为凉爽、暖季气温不高且海拔在1 000 m以上的中山山地。但整体来看,海南关于生境与兰科植物多样性的关系的研究资料相对不足,且研究对象不全面,范围狭窄,方法单一,缺少大范围内多因素作用机理和关联分析的综合研究。
近年来,生物多样性面临生境破坏带来的巨大威胁,保护工作迫在眉睫。研究区域涵盖了海南岛中南部6个主要自然保护地,整合了全海南最为宝贵的生物资源,由于长期受到人类活动干扰及自身生境的特殊性与脆弱性等因素的影响,该区域的生物多样性逐年减少,随着热带雨林国家公园建设的方兴未艾,此地的生物多样性保护工作迫在眉睫,而兰科植物的多样性可在一定程度上反映区域性的生物多样性维持和保护状况(金效华等,2011;田怀珍等,2013)。在这样的大背景下,该研究针对海南主要陆域自然保护地的野生兰科植物开展实地资源调查。拟回答以下科学问题:(1)兰科植物资源的物种多样性和分布格局现状;(2)影响兰科植物多样性的关键生境因子有哪些。上述研究结果将有助于深入掌握该区域的兰科植物的种群大小、资源分布、生存环境适应规律等,为相关单位制定兰科植物保育策略提供本底资料和科学依据。
1 研究方法
1.1 研究区概况
研究样方全部位于海南中南部的霸王岭国家级自然保护区(BW)、尖峰岭国家级自然保护区(JF)、鹦哥岭国家级自然保护区(YG)、五指山国家级自然保护区(WZ)以及吊罗山国家级自然保护区(DL)和黎母山省级自然保护区(LM)6个主要自然保护地内。其内海拔超过1 400 m的山峰有五指山(1 867 m)、鹦哥岭(1 812 m)、猴猕岭(1 655 m)、黑岭(1 560 m)、三角山(1 499 m)、尖峰岭(1 412 m)、黎母山(1 411 m)等。气候类型为热带海洋性季风气候,干湿季较为分明,年均气温22.5~26.0 ℃,年均降雨量为1 759 mm。土壤类型以砖红壤为主,随海拔的上升逐渐过渡为赤红壤、山地黄壤和山顶草甸土,王下乡部分地区为喀斯特溶岩地质。研究区是我国分布最集中、保存最完好、连片面积最大的热带雨林的主要组成部分,复杂的地质和气候因素共同造就了丰富的生物多样性,众多海南特有的生物资源分布于此,其中不乏极其珍稀、濒危的兰科植物。
1.2 野外调查
1.2.1 样线和样方设置 2020年7月至2020年12月开展了为期半年的野外调查工作。在课题组长达二十年的调查基础上,综合考虑兰科植物的生物学特性、生活型、生境特点和植被类型等,选择具有代表性的地段设置样线。基本要求如下:(1)样线长度依实际情况而定,一般不小于1 000 m;(2)样方、样木均设置在样线两侧各20 m内的位置,各样方之间的距离不小于10 m;(3)也可选择一些孤立的大树、残存的自然植被、特殊的物种等单独设置样方;(4)样方大小为5 m × 5 m,样木为冠幅不小于5 m × 5 m的乔木。最终在黎母岭、斧头岭、雅加大岭、东五石峰、王下、俄贤岭、尖峰岭、叉河口、南开、鹦哥嘴、青介、五指山主峰、青春岭、什坡、三角山、吊罗后山、枫果山等地共布设92条样线,1 840个样方(图1),样方垂直分布范围111~1 867 m。
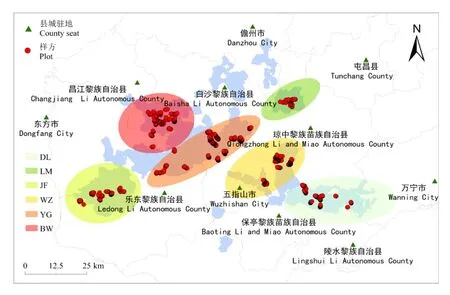
蓝色区域表示研究区范围,白色区域表示非保护区。Blue area represents the scope of the study areas, white area represents the non-protected areas.图 1 研究区域样方示意图Fig. 1 Diagram of the plots in the study area
1.2.2 调查内容 记录兰科植物种名、个体数量、生活型以及物候期;样方植被类型、经纬度、海拔、地形地貌、坡位、坡向、坡度、郁闭度以及外界干扰程度等信息;进行疑难种的少量标本采集、照片拍摄,用于种类鉴定,数据记录标准如下。(1)根据生活基质的不同,分为4种生活类型:地生、地生/石生、附生、附生/石生,腐生兰计入地生类。(2)海拔梯度:H(100~300 m)、H(300~500 m)、H(500~700 m)、H(700~900 m)、H(900~1 100 m)、H(1 100~1 300 m)、H(1 300 m~1 500 m)、H(>1 500 m)。(3)植被类型:热带季雨林、热带低地雨林、枫香林、热带山地雨林、热带山地常绿林、山顶矮林。(4)地形地貌:低山丘陵、中山山地、河谷地貌、喀斯特地貌。(5)坡位:谷地、下部、中下部、中部、中上部、上部、山脊、山顶。(6)坡向:阴坡(北)、半阴坡(东北、西北、东)、半阳坡(西、东南、西南)、阳坡(南)、无坡向。(7)外界干扰程度:无干扰、轻微干扰、中度干扰、强度干扰。(8)计数困难的部分生于树上或岩石上的兰科植物,具有假鳞茎的计算活的假鳞茎数量,否则按照植株或茎或根状茎的数量进行计算。(9)兰科植物命名和分类系统参考《中国野生兰科植物原色图鉴》(金效华等,2019)。
1.3 数据分析
1.3.1 多样性指数 首先运用软件Excel 2019进行各海拔段兰科植物种类和数量的统计分析,计算Gleason丰富度指数()、Shannon-Wiener多样性指数(′)、Pielou均匀度指数()、Simpson优势度指数()(马克平,1994),计算公式如下:
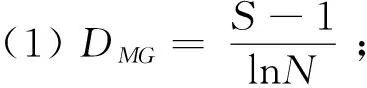
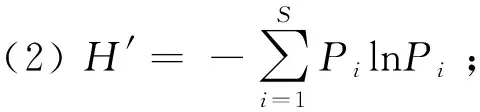
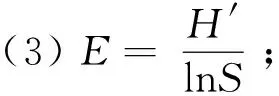
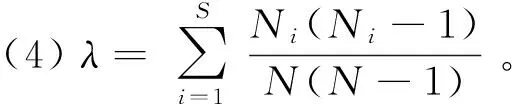
式中:为物种数目;为/;表示第个种的个体数;表示所有兰科植物的个体总数。
1.3.2 物种组成与生境因子的关系CCA排序 采用单峰模型中的约束性排序-典范对应分析(canonical correspondece analysis, CCA)探索生境因子与物种组成之间的关系。物种数据矩阵由193种兰科植物在1 840个样方内的存在与否(0, 1)组成,矩阵为1 840行×193列。生境数据矩阵由野外调查中记录的样方和其对应的实测生境因子数据组成,考虑到植被类型和海拔的显著相关性,选择连续性较好的海拔因子,另外,外界干扰程度由自然环境和人为活动共同构成,对物种组成的塑造存在较大偶然性,也不考虑在内,最终选择了海拔、地形地貌、坡位、坡向、坡度、郁闭度6个生境因子,矩阵为1 840行 × 6列。该分析的数据处理和出图均采用Canoco 5软件。
1.3.3 物种丰富度及多度与生境因子的GLM回归分析 基于广义线性模型(generalized liner model, GLM)的多元扩展的方法可以明确地解释物种丰度数据(包括多度)的超分散现象(Benesh & Kalbe, 2016)。本研究采用R语言Mvabund包来拟合广义线性模型,从而探究生境因子对研究区域野生兰科植物丰富度和多度变异的影响。选取1 840个样方的物种丰富度和多度数据,二者皆为计数数据,假设其符合负二项分布,它与生境因子之间可用对数函数连接,之后用7种生境因子(植被类型、海拔、地形地貌、坡向、坡度、郁闭度、干扰程度)共同拟合模型。为了获得准确的结果,本次分析基于9 999次自检验估计显著性。
2 结果与分析
2.1 兰科植物的物种组成情况
本次野外调查共发现了分属于4个亚科的67属193种兰科植物(除去未鉴定出的种,详细名录见附表),分别占到了海南岛野生兰科植物总数(102属317种)的65.7%和60.9%。图2统计结果显示,万代兰族和柄唇兰族(Podochileae)都超过了10个属,其内绝大多数种属于典型的热带亚热带附生型兰科植物,在海南岛处于优势地位;沼兰族虽然只有3属,但在种类数上却占有绝对优势,有55种之多。从表1的种属组成结果来看,寡种属占比高达47.8%,主要集中在贝母兰族(Arethusea)以及万代兰族;种类数占比最大的是2~5种的小属,以粉药兰族(Cranichideae)和柄唇兰族为主;包括石豆兰属()、石斛属、兰属()和隔距兰属()等在内的几个传统大属在本次调查中仍然占比最大,占到总种类数的37.8%。
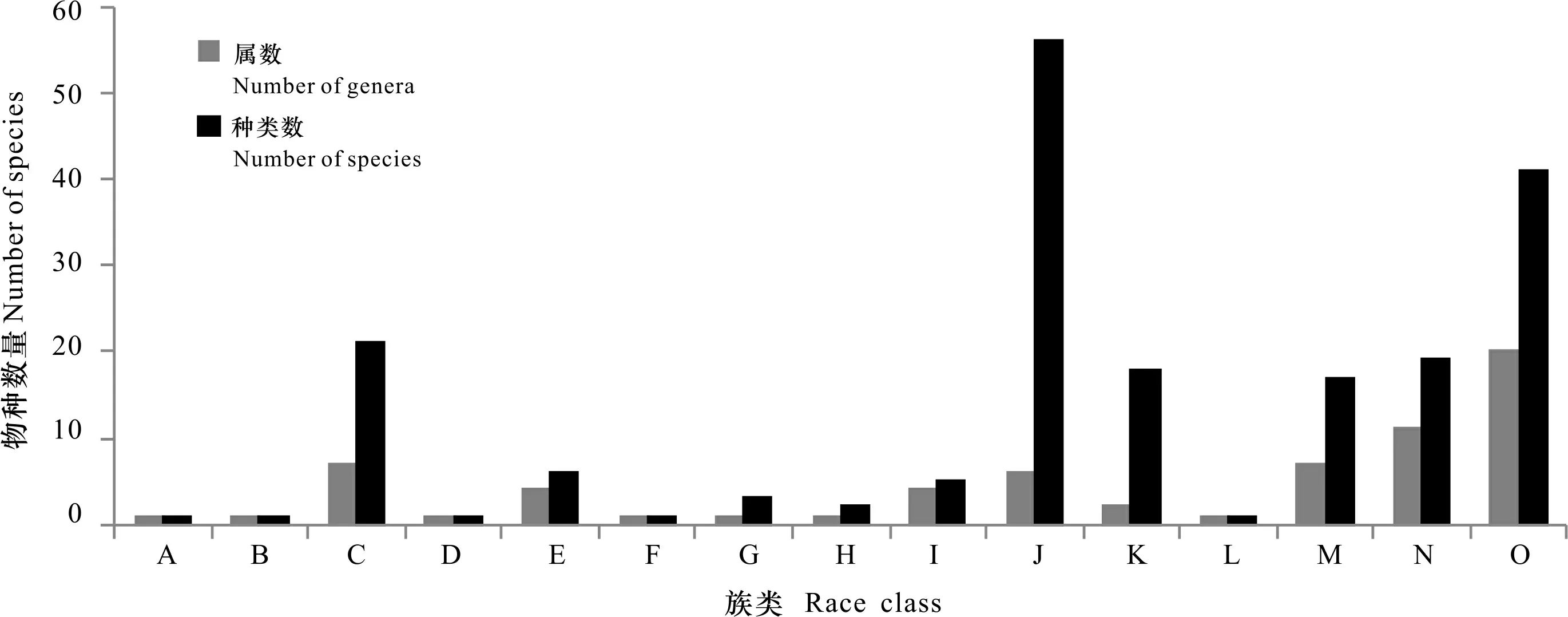
A. 拟兰属; B. 兜兰属; C. 粉药兰族; D. 双尾兰族; E. 红门兰族; F. 鸟巢兰族; G. 竹茎兰族; H. 芋兰族; I. 贝母兰族; J. 沼兰族; K. 兰族; L. 树兰族; M. 吻兰族; N. 柄唇兰族; O. 万代兰族。A. Apostasia; B. Paphiopedilum; C. Cranichideae; D. Diurideae; E. Orchidinae; F. Neottieae; G. Tropidieae; H. Nervilieae; I. Arethuseae; J. Malaxideae; K. Cymbidieae; L. Epidendreae; M. Collabieae; N. Podochileae; O. Vandeae. 图 2 兰科植物在各族中的属和种数量分布Fig. 2 Distribution of the genera and species of orchid in various races
2.2 兰科植物多样性水平分布格局
采用4种多样性指数来描述研究区域兰科植物多样性的水平变化规律。从表2可以看出,Margalef丰富度指数()与简单物种数量呈明显正相关,对于全部种类而言,霸王岭的兰科植物丰富度指数达到了13.432 1,此地生境异质性极强,拥有五花八门的小生境区块,十分有利于兰科植物的遗传分化。附生型兰科植物则有所不同, 鹦哥岭的丰富度指数最大(=3.790 7),鹦哥岭山脉是海南岛最长的一条山脉,自西南向东北延伸,成为海南岛东西部的分界岭,热带季风在吊罗山和五指山的阻挡下到达这里变得微弱,但正是这微弱的水汽资源却深受兰花的喜爱,相对干燥的空气和平行密布的开阔河谷成为附生兰科植物的天堂。‘附生/石生’型兰科植物种类最多,丰富度指数自然也比其他生活型更高,其中黎母山和尖峰岭相对较小,黎母山纬度最高,温度条件不适合部分热带‘附生/石生’型兰科植物的生存,而尖峰岭地区处于海南岛西部最干燥的地区,加之近年来极端气候频发,中低海拔地区时常遭遇极端干旱天气,造成大量兰花的死亡。地生型兰科植物丰富度指数最大值出现在海拔落差最大的五指山,达到了3.839 2,明显高于其他保护地。‘地生/石生’型兰科植物丰富度指数最大值仍然出现在霸王岭,这里有广阔的热带针叶林带,被松针覆盖的薄土层,拥有兰科植物需要的丰富的养分和水分,且排水良好,斑叶兰属()、带唇兰属()、虾脊兰属()等属的部分兰科植物适宜在此生长繁殖。
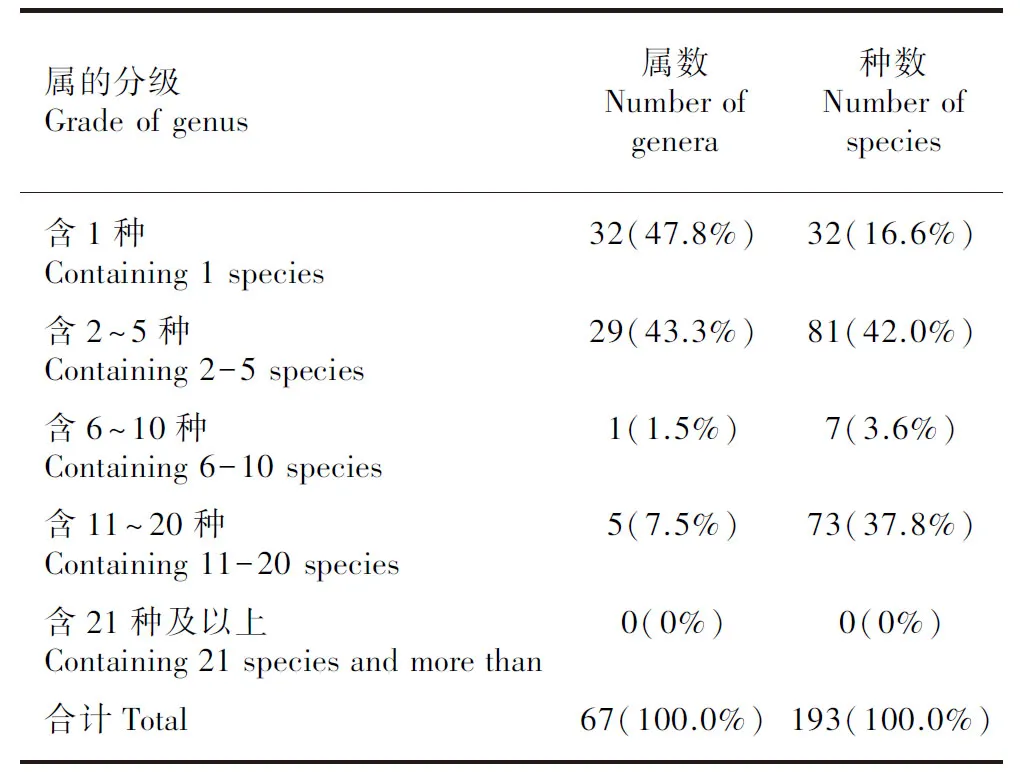
表 1 兰科植物属和种数量的统计结果Table 1 Statistical result of numbers of genera and species of orchid
Shannon-Wiener多样性指数(′)不仅能够体现某一群落内兰科植物的多寡,还能测量群落的异质性,因此是一个内涵丰富的指标,其与均匀度指数呈明显正相关,即多样性指数越大,群落物种的异质性就越大,分布更为均匀,Pielou均匀度指数()也会更大。从研究结果来看,五指山的兰科植物多样性指数最高(′=3.705 7),鹦哥岭次之(′=3.625 3),尖峰岭明显小于其他保护地,只有2.495 5,由此推断尖峰岭的兰科植物异质性较低,存在明显的优势种,据实地调查结果可知,尖峰岭中海拔段河谷拥有丰富多样的兰科植物,部分克隆繁殖的‘附生/石生’型兰科植物如戟唇石豆兰()、芳香石豆兰()通常在裸露的岩石上或者枯木上成片集中生长,数量惊人,因此造成多样性指数和均匀度指数都较低,这从该地‘附生/石生’型兰科植物的多样性指数和均匀度指数便能看出(′=2.226 2,=0.550 6)。
Simpson优势度指数()与均匀度指数呈明显负相关,用来测度群落优势种的优势程度,一般优势度较大的群落均匀度不会太高。本次调查结果显示,霸王岭地生型兰科植物的优势度指数(=0.635 1)明显高于其他保护地,究其原因,主要是因为在石灰岩地区有极大的红花斑叶兰()居群,成为所在小群落的优势类群。而吊罗山大吊罗中高海拔的林缘山坡上有不计其数的竹叶兰()居群分布,另外二裂叶虾脊兰()等喜爱生长在高海拔阴湿沟谷下石壁薄土层的兰科植物也占据了一定的草本生态位优势,因此在‘地生/石生’种类中拥有较高的优势度指数(=0.605 9)。
2.3 兰科植物多样性垂直分布格局
对各海拔段兰科植物的多样性进行比较以探究兰科植物组成的多样性、均匀度以及优势度随海拔的动态变化趋势(表3)。从表2可以看出,全部种类和两种生活型大类的兰科植物的丰富度指数都在H海拔段出现峰值,向两侧延伸则出现缓慢下降,这与简单种类数量的变化趋势一致。无论是全部兰科植物还是附生大类的兰科植物,H海拔段的多样性指数均为最高(′=3.686 5、 3.461 3)。值得注意的是,H海拔段比相邻的H海拔段的多样性指数更高,这与丰富度指数的大小关系不同,暗示H比H的物种异质性要小一些。而地生大类的兰科植物则在更高的H海拔段拥有多样性指数的最大值(′=2.669 8),说明此类兰科植物虽然也在中海拔段最丰富, 但是更高的H海拔段有相当的物种丰富度,且种类之间异质性更低,相互竞争关系较弱,形成了比较温和的群落生态。
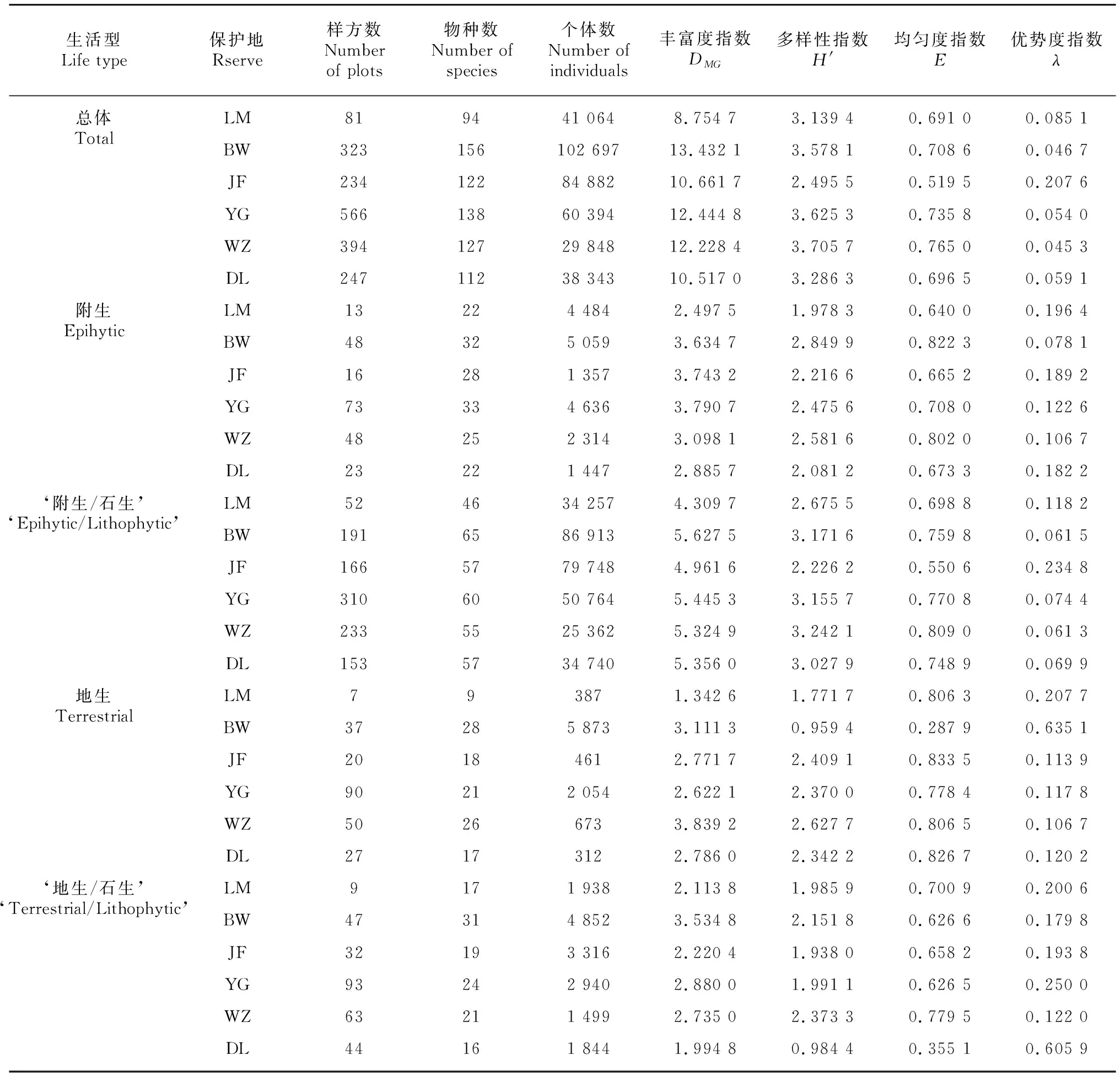
表 2 不同保护地兰科植物多样性指数Table 2 Diversity indexes of orchid in different reserves
对于全部或者附生大类的兰花而言,均匀度指数与优势度指数这对负相关的指数都在H海拔段有各自的最小值(0.582 8、0.595 9)和最大值(0.166 7、0.187 4),即该海拔段的兰科植物群落异质性较高,不同种之间差异明显,且竞争十分激烈,具有明显的优势种,附生大类的兰科植物这一特征最为明显。结合实际情况可知,H海拔段的开阔河谷拥有成片分布的多花脆兰()、海南石斛()、剑叶石斛()等,它们完全占据了石生草本层和附生层的优势生态位,制约了其他兰花甚至非兰花种类的生长。而二者的均匀度指数最大值(0.755 3、0.802 1)都出现在最高的H海拔段,这里的兰科植物丰富度都较低,优势度最小值(0.041 0、0.048 4)则同为H海拔段,前述结果已经表明该海拔段兰科植物最为丰富,复杂的种类构成削弱了部分优势种的作用。
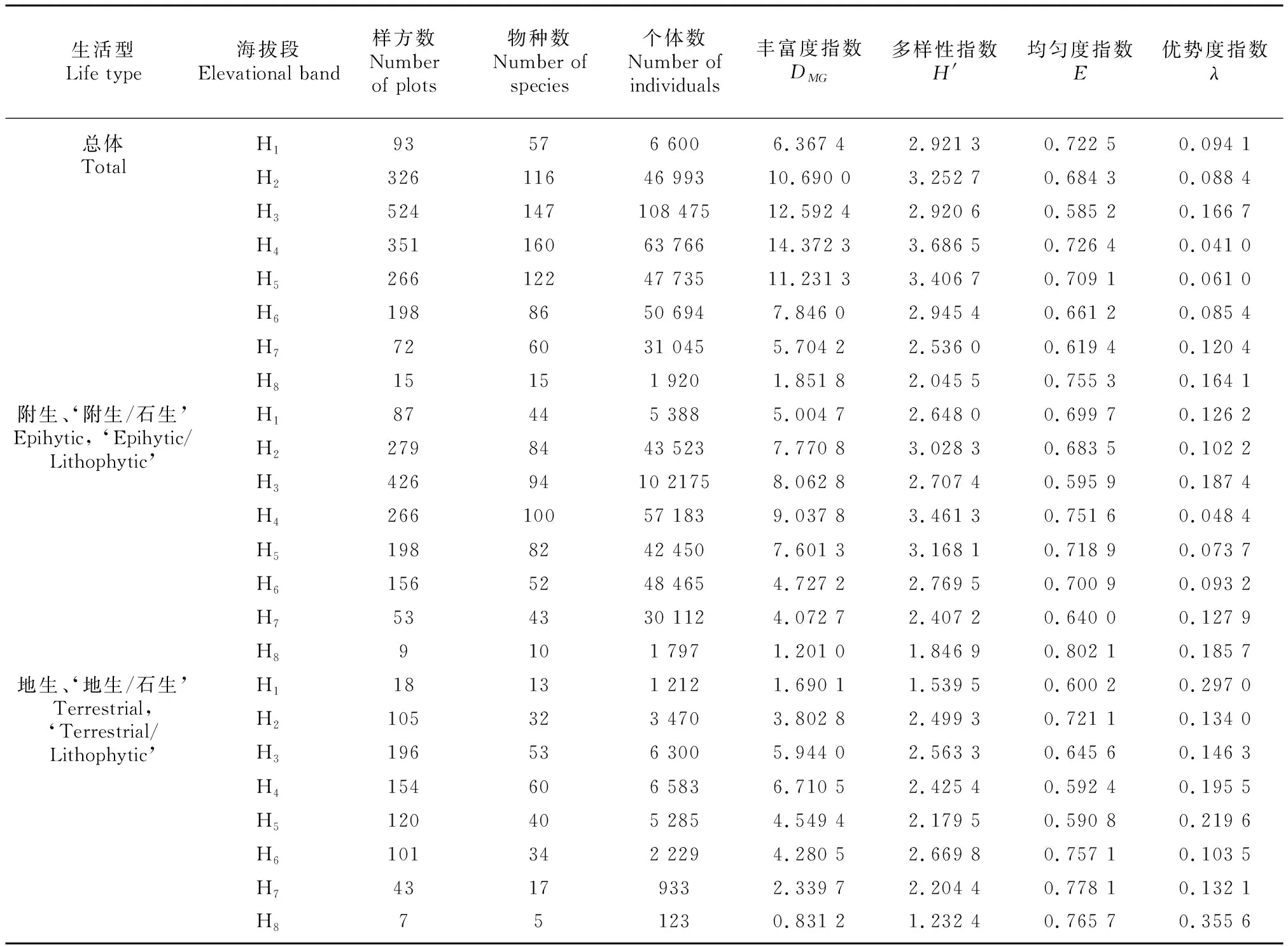
表 3 不同海拔段兰科植物多样性指数Table 3 Diversity index of orchid at different elevational bands
地生大类的兰科植物的均匀度和优势度分布格局有所不同。首先,各海拔段之间兰花均匀度指数的差异并不明显,因为偏地生型的兰科植物丰富度不及附生大类,而且它们通常位于植物群落的底部,对由海拔梯度变化带来的环境变化的敏感性相对较低。1 500 m以上的山顶矮林地带地生兰种类不多,其中以绒叶斑叶兰()、小舌唇兰()、云叶兰()等种类的植株数量最为丰富,它们的多度远超其他兰花,这导致H海拔段拥有最高的生态优势度(=0.355 6)。
2.4 兰科植物组成与生境因子的关系
从表4可以看出,CCA排序结果解释了物种组成总变异的6.2%,基于所有典范特征值之和的蒙特卡洛随机置换检验为极显著(=0.002),这暗示兰科植物组成格局与所选生境因子之间强烈的相关关系。CCA前两轴有比第3和第4轴更高的特征值(0.658 3、0.370 9),表明前两轴在对物种组成变异的解释中起主导作用,它们分别解释了物种组成总变异的1.19%和0.67%。从生境因子与典范轴之间的相关系数可以清晰地看到,海拔、中山山地地形以及中下部坡位与第1轴显著负相关(-0.891 0、-0.737 4、-0.474 0),而河谷、低山丘陵地形和喀斯特地貌则与之显著正相关(0.486 8、0.315 7、0.200 6),说明该轴综合反映了海拔、地形地貌以及坡位的梯度,但主要是海拔和地形地貌(高的相关系数);喀斯特地貌、西北坡向以及坡度与第2轴显著正相关(0.683 6、0.276 5、0.244 7),河谷地貌和谷地坡位则与第2轴负相关(-0.405 9、 -0.261 4),说明该轴主要反映了地形地貌梯度,同时也反映了坡位、坡向和坡度梯度。基于蒙特卡洛随机置换的检验结果表明,除部分坡位和坡向因子对兰科植物组成变异的解释率未达到显著水平外, 其余生境因子均较显著地解释了兰科植物组成的变异,其中解释变异量最多的是海拔(1.2%),其次为喀斯特和河谷地貌(0.6%; 0.4%),另外两种地形、郁闭度以及中部和谷地坡位也解释了一定的物种组成变异(表5)。
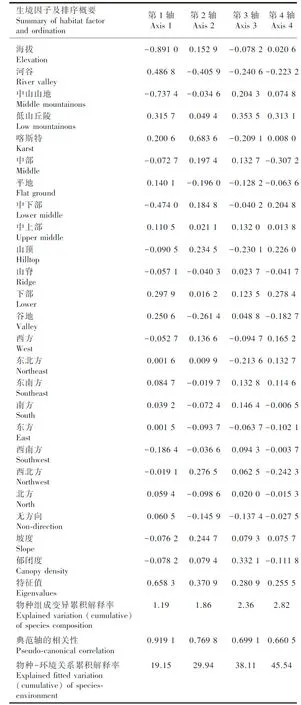
表 4 生境因子与CCA前4排序轴的相关系数及排序概要Table 4 Correlation coefficient between habitat factor and the first four CCA ordination axis and ordination summary
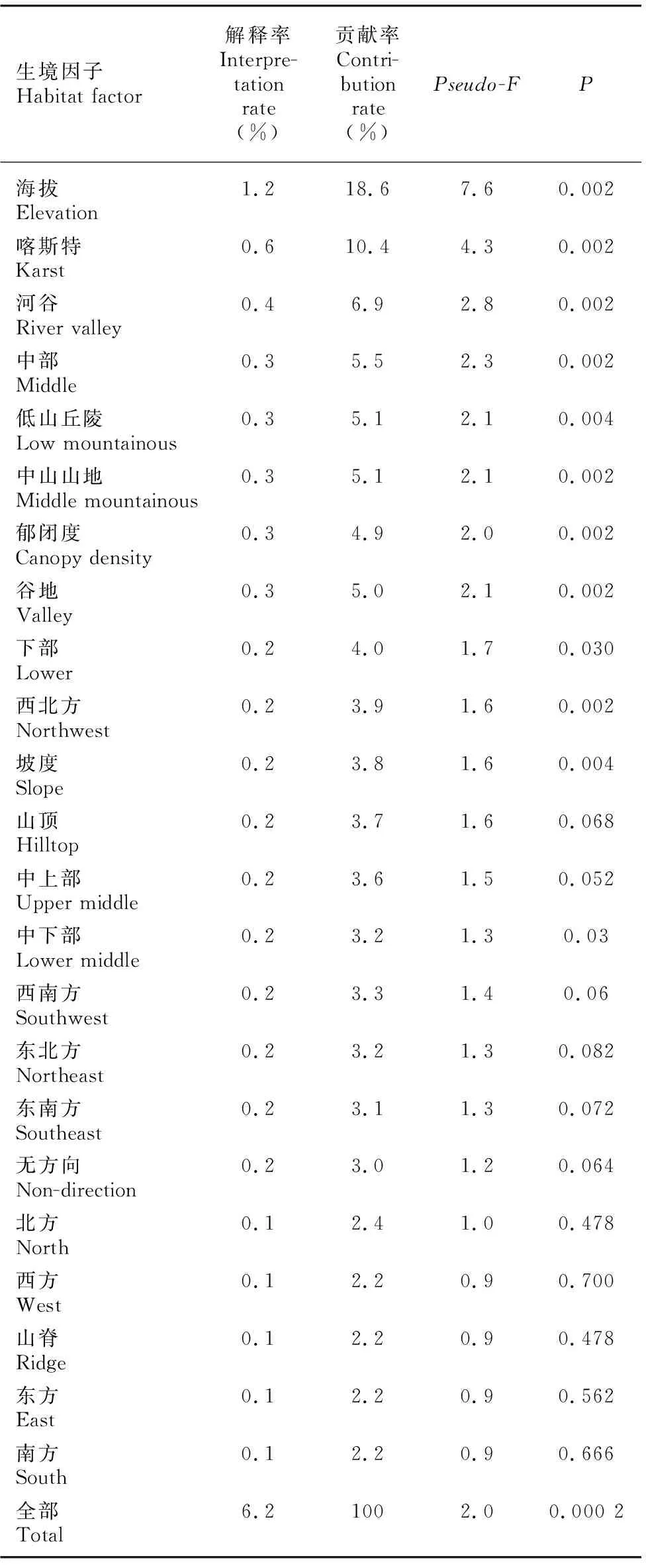
表 5 生境因子对物种组成的解释率Table 5 Interpretation rate of habitat factor on species composition
在进行排序分析的193种兰科植物中,分布较广的种有石仙桃()、密花石斛()、海南石斛、纯色万代兰()、大叶寄树兰()等,发生样方数都超过了100个,分别占到总样方数的8.97%、8.04%、6.36%、6.09%和5.65%。但分布样方数仅为1的稀有种类也达到了31种,包括坛花兰()、莫氏曲唇兰()、三色槌柱兰()、心叶带唇兰()、五指山石豆兰()、中华坛花兰()等。双序图(图3)中展示的受生境因子影响最显著的30种兰科植物可以明显划分为四个小组:第一组包括绒叶斑叶兰、乐东石豆兰()、虎斑卷瓣兰(var.)等,其类群主要分布在海拔较高的中山山地,坡度和郁闭度适中且坡向靠西南方向时有最适值;第二组包括橙黄玉凤花()、火焰兰()、大尖囊蝴蝶兰()、大叶寄树兰等,它们偏向于分布在中低海拔的开阔河谷地区,郁闭度和坡度都相对较小;第三组包括纯色万代兰、钗子股()、多花脆兰、长茎羊耳蒜()和流苏金石斛(),主要分布在海拔不高的低山丘陵地带的较陡的崖壁上,且周围有一定乔灌丛遮挡;第四组则对喀斯特地貌有强烈的偏好性,主要包括云南石仙桃()、红花斑叶兰、泽泻虾脊兰()、卵叶带唇兰()、海南蝴蝶兰()等。其他未展示的大部分种类出现在排序图中心点附近,他们的分布受到生境因子的综合影响相对较小。
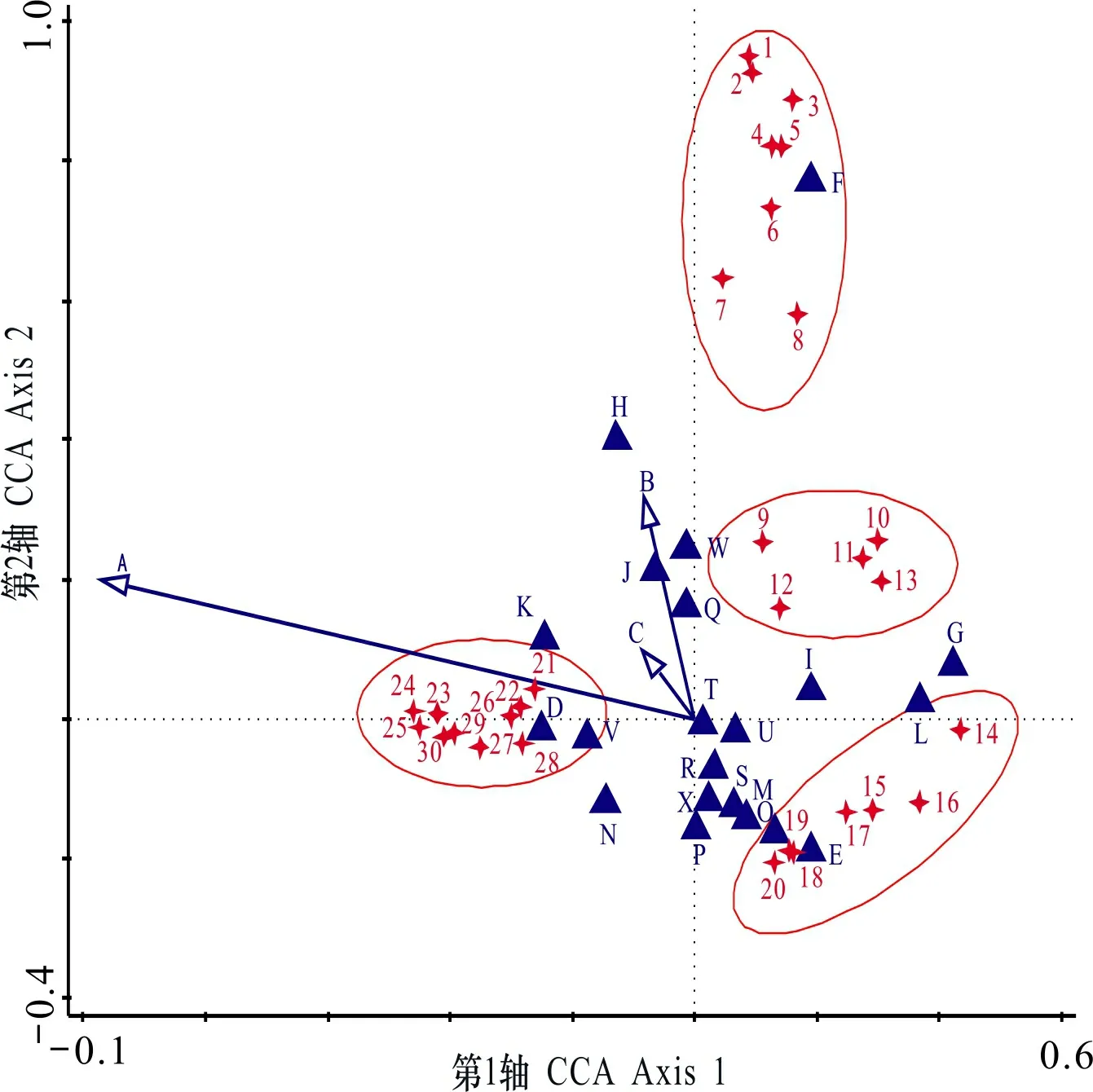
A. 海拔; B. 坡度; C. 郁闭度; D. 中山山地; E. 河谷; F. 喀斯特; G. 低山丘陵; H. 山顶; I. 中上部; J. 中部; K. 中下部; L. 下部; M. 平地; N. 山脊; O. 谷地; P. 东方; Q. 西方; R. 南方; S. 北方; T. 东北方; U. 东南方; V. 西南方; W. 西北方; X. 无方向。1. 泽泻虾脊兰; 2. 红花斑叶兰; 3. 毛葶玉凤花; 4. 海南蝴蝶兰; 5. 卵叶带唇兰; 6. 叠鞘石斛; 7. 云南石仙桃; 8. 无茎盆距兰; 9. 纯色万代兰; 10. 多花脆兰; 11. 长茎羊耳蒜; 12. 流苏金石斛; 13. 钗子股; 14. 火焰兰; 15. 大叶寄树兰; 16. 大尖囊蝴蝶兰; 17. 橙黄玉凤花; 18. 戟唇石豆兰; 19. 剑叶石斛; 20. 匙萼卷瓣兰; 21. 流苏贝母兰; 22. 美花隔距兰; 23. 华石斛; 24. 绒叶斑叶兰; 25. 厚唇兰; 26. 钟兰; 27. 粗茎苹兰; 28. 虎斑卷瓣兰; 29. 黄兰; 30. 乐东石豆兰。代表物种,箭头和▲代表生境因子。A. Elevation; B. Slope; C. Canopy density; D. Middle mountain; E. River valley; F. Karst; G. Low mountain and hill; H. Hilltop; I. Upper middle; J. Middle; K. Lower middle; M. Flat ground; N. Ridge; O. Valley; P. East; Q. West; R. South; S. North; T. Northeast; U. Southeast; V. Southwest; W. Northwest; X. Non-direction. 1. Calanthe alismaefolia; 2. Goodyera grandis; 3. Habenaria ciliolaris; 4. Phalaenopsis hainanensis; 5. Tainia ovifolia; 6. Dendrobium denneanum; 7. Pholidota yunnanensis; 8. Gastrochilus obliquus; 9. Vanda subconcolor; 10. Acampe rigida; 11. Liparis viridiflora; 12. Dendrobium plicatile; 13. Luisia morsei; 14. Renanthera coccinea; 15. Robiquetia spatulata; 16. Phalaenopsis deliciosa; 17. Habenaria rhodocheila; 18. Bulbophyllum Depressum; 19. Dendrobium spatella; 20. Bulbophyllum spathulatum; 21. Coelogyne fimbriata; 22. Cleisostoma birmanicum; 23. Dendrobium sinense; 24. Goodyera velutina; 25. Dendrobium mariae; 26. Campanulorchis thao; 27. Pinalia amica; 28. Bulbophyllum retusiusculum var. tigridum; 29. Cephalantheropsis gracilis; 30. Bulbophyllum ledungense. represents species, arror and ▲ represent habitat factors. 图 3 兰科植物组成与生境因子的CCA双序图Fig. 3 CCA bi-plot of orchid composition and habitat factor
2.5 兰科植物丰富度与生境因子的关系
针对1 840个样方中的193种兰科植物,首先分析了生境因子与兰科植物丰富度的简单数量关系(图4)。较高海拔的3种(热带山地常绿林、山地雨林、山顶矮林)植被类型中兰科植物丰富度差异不明显, 但位于热带山地常绿林中的样方的兰科植物的丰富度显著高于较低海拔的热带低地雨林、枫香林、热带季雨林。喀斯特溶岩地区兰科植物的丰富度最高且样方之间差异较小,河谷地区兰科植物的丰富度也很高,低山丘陵和中山山地之间无显著差异,且丰富度水平均显著低于前两者。9种坡向类型下的丰富度分布结果显示位于东南坡、东坡和南坡几类阳坡条件下的样方中兰科植物丰富度凸显出一定优势,而无坡向的样方兰科植物丰富度显著低于其他坡向。不同干扰程度下样方的兰科植物丰富度差异不明显,合理的解释是一定程度的外界干扰并不能短时间内完全毁灭某些兰科植物,而且适度的干扰可能有利于部分兰花的生长。值得注意的是,以上统计结果均显示丰富度数据存在较多离群值,降低了简单方差分析结果的准确性。针对连续变量散点图的线性拟合情况也不乐观(值都很小),说明这3种生境因子与兰科植物丰富度之间同样不能完全用简单的一元线性关系来解释。另外,简单方差分析只能进行各生境因子影响下样方兰科植物丰富度的差异比较,而无法判断生境因子对样方兰科植物丰富度变异的影响程度和趋势。
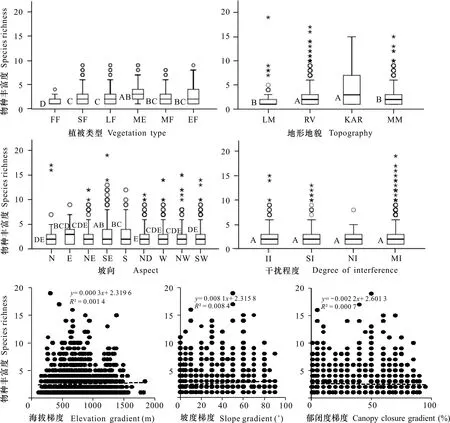
FF. 枫香林; SF. 热带季雨林; LF. 热带低地雨林; ME. 山地常绿林; MF. 热带山地雨林; EF. 山顶矮林; LM. 低山丘陵; RV. 河谷; KAR. 喀斯特; MM. 中山山地; ND. 无方向; II. 强度干扰; SI. 轻微干扰; NI. 无干扰; MI. 中度干扰。箱线图表示中位数和第25/75百分位数,ο和★表示离群值。图中的大写字母相同与否表示二者是否有显著性差异。FF. Liquidambar formosana forest; SF. Tropical monsoon forest; LF. Tropical lowland rain forest; ME. Tropical mountain evergreen forest; MF. Tropical montane rain forest; EF. Tropical elfin forest; LM. Low mountain; RV. River valley; KAR. Karst; MM. Middle mountain; ND. Non-direction; II. Intensity interference; SI. Slightly interference; NI. No interference; MI. Moderate interference. Boxes represents the median and the 25th/75th percentile, ο and ★ indicate outliers. Whether the capital letters in the figure are the same or not indicates whether there is significant difference between the two.图 4 生境因子与兰科植物丰富度的关系Fig. 4 Relationship between different habitat factors and the richness of orchid
因此,采用基于GLM框架下的负二项回归来分别拟合生境因子对兰科植物丰富度的独立效应。从表6可以看出,植被类型、地形地貌、坡向以及坡度4个因子的独立效应都是极显著的(Wald=5.896,=3e-04; Wald=9.407,=1e-04; Wald=5.811,=3e-04; Wald=4.372,=1e-04),这表明在忽略其他任何协变量的影响下,兰科植物丰富度都与它们相关。除低山丘陵外的其他3种地形地貌因子对兰科植物丰富度存在明显的正效应,以喀斯特地貌最为显著,回归系数达到了0.85。东南方坡向带了的充足光照适合更多种兰科植物定殖于此,这与简单方差分析结果类似。陡坡同样能够促进样方中兰科植物丰富度的增加。4种有显著效应的植被类型中,只有山地常绿林拥有正回归系数(regression coefficient,RC,RC=0.17),枫香林、热带季雨林、热带山地雨林都存在一定的负效应,猜测与后三者人为破坏程度更大有关。值得注意的是,海拔变化在独立模型中对兰科植物丰富度的影响不显著,暗示了海拔梯度的显著效应可能要依赖其他因子的共同参与。仍然使用负二项回归来拟合生境因子的多元线性回归模型,以探究多因素共同作用的结果。由表7可以看出,与一元回归模型不同,海拔因子的影响效应达到了显著水平(Wald=2.160,=0.0404, RC=3.319 1e-04),说明在野外实际条件下,海拔梯度的变化会对兰科植物的丰富度变异产生显著影响,这与前文猜测吻合,也符合实际观测情况。郁闭度和外界干扰程度无论是在独立模型还是在全模型中,都未表现出对丰富度变化的显著影响,这可能是因为调查的193种兰科植物生活型全面、生态习性千差万别,对光条件的要求并非梯度变化而是更复杂的相互选择过程,另外,适当的外界干扰例如人为非过度采挖活动对兰科植物丰富度的影响并不大。
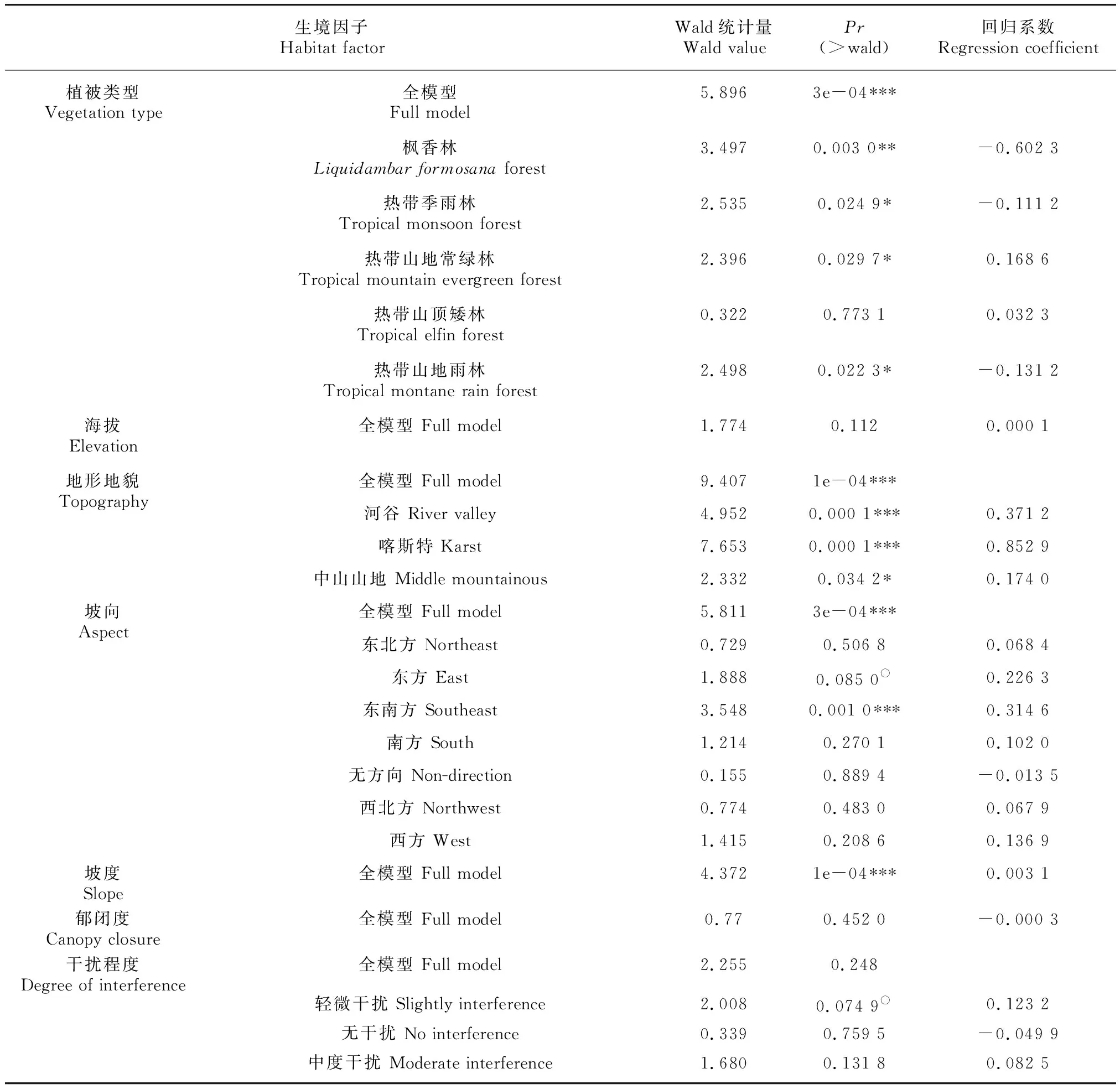
表 6 兰科植物丰富度一元回归模型中生境因子的显著性Table 6 Significance of habitat factor in the univariate GLM of richness of orchid
2.6 兰科植物多度与生境因子的关系
对于兰科植物而言,当居群以某些克隆繁殖习性强的附生兰为主时,多度数据具有比丰富度更明显的离散特征,它们完全偏离正态性,常规的统计方法如检验、一般线性模型等都难以适用。因此,本研究直接采用广义线性模型框架下的负二项回归进行二者的关系拟合。表8中针对单一变量的拟合结果显示,除了郁闭度(Wald=3.102,=0.065 4)和干扰程度(Wald=3.936,=0.123)的效应不显著以外,其他生境因子的全模型均达到了极显著水平。其中,植被类型的变化能够极显著得影响兰科植物多度大小,山地常绿林和山顶矮林的回归系数分别为0.68和0.75,随着这两种植被类型中样方数增多,会促进兰科植物多度的上升,与之相反的是枫香林(Wald=8.191,=0.000 1, RC=-2.238 6),在五指山和鹦哥岭的中高海拔河谷或者山地,会有成片的枫香林存在,其内分布较多的兰科植物包括纯色万代兰、大序隔距兰()等万代兰族附生兰,底层则以带唇兰属部分种为主,这里林分组成单一,而且受到放牧、采挖等人为活动的严重干扰,兰科植物多度普遍较低。除低山丘陵外的3种地形地貌因子都对多度变化存在极显著的正效应,喀斯特地貌极其多样化的小生境类型,中低海拔河谷充足的水热资源,高海拔山地通风良好且空气湿润,都存在适合部分兰科植物的大量繁殖扩散的条件。坡向因子的高影响力(Wald=5.343,=0.000 4, RC=-0.850 4)则是由无坡向的平缓区域带来的,由此可见低海拔丘陵台地或者山脉间的过渡缓坡带兰科植物多度都很低, 相对单一的垂直林冠结构不利于兰花种子的扩散繁殖。另外,两个连续变量(海拔和坡度)具有显著的独立效应,即海拔差异能够带来明显的适宜生境变异,陡坡则能增加兰科植物的生存空间和受光照质量,从而促进兰科植物的大量繁殖。
对于生境因子的多元线性回归拟合结果显示(表9)。首先,全模型为极显著(Wald=22.88,=0.001 1),这说明所选生境因子的综合作用能够显著影响兰科植物的多度,而且对多度变异的解释量要高于对丰富度变异的解释量。但与单因素模型拟合结果不同的是,热带季雨林、 山顶矮林、中山山地以及坡向因子的效应不再显著,而坡度和海拔仍然是不可或缺的多度主导因素。以上结果说明在野外实际生境条件下,多因素之间综合作用共同影响兰科植物的多度,部分因子的影响被其他决定性更强的因子包含在内,不再具有显著性,而且海拔、坡度的显著正效应(RC=0.000 9; 0.008 7)和枫香林的显著负效应(RC=-2.554 2)受其他生境因子影响较小。
3 讨论与结论
3.1 兰科植物物种多样性
本研究通过半年不间断的实地资源调查,初步对海南岛主要陆域自然保护地内的野生兰科植物资源状况进行了一次摸底。发现了镰叶盆距兰()、保亭羊耳蒜()、黎氏兰()等海南特有和中国仅海南有分布的兰科植物共19种,占到目前有记载的海南特有类群的将近一半(翟俊文等,2016),其中还不乏独占春()、美花兰()、珍珠矮()、兰屿芋兰()、卵叶带唇兰等珍稀濒危种。种属分布以中小型属为主,但种类数量却集中分布在几个大属中,石豆兰属共发现19种,石斛属和兰属都为16种,与全海南岛的情况差距不大(余文刚,2014)。这一方面说明上述几个属的兰科植物分布范围较广,另一方面也反映了研究区域为海南岛兰科植物分布的绝对中心,需要重点关注和保护。
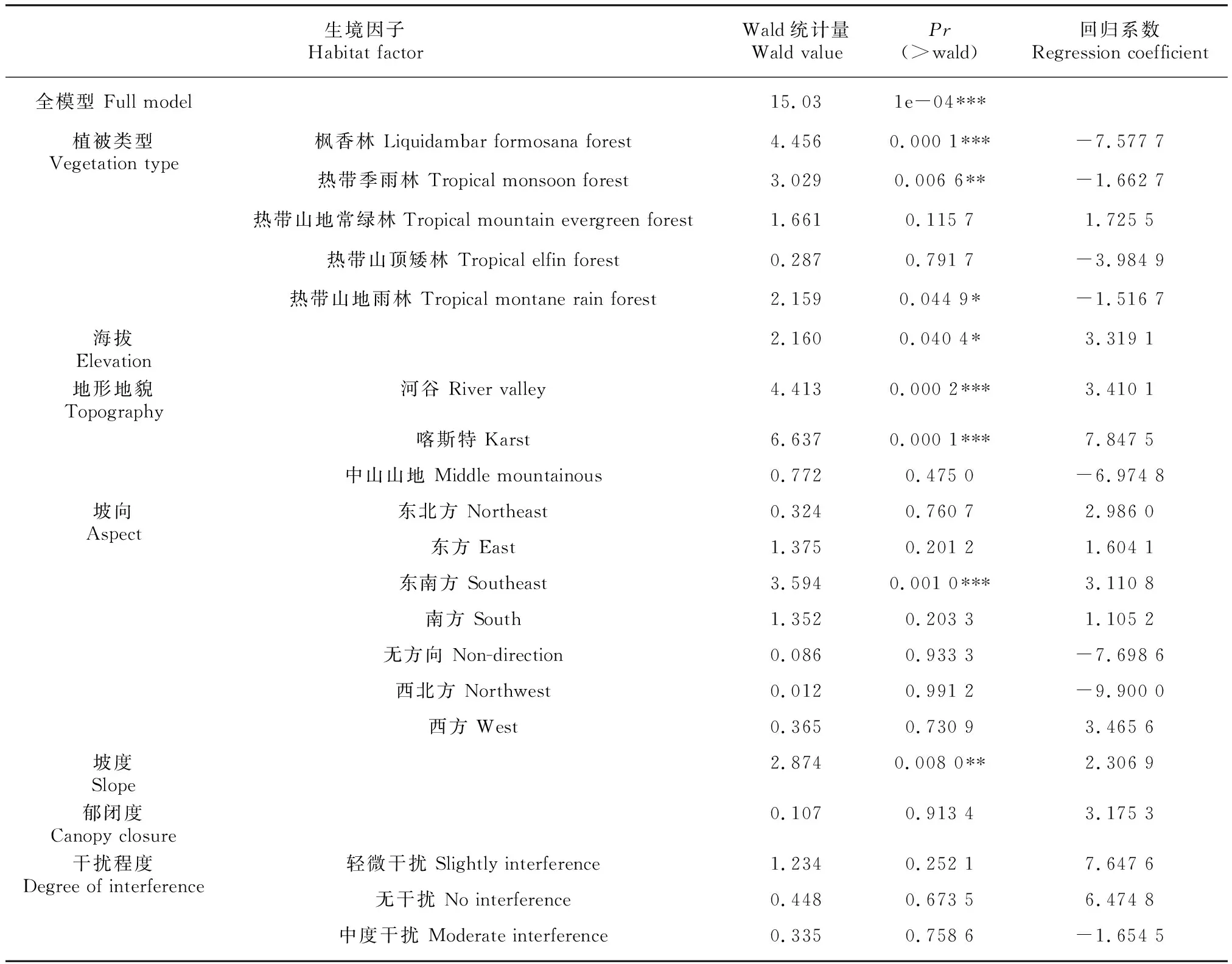
表 7 兰科植物丰富度多元回归模型中生境因子的显著性Table 7 Significance of habitat factor in the multiple GLM of richness of orchid
与海南岛以往调查历史资料相比,此次调查结果是除鹦哥岭和尖峰岭以外其他保护地关于兰科植物资源数量与分布等信息最新最全的记载(施国政,2008;卢刚等,2018)。另外,与我国东南部热带亚热带地区的部分自然保护地记载的兰科植物资料对比发现(程志全,2015),研究区域的兰科植物丰富度显著高于除玉山外的其他保护地,虽然一定程度得益于整个区域的面积较大,但即使是单一保护地的兰科植物丰富度同样名列前茅。综上所述,研究区域不仅是海南岛兰科植物分布的绝对中心,同样是我国热带亚热带兰科植物最为丰富的地区之一。
3.2 海拔对于兰科植物多样性的影响
物种多样性与海拔之间的关系一直是生物多样性研究的热点问题,因为在如此小的距离变异下却有较大的气候变化出现(Acharya et al., 2011)。已有许多研究表明海拔梯度是包含光照、温度、湿度等多种环境因子的综合气候轴(李晓芳,2017),另有学者指出海拔在一定范围内还反映了植物受到外界人为干扰的种类和强度大小(Kevin, 2000)。研究区域的兰科植物丰富度在海拔梯度上的变化呈现的“驼峰”形式已经被广泛证实是一种基本分布格局(Lorenzo et al., 2007; Sherman et al., 2008; Zhang et al., 2015),中海拔地区拥有较为适宜的温度、降水、光照,适合大多数兰科植物的生长(Tang & Ohsawa, 1997),因此种类最丰富(常学向等,2004)。我们还发现,不同生活类型的兰科植物均具有该种分布形式,只是强弱程度存在一定差异,这可能是因为中海拔段林分层次最为丰富,从而具备了适宜各种生活型兰科植物生长的水分、光照、土壤以及植被条件,但各种生活型兰科植物对于小生境要求不尽相同,加之基础种群数量的差异导致变化强弱有所不同(田怀珍和邢福武,2008)。值得注意的是,基于GLM回归分析的结果显示海拔对于兰科植物丰富度的影响并非独立存在,而是在其他地形地貌因子存在的情况下才有显著影响,这进一步说明了海拔对于兰科植物丰富度的影响是一个复杂的综合作用过程,目前对于物种丰富度沿海拔梯度变化的单峰模型的解释假说除了气候 (水分和能量) 外, 还主要包括面积、 几何限制 (Geometric constraints)等(Tang & Ohsawa, 1997;李巧燕和王襄平,2013),由此推断地形地貌因子可能和面积存在一定的相关关系。除丰富度之外,兰科植物组成也存在明显海拔变异,CCA排序结果显示不同海拔段的样方内兰科植物组成存在明显不同,海拔较低时,温度较高,但降雨和通风不足,是部分万代兰族兰花适应的闷热环境,高海拔地区温度较低、湿度大、光照充足且十分通风,沼兰族和粉药兰族的部分种类钟爱此环境,而中海拔段植被类型最为复杂多样,以山地雨林为主,还包括部分热带针叶林等,典型的生境特征是温度和湿度都很高,光照和通风条件都适中,适合最多种类兰科植物的生长。GLM回归分析显示兰科植物多度也受到海拔因子的显著影响,且该种影响在一定程度上不受其他生境因子的限制,表明兰科植物多度和海拔之间的关系可能相对简单一些,但兰科植物多度受到计数方法、主观臆测、计数精度等多种因素的影响,且数据过于离散不服从正态性(Benesh & Kalbe, 2016),因此可能需要更广的取样范围和更统一的计数方法运用其中才能得出更准确的结果。
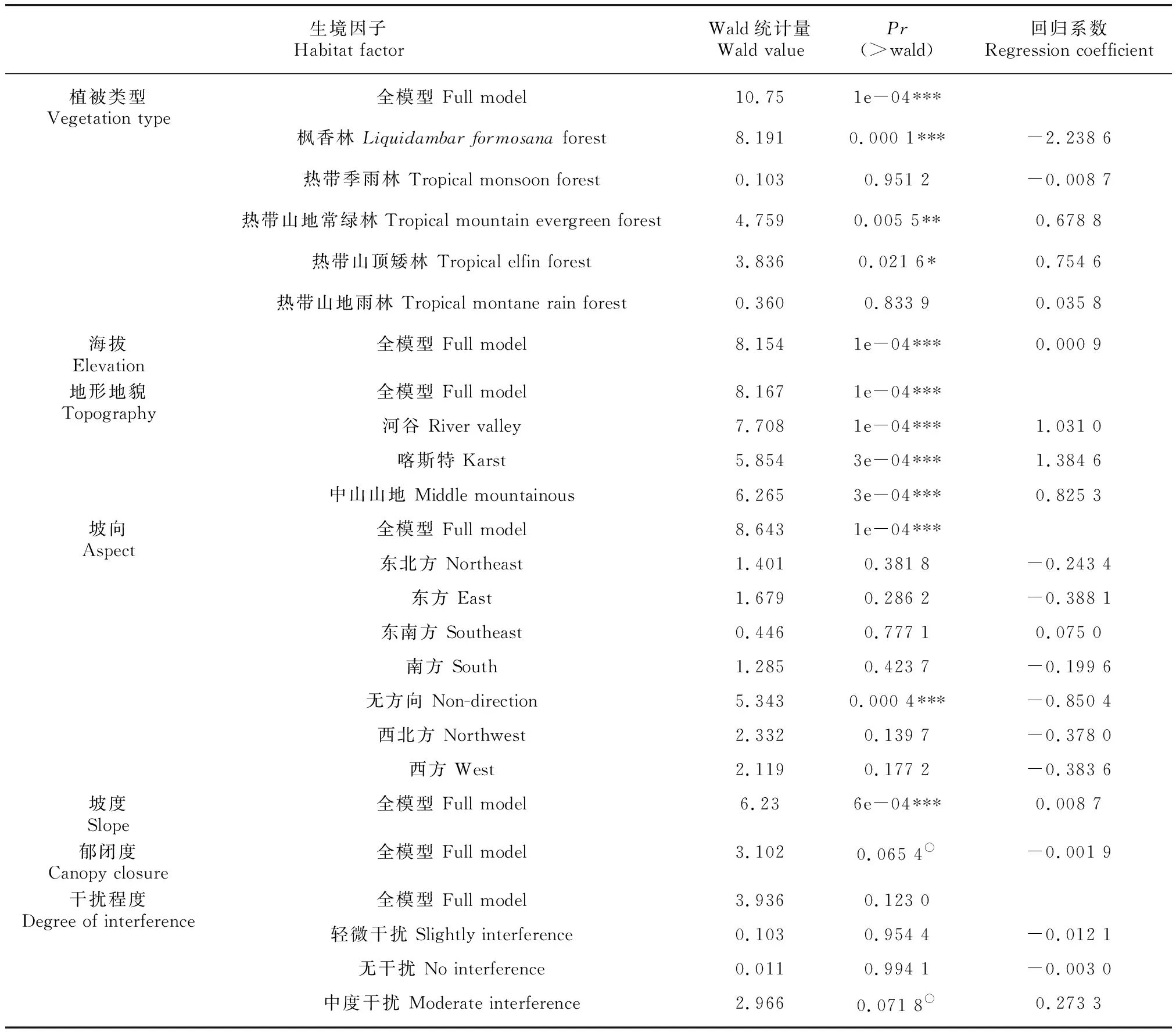
表 8 兰科植物多度一元回归模型中生境因子的显著性Table 8 Significance of habitat factor in the univariate GLM of abundance of orchid
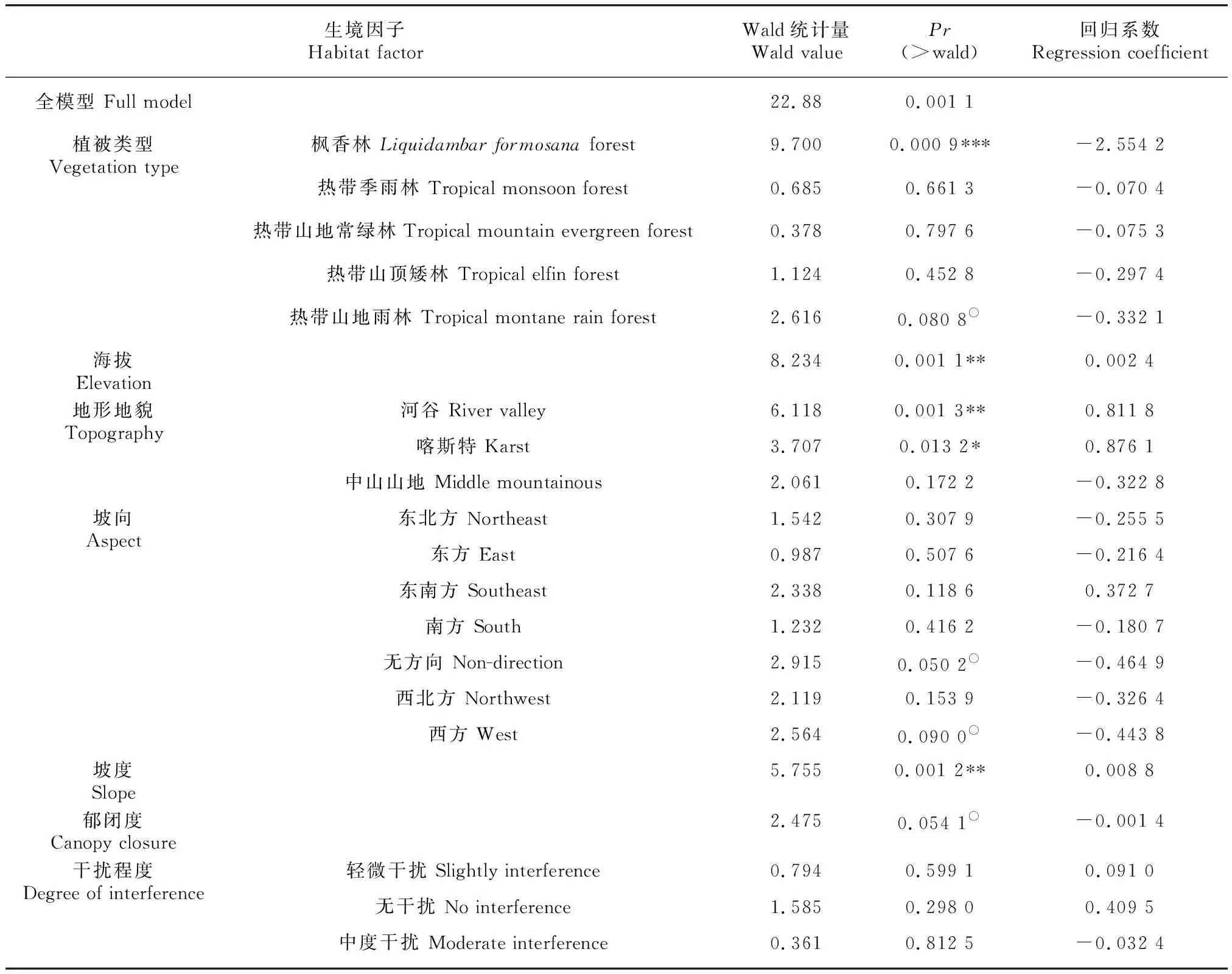
表 9 兰科植物多度多元回归模型中生境因子的显著性Table 9 Significance of habitat factor in the multiple GLM of abundance of orchid
3.3 生活型对兰科植物多样性的影响
生活型的差异使不同兰科植物对生境条件的要求有显著的差异,二者的相互选择共同决定了各生活型兰科植物在地理分布上的偏好性和不均匀性。从前人研究结果可以发现,在垂直方向上4种生活型的兰科植物虽然都在中海拔地区拥有较高的丰富度和多度,但附生/石生类型在各海拔段都为优势类群,它们多属于石斛属、石豆兰属、羊耳蒜属、沼兰属()、隔距兰属以及广义的毛兰属(),一般生长在裸露岩石或其他植物上而不吸收其营养,生活史全部或部分时期生长在空气中不与地面接触(Benzing, 1990),这导致其附载基质的稳定性较低,很容易受到营养和水分供应缺乏的威胁,因此能够适应这一生态位的兰花对附生环境的要求非常高,而一旦适应下来就能成为明显的优势种(刘强等,2010)。本次调查中,中低海拔地区的河谷和喀斯特地貌光照充足,水气资源丰富,既能为兰花提供充足的水分,又避免了大量水分累积导致的涝害,这里的裸露岩石或者树干中上部以及树冠层生长着大量的‘附生/石生’型兰花,例如纯色万代兰、多花脆兰、大叶寄树兰、火焰兰、大尖囊蝴蝶兰、直唇卷瓣兰()等,而在远离河谷的低山丘陵,兰花的多样性相对较低,只有钗子股、金塔隔距兰()等种分布较广;中高海拔地区温度低,但空气更加湿润,各种石斛和石豆兰集中高密度分布,通过假鳞茎进行的克隆繁殖成为主要的繁殖方式,假鳞茎是附生兰科植物的特化专一的营养贮藏器官,在附生兰科植物的生长和更新中具有重要作用(Khee et al., 2000);山地常绿林和山顶矮林地区温度较低,长期受到台风的侵扰,钟兰()、流苏贝母兰()、华石斛、芳香石豆兰、丛生羊耳蒜()等种类因为株体小且拥有假鳞茎,抗性较强,通常成片密集分布,成为这一区域的优势类群。以粉药兰族、红门兰族、兰属为主的地生型兰科植物呈现出完全不同的分布格局,这类兰花无明显分布偏好性。针对某一特定种属例如兰属,寒兰()、墨兰()、建兰()主要分布在中高海拔松针较多的薄腐殖土层中,美花兰、莎叶兰()等则喜欢生长在更加凉爽且湿度充足的高海拔山脊或者山顶薄土层中。粉药兰族的斑叶兰属和翻唇兰属()兰科植物为较为广布的种类,对海拔和地形地貌没有专性要求,而金线兰属()基本分布在中高海拔阴湿凉爽的林下腐殖土或岩石上,血叶兰()则集中分布在中低海拔闷热的河谷边岩石苔藓层上。
3.4 其他生境因子对兰科植物多样性的影响
植被类型与海拔的关系尤为密切,不同植被类型分布在不同的海拔段内,一定程度上可以说是海拔变化塑造了植被类型的多样化(刘广福等,2010)。但植被类型带来的差异不仅限于由海拔因素驱动的温度、水分等,还意味着由植物物种组成成分、林冠层结构引起的光照、生存竞争强度的变化(李德志和臧润国,2004)。因此在本研究中,植被类型在兰科植物的丰富度和多度中都存在由枫香林引起的显著负效应,而且是不依赖海拔独立存在的。总而言之,植被类型对于兰科植物多样性的影响不能简单归结于海拔变化,更加复杂的综合作用过程值得深入探究。喀斯特地貌作为研究区域十分重要的地形地貌组成部分,具有极其复杂多样的小生境类型(钟云芳等,2014),这使之成为兰花生长的天堂,兰科植物的种类、密度、多度都令人叹为观止,调查中喀斯特溶岩地区一个样方最多能达到17种兰科植物,CCA排序和GLM回归分析的结果都显示了其在兰科植物组成、丰富度、多度中的显著影响。河谷对于兰科植物丰富度和多度的影响程度都超过了喀斯特地貌,究其原因,河谷两侧拥有充足的光照,河流水分的蒸发为附生兰科植物提供了恰当的水分供应,而不间断的微风和水流增加了种子传播距离,另外,河谷还能一定程度上抵挡台风的侵扰,成为大批附生型兰科植物的“避难所”。坡位主要用于描述成坡的相对位置,各种坡位的土壤水肥条件有很大差别(田迅等,2015),这可能是影响植物多样性的重要因素,但在多数研究中,坡位因素一直由于获取较为困难且误差较大的原因,被作为次要因子考虑。本研究对于生境因子的CCA排序结果显示,除山脊之外的其他坡位类型对兰科植物组成变异的解释率和贡献率都达到了显著水平以上,有力地说明了不同的成坡位置所形成的独特的水肥小生境条件对兰科植物组成变化较强的驱动性。坡向和坡度通过影响生境的温度和湿度进而影响物种组成,一般情况下阳坡比阴坡光照条件更好,但土壤含水量和湿度相对较低(Leps & Smilauer, 2003)。该研究针对兰科植物丰富度和多度的GLM回归分析中指出了坡向的显著效应,其中东南方坡向对兰科植物丰富度的正向影响是很稳定的,即在一元模型和多元模型中,具有东南坡向样方的增加都有利于形成更高的兰科植物丰富度。东南方坡向属于半阳坡,光照条件适中,且时常受到东南方暖湿气流的光顾,为兰科植物提供了极佳的条件,相较于其他坡向适合更多兰科植物的定殖。但在多度分析的多元模型中,坡向因子受其他协变量影响较大,并未体现出显著效应,猜测可能是受到海拔等因子的影响,海拔过高存在台风侵扰,海拔太低暖湿气流被阻隔,因此对多度的影响力有所下降。陡坡的土壤或砂石水分含量较少但排水良好,适合大多数地生或石生兰科植物生长,而对于附生型兰科植物来说,坡度越大意味着能获得更多光照(李成俊等,2013),在我们的研究中,坡度对兰科植物丰富度和多度的影响都是显著的,在物种组成变化中也有显著的解释率,由此可见坡度的增加不但具有因促进了独特小生境形成而带来的物种选择作用,而且有利于兰科植物的大量繁殖。光照条件是海拔、地形地貌、土壤养分等立地条件中影响林下植物组成的主要因素之一(Huang et al., 2008; Tinya et al., 2009),郁闭度则是影响光照强度和持续时间最直接的因素,郁闭度对林下植物多样性的显著影响已经被广泛证实(曹梦等,2018;王媚臻等,2019)。本研究中郁闭度确实对兰科植物的组成具有一定影响,但对于丰富度和多度的效应均不显著,可能是因为不同郁闭度大小作某一小生境中兰科植物定殖重要的环境选择依据,但达不到精细的兰花种类和数量选择水平。
3.5 基于关键生境因子的兰科植物资源保育策略
本研究中用于解释物种多样性的生境因子之间可能存在复杂的相互作用,这使得他们对于兰科植物多样性的解释存在一定的重叠效应(Tsiftsis,2020),但这并不能否定文中指出的相关生境因子的重要性。通过此次调查和分析,我们发现8种生境因子对兰科植物多样性都有不同侧重点的显著影响,其中以植被类型、海拔和地形地貌因子的效应最为显著。根据兰科植物多样性与生境因子的相互适应结果,提出一下资源保育策略:(1)研究区域拥有海南岛几乎全部的植被类型,丰富的植被类型为不同的兰科植物营造了与之相适应的生存环境,中高海拔段的山地雨林拥有极其丰富的兰科植物资源,而高海拔段的山地常绿林和山顶矮林中则存在例如美花兰、卷萼兜兰()、五指山石豆兰等珍稀濒危类群。因此,在今后的保育工作中应重点关注中高海拔地区的生境保护。(2)喀斯特溶岩山地同样存在着丰富的兰科植物资源,本研究指出该地貌是驱动兰科植物生长和分化的关键生境因子,但由于这一地区长期处于保护区的一般控制区,生境破坏严重,历史因素如上世纪的金矿开采活动,人居活动干扰如经济林栽植、挖掘野生花梨的炸山挖石,以及附近水泥厂的采矿活动等,导致部分石灰岩山地轻则寸草不生,重则直接被夷为平地,这不仅使兰科植物资源多样性遭受到巨大破坏,更是对石灰岩专性植物的毁灭性打击。应该加强对当地村民的正确管理、引导及宣传,并且通过各类扶贫战略的实施使当地村民摆脱靠山吃山的窘境,这对于兰科植物重要自然栖息地的恢复和就地保护十分必要。(3)兰科植物保护不是盲目的一刀切,应该理清轻重缓急,而且保护工作最好是在防止人为破坏的基本要求下通过改善生境条件来进行,因为与生境的长期相互适应使得兰科植物对其原生境有高度的依赖性,这种关系一旦被打破,就难以恢复到其最初的良好生长状况。

