PI-RADS v2.1在前列腺临床显著癌诊断中的作用
崔 冰, 吴海燕, 陈 妍, 刘有为, 许丽丽, 许再超
(河北省承德市中心医院, 河北 承德 067000)
多参数MRI(multiparametric MRI,mpMRI)对前列腺临床显著癌的诊断及危险度分级有重要作用[1,2]。国外指南认为mpMRI应成为怀疑前列腺癌病人的一线检查方式[3,4]。2019年PI-RADS指导委员会对第2版影像报告与数据系统(prostate imaging-reporting and data system,PI-RADS v2)进行更新并发布PI-RADS v2.1[5]。PI-RADS v2已被证实在前列腺临床显著癌诊断中的重要价值[6],而新版PI-RADS v2.1诊断标准的变化对前列腺评分的影响需要进一步研究。因此本研究的主要目的就是探讨基于PI-RADS v2.1的前列腺mpMRI在诊断临床显著癌中的价值。
1 资料与方法
1.1研究对象:回顾性收集2018年1月至10月于本院行前列腺mpMRI患者176例,所有患者均为PSA升高而临床怀疑前列腺癌且未行前列腺穿刺。排除标准:mpMRI资料及基本临床信息不完整;首次mpMRI 检查前接受过任何相关治疗;手术前行相关治疗(内分泌治疗3例,放射治疗1例);未在本院取得最终根治病理结果(排除29例)。前列腺根治术前行内分泌治疗3例,选择放射治疗1例,未在本院行前列腺根治术29例。最终入组病例资料143例,年龄64.0±7.5岁(范围40~78岁)。前列腺特异性抗原(prostate specific antigen,PSA)8.0±3.5 ng/mL(正常范围4.2~22.6ng/mL)。
1.2仪器与方法:采用3.0T MRI扫描仪(GE 3.0T Discovery HD 750 MR)。基本扫描序列包括T1WI、T2WI、扩散加权成像(DWI,b=1400 s/mm2)和动态对比增强(dynamic contrast enhancement,DCE)。轴位T2WI扫描参数:TR 3000ms,TE 85ms,矩阵320×256,层厚3mm,间距0mm。轴位DWI采用EPI序列,TR 2700ms,TE 65ms,矩阵96×96,平均采集次数16,层厚4mm,间距0mm。同时重建相应ADC图。DCE采用GRE序列,团注0.1mmoL/kg钆喷酸葡胺(Gd-DTPA)同时开始扫描3min以上,时间分辨率13s。
1.3MRI图像分析:所有MRI图像由一名经验丰富的腹部影像学专家(工作经验20年)按照PI-RADS v2.1标准进行评分,分析并记录每个病人的责任病灶(index lesion)。读片者采用独立盲法阅片,读片前不被提供任何相关临床信息。
1.4病理金标准:所有患者均接受超声引导下前列腺穿刺,穿刺方式根据原始MRI报告结果,如果原始报告有阳性表现则进行认知融合穿刺,否则进行12针或13针系统性穿刺。如果穿刺发现癌,则接受前列腺根治术。所有病理结果均由一名病理科医师进行评价。临床显著癌的定义为Gleason评分≥7,和/或肿瘤体积≥0.5cm3和/或前列腺外侵犯。
1.5统计学方法:使用SPSS19.0软件进行诊断效能分析。以患者为研究单位,以PI-RADS≥3分为阳性表现,并与最终病理结果进行对照。绘制受试者工作特征曲线(receiver operating characteristic curves,ROC曲线),并计算ROC曲线下面积(areaundercurve,AUC)、准确率、敏感性和特异性。
2 结 果
2.1一般资料:入组病例资料143例,72例(50.3%)根治病理诊断为临床显著癌,2例根治病理为非临床显著癌。由于本研究的主要目的是探讨PI-RADS v2.1对临床显著癌的诊断效能,因此将病理证实为临床显著癌的病例认为是阳性病例,非临床显著癌病例及所有穿刺阴性病例认为是阴性病例。
2.2诊断效能:PI-RADS v2.1评分诊断所有前列腺临床显著癌、移行带和外周带临床显著的AUC、准确率、敏感性、特异性见表1。10例移行带PI-RADS ≥4分病灶(包括PI-RADS 3+1分)全部证实为临床显著癌,60例外周带PI-RADS ≥4分病灶(不包括PI-RADS 3+1分)中59例(98.3%)最终证实为临床显著癌。因此,PI-RADS≥4分(不包括外周带PI-RADS3+1分)为临床显著癌的准确率为98.67(69/70)。MRI识别责任病灶55例(31.5%)位于移行带:27例(49.1%)T2WI评分2分,其中4例(14.8%,4/27)最终评分升级为PI-RADS 2+1分、且穿刺均未发现癌;20例T2WI(36.4%)评分3分,有3例(15%,3/20)升级为PI-RADS 3+1分、且根治病理结果均为临床显著癌。MRI识别责任病灶88例(61.5%)位于外周带:21例(23.9%)DWI评分3分,其中14例(66.7%,14/21)最终评分升级为PI-RADS 3+1分、且11例(78.6%,11/14)穿刺未发现癌。mpMRI未检出的临床显著癌2例,均位于移行带,均穿刺12针,1例穿刺病理结果仅为数个异型腺体,1例穿刺病理结果仅1针癌(癌组织比例1/3),根治病理结果均为Gleason评分3+4,病理分期pT2c。
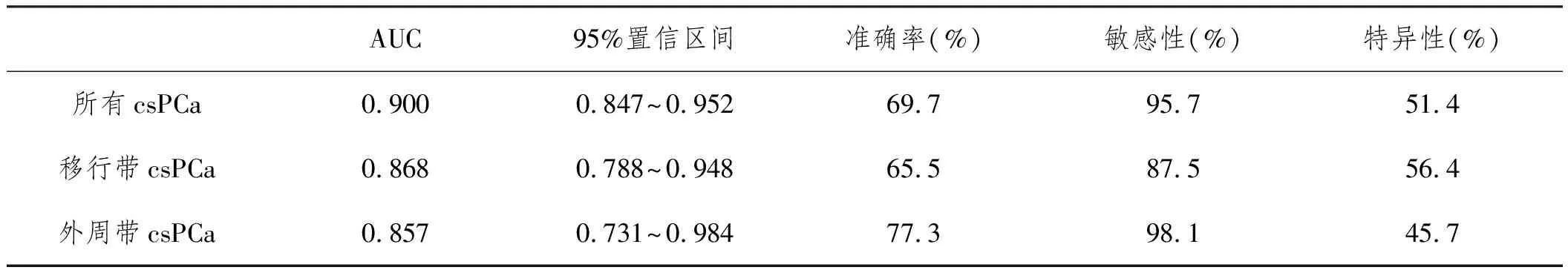
表1 PI-RADS v2.1诊断效能(界定PI-RADS≥3分为阳性)
3 讨 论
血清PSA是目前前列腺癌筛查最常用的手段,但由于其可能导致过度诊断和过度治疗而存在争议,因此在某些国家并不被推荐。一项随访时间中位数10年的随机对照试验发现,仅以PSA筛查并不能改善50-69岁男性前列腺癌死亡率,但是会增加低风险前列腺癌检出率[4]。而很多低分化或致死性的前列腺癌也难以通过PSA筛查发现[5]。因此,MRI作为无创性的影像学检查手段,可以弥补单纯依靠PSA筛查造成的不足,在前列腺穿刺前或穿刺阴性的患者中均有重要的作用。国外指南认为mpMRI是优化前列腺穿刺方案的主要手段[2]。若在穿刺前应用mpMRI检查对可疑前列腺癌的患者进行筛选,则可以减少部分患者穿刺的机会、避免穿刺并发症的发生。而在系统性穿刺的基础上再增加对MRI可见的病变进行穿刺,又可以在增加临床显著癌的检出率的同时降低非临床显著癌的检出率,从而减少过度诊断和过度治疗。
本研究结果发现PI-RADS≥3分对前列腺临床显著癌的检出具有很高的敏感性(敏感性95.7%),提示临床可以进一步穿刺明确;PI-RADS≥4分(不包括外周带PI-RADS 3+1分)的诊断准确率达98.6%,为临床提供了可靠的后续诊疗依据。研究[6]认为,相较于PI-RADS v2,PI-RADS v2.1对临床显著癌的诊断效能更好,尤其是对移行带临床显著癌的检出。
PI-RADS v2.1评分路径的主要变化是增加了针对移行带T2WI 2分病灶的DWI评分,如果T2WI 2分同时DWI≥3分则最终PI-RADS评分升级为3分。Linhares Moreira等[7]研究发现PI-RADS评分变化主要发生在移行带、且以PI-RADS 2分降为1分为主。Byun等[8]研究入组201个移行带病灶,发现PI-RADS≥3分的敏感性和特异性分别为94.5%、60.9%,其中PI-RADS 2+1分的阳性率为50%(4/8)。而本研究中4例(14.5%,4/27)评分升级为PI-RADS 2+1分,且穿刺均未发现癌。造成本研究结果与文献的差异原因可能是本研究中入组病例数较少,也可能是由于PI-RADS 2分升级为PI-RADS 2+1分的概率本身就比较低。
DCE对前列腺癌的检出具有高敏感性的特点,但有时外周带炎症与前列腺癌的强化方式表现类似难以鉴别。许多研究开始关注不含DCE的双参数MRI(bpMRI),并证实bpMRI与mpMRI对前列腺癌的诊断准确率相当[9],而且bpMRI有额外的优势:降低检查价格、减少扫描时间、避免钆对比剂风险。Tamada 等[10]研究结论认为bpMRI诊断准确率要高于mpMRI。他们采用3名读片者对外周带病灶评价时,PI-RADS 3+1分的假阳性率分别为62%、57%、73%。因此认为PI-RADS v2.1对外周带病灶的评价,PI-RADS 4分的准确率要高于PI-RADS 3+1分和4分的准确率。本研究也得出类似的结果:外周带14例PI-RADS 3+1分病灶中78.6%(11/14)为假阳性,在提高敏感性的同时降低了PI-RADS≥4分的诊断准确率。
本研究有一定的局限性。所有病例均是根据原始MRI报告进行的认知融合穿刺,而不是以PI-RADS v2.1为标准,可能会造成部分病例目标穿刺病灶与研究中的责任病灶不一致的情况,此问题需要在将来的前瞻性研究中继续探讨。另外非癌组的金标准仅根据穿刺病理会存在不准确性,但国外研究认为,不论是MRI靶向穿刺或系统性穿刺均不能单独成为检出癌的金标准,而二者联合应用已是最优选择[11],但本研究由于硬件条件限制无法做到MRI靶向穿刺。最后,本研究只有一名经验丰富的影像科医生进行独立盲法阅片,缺乏不同医生之间的读片一致性分析,需要进一步的研究进行探讨。
通过本研究发现,基于PI-RADS v2.1的前列腺mpMRI对临床显著癌的检出有很高敏感性,DCE增加外周带癌检出的敏感性。而PI-RADS≥4分(不包括外周带PI-RADS 3+1分)提示患有临床显著癌的可能性高达98.6%。

