淫羊藿苷联合富血小板血浆对骨性关节炎的软骨保护作用和分子机制研究Δ
刘 杰,史 超,刘 杨,赵 妍
(新疆医科大学第六附属医院康复医学科,乌鲁木齐 830000)
骨性关节炎(osteoarthritis,OA)是全球中老年人群中的常见疾病[1]。目前已有文献报道,注射非甾体抗炎药(NSAID)可缓解OA患者的疼痛症状,但对缓解关节软骨变性的助益甚微[2]。近年来,注射富血小板血浆(PRP)是治疗OA的新方法,能促进软骨细胞增殖、分化和基质合成[3]。而且研究结果发现,PRP联合药物方案治疗OA的改善效果更有效。有研究结果发现,淫羊藿苷(ICA)与PRP联合应用可促进软骨细胞增殖,促进兔肌腱愈合[4-5]。ICA是淫羊藿主要的天然黄酮类成分,有调节骨组织、骨细胞代谢的作用。近年来,关于ICA在骨与软组织中应用的机制研究越来越广泛。ICA通过调控Wnt/β-catenin信号通路改善股骨头坏死,增强骨髓间质干细胞活力,促进成骨分化[6]。且ICA具有抑制软骨细胞凋亡的作用[7]。Deng等[8]的研究结果表明,ICA可以抑制炎症因子白细胞介素1β(IL-1β)介导的纤维软骨细胞凋亡。但是ICA联合PRP对OA的作用和机制目前仍未知。本研究建立了OA细胞模型和动物实验模型,旨在确定ICA联合PRP、单用ICA与单用PRP在体内外治疗OA是否具有相似的生物学作用,并进一步验证ICA联合PRP是否通过Wnt/β-catenin信号通路改善OA。
1 材料与方法
1.1 材料
1.1.1 实验动物:30只雄性新西兰白兔由新疆医科大学实验动物学实验室提供,动物实验由我院伦理委员批准通过(批准号为IACUC20210101-12)。
1.1.2 仪器:TP 1210型脱水机、EG 1250 H型石蜡包埋机、RM 2019型石蜡切片机(德国Leica公司);CX40型正置显微镜[舜宇光学科技(集团)有限公司];Image J 2.0型灰度分析软件(美国国家卫生研究所);170-3930型Western blot电泳仪和转膜仪(美国Bio-Rad公司);KODAK Gel Logic 2200数字凝胶成像分析系统(美国DL Naturegene Life Sciences公司);LSETM通用离心机(美国Corning公司);BPH-9082细胞培养箱(上海恒一精密仪器有限公司)。Multiskan FC型酶标仪(美国Thermo Fisher Scientific公司);Bio-Rad 680型分光光度酶标仪(美国Bio-Rad公司);BD Accuri® C6 Plus型流式细胞仪(美国BD公司);FV3000激光共聚焦显微镜(日本Olympus公司)。
1.1.3 药品与试剂:胰蛋白酶、胎牛血清、1%青霉素/链霉素、低血清培养液和DMEM/F12培养基购于美国Gibco公司(货号分别为15090046、10100147、15140122、31985062和A4192001)。anti-Col-Ⅱ、anti-ADAMTS-5购于英国Abcam公司(货号分别为ab185430、ab182795)。山羊抗小鼠免疫球蛋白(Ig)G(H+L)第二抗体AlexaFluor488、山羊抗兔IgG(H+L)第二抗体购于美国Invitrogen公司(货号分别为A16098、PA1-28555)。DAPI染液和细胞计数试剂盒-8(CCK-8)购于上海Beyotime公司(货号分别为C1002、C0038)。Transwell细胞培养室购于美国Corning公司(货号为CLS3396)。IL-1β、ICA(分子式为C33H40O15)购于美国Sigma公司(货号分别为IL038、I1286)。BCA蛋白测定试剂盒、RIPA裂解缓冲液购于美国Pierce公司(货号分别为23225、89900)。牛血清白蛋白购于生工生物工程(上海)股份有限公司(货号为AD0069)。anti-Wnt1、GSK-3β、β-catenin、磷酸甘油醛脱氢酶(GAPDH)及辣根过氧化物酶(HRP)偶联的第二抗体购于美国Cell Signaling Technology公司(货号分别为XY-1739R、9832、37447、51332和7076)。ECL成像试剂盒购于美国Thermo Fisher Scientific公司(货号为A38556)。
1.2 方法
1.2.1 兔PRP的制备:新西兰大白兔全血经耳廓中央动脉穿刺取血,以9∶ 1(V血液/V柠檬酸葡萄糖溶液A抗凝剂)的比例加入柠檬酸葡萄糖溶液A抗凝剂中。将样品轻轻搅拌至混合。将10 mL的混合物在15 mL离心管中以1 500 r/min (离心半径为10 cm)离心10 min。然后,血液从上到下被分成血浆、血小板、白细胞(“缓冲层”)和红细胞。顶部两层包含血小板,被转移到新的离心管二次离心,3 000 r/min (离心半径为10 cm)离心10 min。弃掉上层血清和下层的红细胞沉淀,,中间层即为血小板,重悬获得PRP 1 mL[9]。
1.2.2 软骨细胞的分离和培养:软骨来自新西兰大白兔终端胫骨和股骨,无菌条件下切成碎块,用PBS洗3次,添加0.25%胰蛋白酶消化1~2 h,然后用0.2%Ⅱ型胶原(COL-Ⅱ)酶消化,37 ℃孵化器,5%二氧化碳。过夜消化后,整个混合物用200目滤网过滤,滤液在1 300 r/min(离心半径为10 cm)离心5 min,弃去上清液。将残留物重悬于剩余培养基中,置于含有10%胎牛血清和1%青霉素/链霉素的DMEM/F12培养基的T25培养瓶中培养。P1(细胞传代1次)软骨细胞用于细胞鉴定,P2(细胞传代2次)软骨细胞用于后续实验。
1.2.3 软骨细胞的阿利新蓝染色及免疫细胞化学研究:(1)将P1软骨细胞用0.25%胰蛋白酶-EDTA消化后转移至玻片上。4%多聚甲醛固定30 min后,软骨细胞在阿尔新酸化液浸泡3 min,孵育阿尔新蓝染色液30 min,PBS冲洗2次后再与阿尔新蓝染色液孵育5 min,额外PBS清洗1 min。然后,切片在不同梯度的无水乙醇中脱水,二甲苯中冲洗10 min,显微镜下观察。(2)收集P2软骨细胞,在4%(W/V)的多聚甲醛缓冲溶液中固定15 min,然后用0.2%(W/V)TritonX-100渗透10 min。用小鼠anti-ColⅡ(1∶ 100)和兔anti-ADAMTS-5(1∶ 100)一抗添加至固定后的软骨细胞中,并在4 ℃下孵育过夜。然后用PBS清洗细胞3次。相应的山羊抗小鼠IgG(H+L)交叉吸附二抗AlexaFluor488(1∶ 250)和山羊抗兔IgG(H+L)交叉吸附二抗AlexaFluor555(1∶ 250)加至上述细胞中孵育2 h。随后用DAPI(1∶ 500)染色15 min,并用激光共聚焦显微镜进行观察。
1.2.4 酶联免疫吸附试验(ELISA):在体外实验中,以IL-1β(10 ng/mL)作为对照。采用ICA、PRP和ICA+PRP分别联合IL-1β(10 ng/mL)刺激软骨细胞24 h,作为ICA组、PRP组和ICA+PRP组。将细胞上清液保存在-80 ℃中,用于分析。肿瘤坏死因子α(TNF-α)由eBioscience公司的ELISA试剂盒根据制造商的协议进行检测。
1.2.5 软骨细胞的增殖:使用CCK-8观察软骨细胞增殖情况。第二代软骨细胞的初始密度为3 000个/100 μL。以IL-1β(10 ng/mL)作为对照,ICA组、PRP组和ICA+PRP组分别联合IL-1β(10 ng/mL)刺激软骨细胞24 h。在各孔中加入CCK-8溶液10 μL和新鲜培养基100 μL,避免气泡,37 ℃孵育4 h。最后,用分光光度酶标仪在450 nm波长下测定OD值。软骨细胞的增殖活性用检测孔的OD减去空白孔的OD表示。
1.2.6 软骨细胞的凋亡:采用流式细胞术检测软骨细胞体外凋亡。处理方法如前所述,1 300 r/min(离心半径为15 cm)离心5 min后收集软骨细胞,在4 ℃用PBS洗2次。然后在1 300 r/min(离心半径为15 cm)离心5 min,重悬后,将1×106个/mL的软骨细胞100 μL与AnnexinV/PE 5 μL和7-AAD 10 μL混匀。4 ℃暗处理15 min后,加入1×Binding Buffer 400 μL中,1 h内用流式细胞仪检测细胞凋亡率。
1.2.7 动物模型和分组:取雄性新西兰白兔24只(4周龄,2~3 kg),建立OA模型,随机分为模型组、ICA+PRP组、ICA组和PRP组。新西兰白兔采用10%水合氯醛麻醉(4 mL/kg),切断手术侧的(左)膝盖内侧副韧带和前交叉韧带,切除内侧半月板[10]。术后采用8 000 000 U/kg的青霉素钾肌内注射7 d(1日1次)预防感染。所有兔都在手术结束后根据不同分组于关节内注射不同药物治疗,随后在(21±0.5)℃的条件下单独饲养,自由活动6周。6周后注射过量空气处死所有新西兰大白兔,采集左膝软骨标本,评估软骨退行性变并进行后续实验。模型组于关节内注射0.9%氯化钠溶液,1周1次;ICA+PRP组关节内注射ICA+PRP,1周1次;ICA组关节内注射ICA,1周1次;PRP组关节内注射PRP,1周1次。另取6只正常新西兰白兔作为正常组。
1.2.8 组织染色、免疫组化和国际骨关节炎研究学会(OARSI)评分:标本采集后,将兔关节用4%缓冲多聚甲醛固定24 h,用10%(W/V)EDTA(pH7.4)在4 ℃条件下脱钙3 d,石蜡包埋。采用5 μm厚度的矢状关节切片,苏木精-伊红(HE)染色。免疫组化检测COL-Ⅱ和Runt相关转录因子2的表达。采用国际骨关节炎研究学会(OARSI)评分系统[11]对HE染色结果进行评分,0分为关节软骨正常,无结构变化;15分及以上为软骨处有垂直皲裂/侵蚀,延伸至>75%的关节面;评分越高关节软骨破坏越严重。
1.2.9 实时荧光定量聚合酶链反应(RT-qPCR):取股骨内髁软骨,以PBS溶液进行冲洗3次,用眼科微型剪将软骨剪成碎末状,随后使用Trizol法分离提取总RNA。并反转为cDNA,将得到的cDNA进行Wnt1、GSK-3β及β-catenin扩增。PCR扩增反应条件为,预变性94 ℃,3 min;变性94 ℃,30 s;退火Wnt1 51.5 ℃、GSK-3β 35 ℃、β-catenin 57 ℃,30 s;延伸72 ℃,45 s;终末延伸72 ℃,10 min,4 ℃保存。最后,通过SYBR Green PCR试剂盒在ABI 7500实时PCR系统上进行RT-PCR。引物如下,Wnt1-正向引物 5′-CTGCGCCAACACAGA AATTATTGTA-3′;Wnt1-反向引物 5′-TTCACTGGCATCTTCA CTGATTCTT-3′;GSK-3β-正向引物 5′-GCGTGAGGAGGGATA AGG-3′;GSK-3β-反向引物 5′-CAGTTGGTGGAAATAATAA AGG-3′;β-catenin-正向引物 5′-GGAAATCGTG CGTGACATTA-3′;β-catenin-反向引物 5′-GGAGCAATGATC TTGATCTTC-3′。mRNA相对表达量采用2-ΔΔCt法计算,以GAPDH为内参。PCR扩增后,以实时荧光定量PCR仪自动分析结果,计算公式为ΔCt=Ct目的基因-Ct内参,记为ΔCt对照,用各组的ΔCt分别减去平均ΔCt对照,求得ΔΔCt值,再计算各组2-ΔΔCT值,即为各组中基因的相对表达量。
1.2.10 蛋白质印迹法检测软骨组织Wnt/β-catenin的表达:以RIPA裂解缓冲液提取模型组、PRP组、ICA组和ICA+PRP组的软骨组织蛋白,用BCA蛋白测定试剂盒测定总蛋白浓度。将提取的30 μg蛋白在沸水中变性5 min,经10%(W/V)十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。电泳后,将蛋白转移至聚偏氟乙烯(PVDF)膜上,室温(25 ℃)下用5%(W/V)牛血清白蛋白封闭1 h。随后用Wnt1(1∶ 1 000)、GSK-3β(1∶ 800)、β-catenin(1∶ 1 000)一抗在4 ℃条件下孵育过夜。在含有Tween-20的Tris缓冲盐水(TBST)中洗涤3次后,用相应的辣根过氧化物酶(HRP)偶联二抗体(1∶ 3 000)在室温下处理1 h。以TBST洗掉多余的二抗体,采用ECL成像试剂盒激发化学发光信号。GAPDH作为内参对照。
1.3 统计学方法
2 结果
2.1 兔软骨细胞的分离与鉴定
P2兔软骨细胞培养24 h后呈三角形、多边形和梭形,细胞逐渐整合。软骨细胞中蛋白多糖的沉积,呈蓝色。免疫组化染色Col-Ⅱ蛋白,确认提取的细胞为软骨细胞。细胞核呈蓝色,细胞质呈棕黄色。染色显示了软骨细胞的形态特征,见图1。
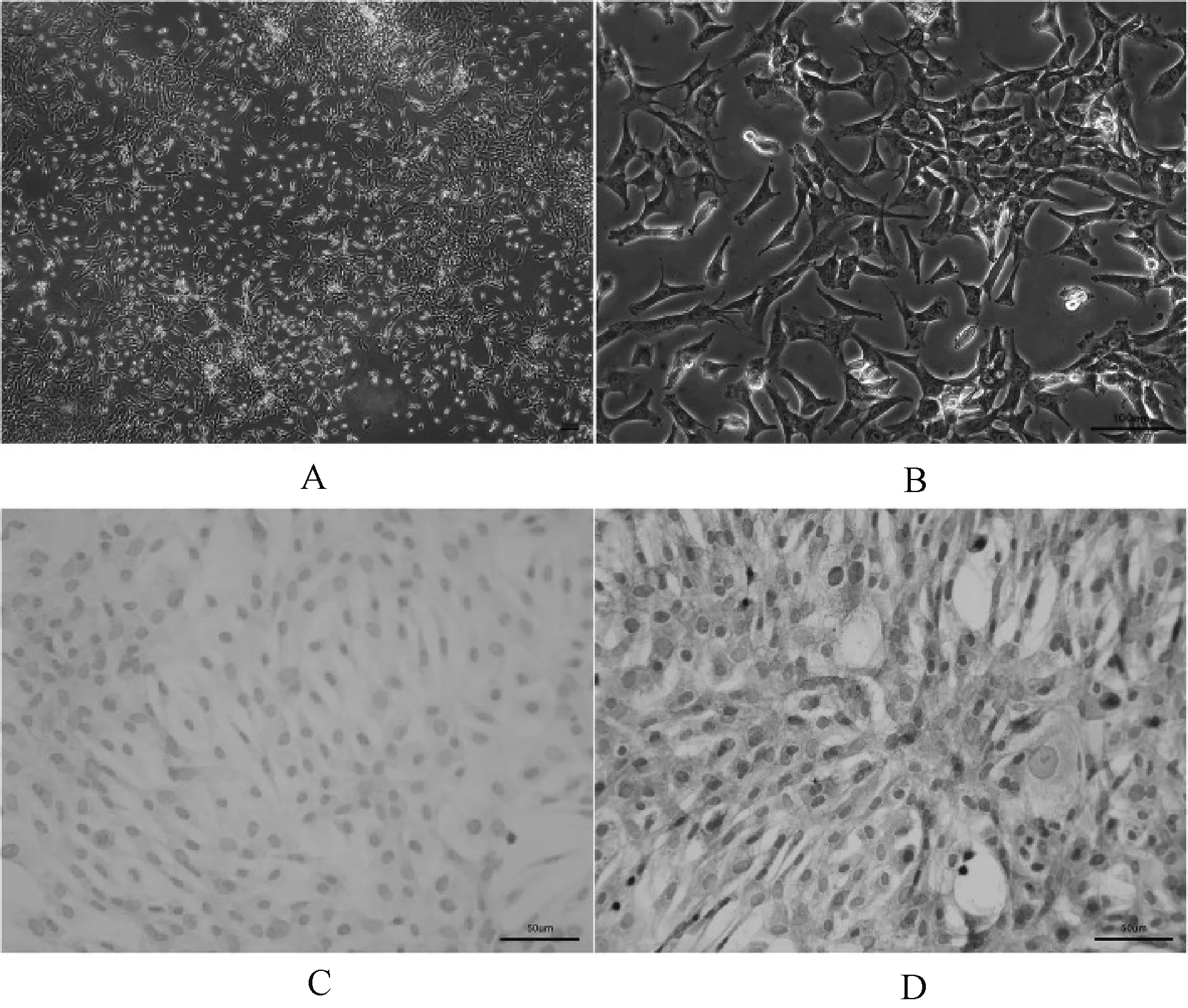
A.软骨细胞形态(倒置显微镜×40,标尺=100 μm);B.软骨细胞形态(倒置显微镜×200,标尺=100 μm);C.软骨细胞鉴定(阿尔新蓝染色);D.Col-Ⅱ细胞(免疫组化染色,标尺=50 μm)A. chondrocyte morphology (inverted microscope ×40, he bar =100 μm); B. chondrocyte morphology (inverted microscope ×200, he bar =100 μm); C. chondrocyte identification (Alcian blue staining); D. Col-Ⅱ cells (cellular immunohistochemical staining, bar=50 μm)
2.2 ICA联合PRP抑制TNF-α的释放
与IL-1β组比较,ICA组、PRP组和ICA+PRP组TNF-α水平均显著降低,且ICA+PRP组TNF-α水平最低,其次为ICA组和PRP组;ICA组、PRP组TNF-α水平的差异无统计学意义(P>0.05);ICA+PRP组对TNF-α释放的抑制效果优于ICA组及PRP组,见图2。
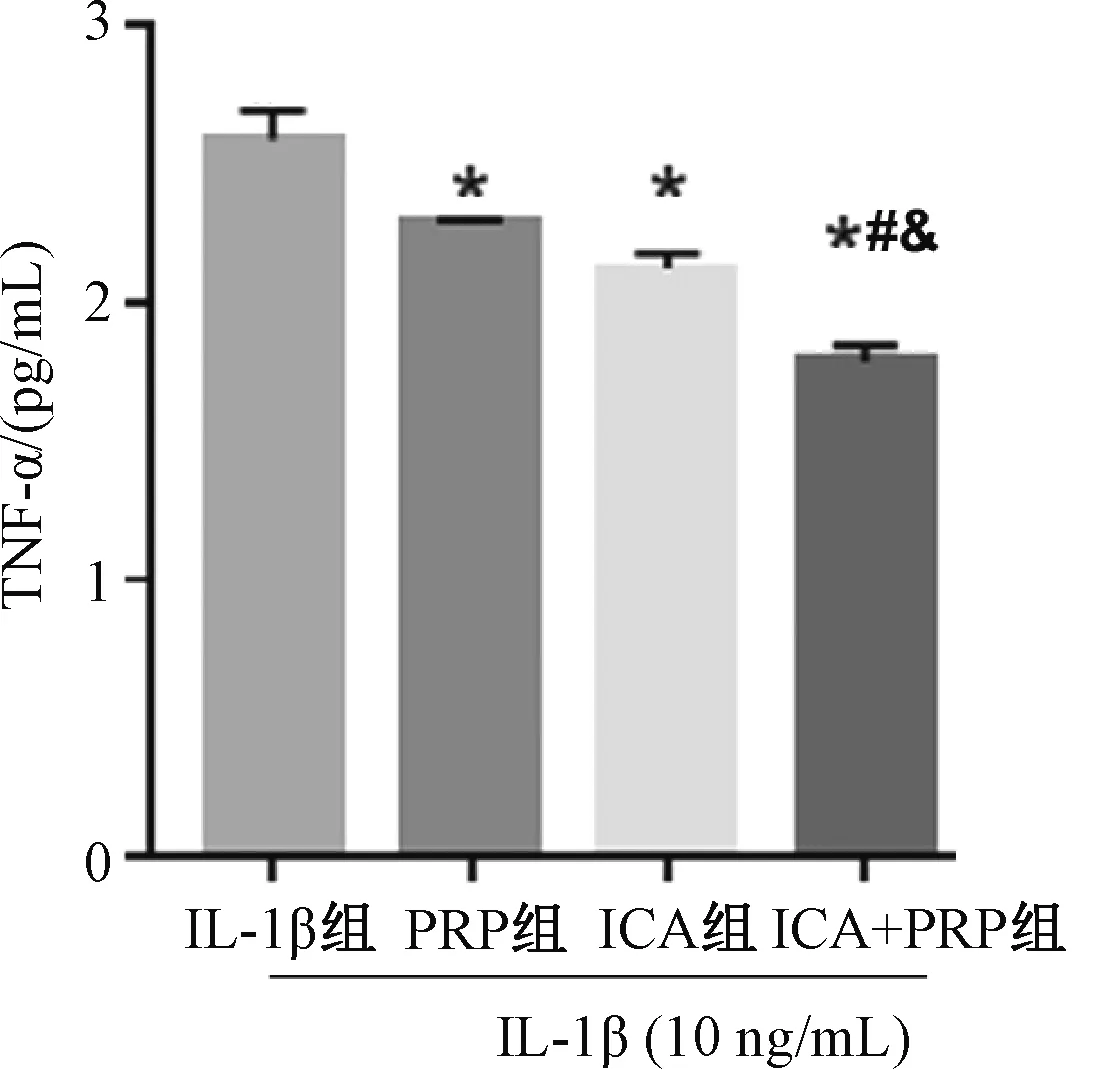
与IL-1β组比较,*P<0.05;与PRP组比较,#P<0.05;与ICA组比较,&P<0.05vs. IL-1β group, *P<0.05; vs. PRP group, #P<0.05; vs. ICA group, &P<0.05
2.3 ICA联合PRP促进软骨细胞的增殖活性
与IL-1β组比较,ICA组、PRP组和ICA+PRP组处理24 h的软骨细胞增殖活性均显著增加,且ICA+PRP组的细胞增殖活性最强,其次为ICA组,随后为PRP组;ICA+PRP组软骨细胞增殖活性优于ICA组、PRP组,差异有统计学意义(P<0.05),见图3。
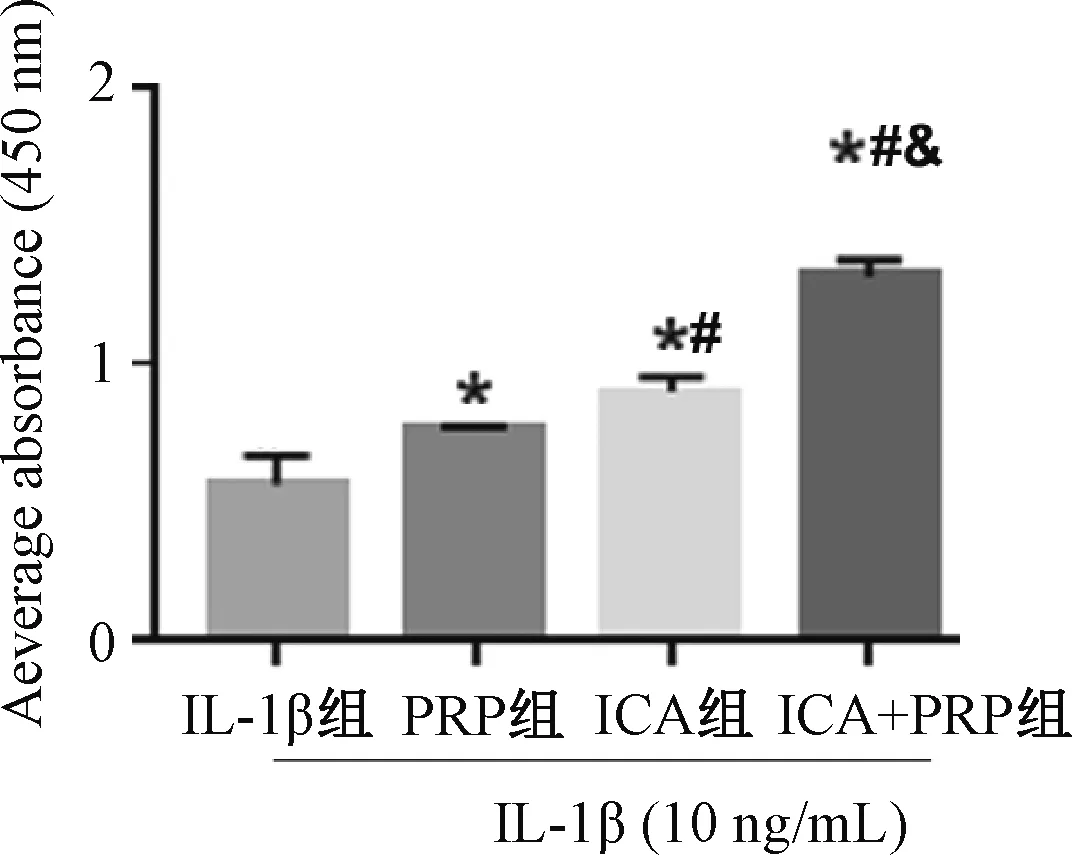
与IL-1β组比较,*P<0.05;与PRP组比较,#P<0.05;与ICA组比较,&P<0.05vs. IL-1β group, *P<0.05; vs. PRP group, #P<0.05; vs. ICA group, &P<0.05
2.4 ICA联合PRP抑制IL-1β诱导的软骨细胞凋亡
ICA+PRP组、ICA组和PRP组的处理均可抑制IL-1β对软骨细胞的凋亡作用;此外,与ICA组、PRP组比较,经ICA+PRP组处理的软骨细胞凋亡率更低,差异均有统计学意义(P<0.05),见图4。

与IL-1β组比较,*P<0.05;与PRP组比较,#P<0.05;与ICA组比较,&P<0.05vs. IL-1β group, *P<0.05; vs. PRP group, #P<0.05; vs. ICA group, &P<0.05
2.5 体内ICA联合PRP治疗OA的效果
本实验中,兔没有发生明显的不良事件。正常组兔的关节软骨表面光滑,结构完整,无缺损,软骨细胞排列有序,边界明确,潮线清晰。模型组兔的关节软骨表面局灶性增生,软骨细胞排列不规则,边界模糊。PRP组兔的关节软骨表面局灶性增生依然存在,软骨细胞排列不规则,边界模糊。ICA组兔的关节软骨表面增生轻微减少,但软骨细胞排列不规则,边界模糊程度减少。ICA+PRP组兔的关节软骨表面增生减少,软骨细胞排列不规则和边界模糊程度都减少。
OASRI评分结果显示,与正常组比较,模型组、PRP组、ICA组和ICA+PRP组评分均显著升高;与模型组比较,PRP组、ICA组和ICA+PRP组评分显著降低;与ICA组、PRP组比较,ICA+PRP组评分均显著降低;与PRP组比较,ICA组评分显著降低,上述差异均有统计学意义(P<0.05)。
另外,ICA+PRP组、ICA组和PRP组逆转了骨关节炎引起的COL-Ⅱ表达降低,与模型组比较,差异均有统计学意义(P<0.05);ICA+PRP组的COL-Ⅱ表达高于ICA组、PRP组,ICA组高于PRP组,差异均有统计学意义(P<0.05),见图5。
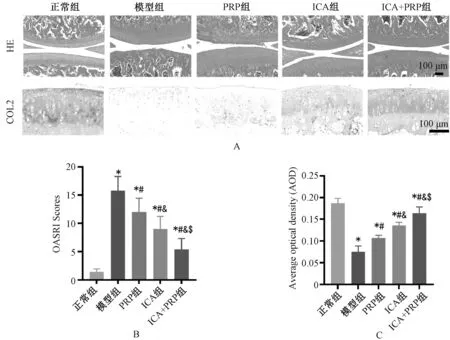
A.股骨髁片的HE染色和COL-Ⅱ表达的免疫组化染色(×200,比例尺=100 μm,n=6);B.OARSI评分;C.COL-Ⅱ表达量(用平均OD值表示);与正常组比较,*P<0.05;与Model组比较,#P<0.05;与PRP组比较,&P<0.05;与ICA组比较,$P<0.05A. HE staining of femoral condyles and immunohistochemical staining of COL-Ⅱ expression (×200, bar=100 μm, n=6); B.OARSI score; C. expression of COL-Ⅱ (mean OD value); vs. normal group, *P<0.05; vs. model group, #P<0.05; vs. ICA group, &P<0.05; vs. PRP group, $P<0.05
2.6 ICA和PRP对Wnt/β-catenin信号通路基因的mRNA水平的影响
与模型组比较,ICA组Wnt、β-catenin的mRNA表达显著降低,GSK-3β的mRNA表达显著升高,差异均有统计学意义(P<0.05)。与模型组比较,PRP组β-catenin的mRNA表达显著降低,GSK-3β的mRNA表达显著升高,差异均有统计学意义(P<0.05);而PRP组中Wnt的mRNA表达与模型组的差异无统计学意义(P>0.05)。与ICA组比较,ICA+PRP组Wnt、β-catenin的mRNA表达显著降低,差异均有统计学意义(P<0.05);GSK-3β的mRNA表达组间比较,差异无统计学意义(P>0.05)。与PRP组比较,ICA+PRP组Wnt、β-catenin的mRNA表达显著降低,GSK-3β的mRNA表达显著升高,差异均有统计学意义(P<0.05)。与模型组比较,ICA+PRP组Wnt、β-catenin的mRNA表达显著降低,GSK-3β的mRNA表达显著升高,差异均有统计学意义(P<0.05),见图6。
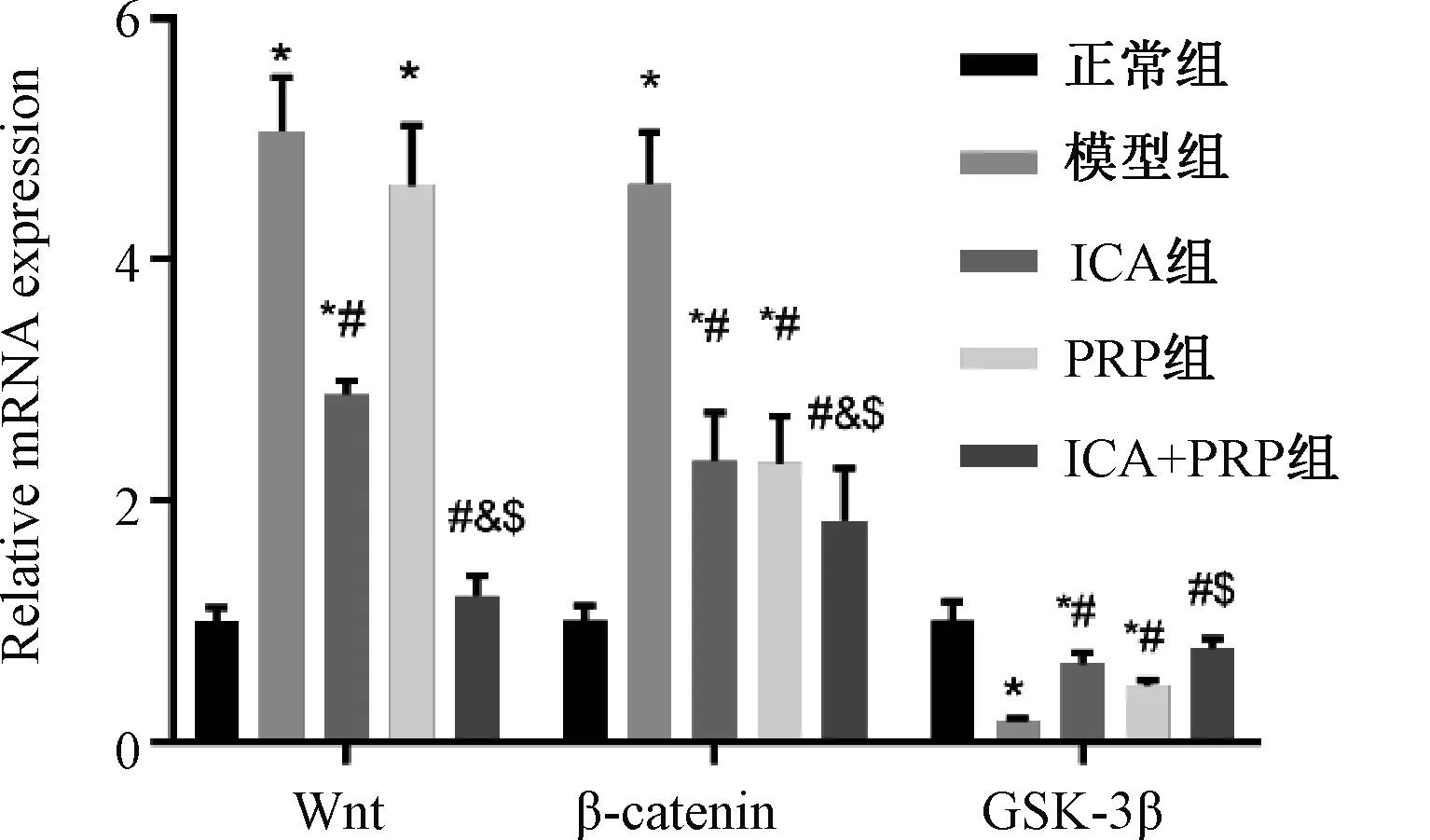
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与ICA 组比,&P<0.05;与PRP 组比,$P<0.05vs. normal group, *P<0.05; vs. model group, #P<0.05; vs. ICA group, &P<0.05; vs. PRP group, $P<0.05
2.7 ICA和PRP对Wnt/β-catenin信号通路基因的蛋白表达水平的影响
与模型组比较,ICA组和PRP组Wnt、β-catenin的蛋白表达显著降低,GSK-3β的蛋白表达水平显著升高,差异均有统计学意义(P<0.05)。与ICA组比较,ICA+PRP组Wnt、β-catenin的蛋白表达水平显著降低,差异均有统计学意义(P<0.05);GSK-3β的蛋白表达水平组间比较,差异无统计学意义(P>0.05)。与PRP组比较,ICA+PRP组Wnt、β-catenin的蛋白表达水平显著降低,GSK-3β的蛋白表达水平显著升高,差异均有统计学意义(P<0.05)。与模型组比较,ICA+PRP组Wnt、β-catenin的蛋白表达水平均显著降低,GSK-3β的蛋白表达水平显著升高,差异均有统计学意义(P<0.05),见图7。
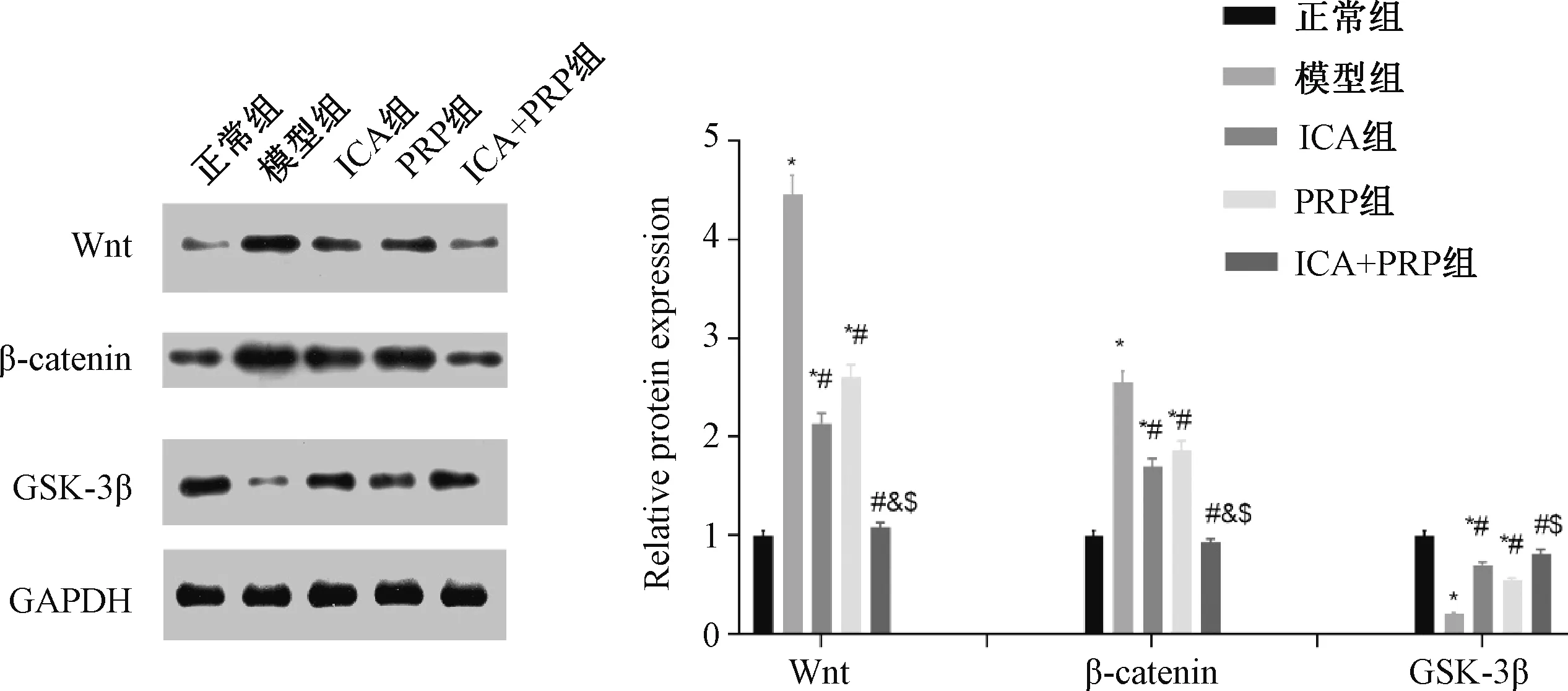
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与ICA组比较,&P<0.05;与PRP组比较,$P<0.05vs. normal group, *P<0.05; vs. model group, #P<0.05; vs. ICA group, &P<0.05; vs. PRP group, $P<0.05
3 讨论
本研究观察了ICA联合PRP对OA兔模型软骨损伤的修复作用,结果表明,ICA联合PRP是极具潜力的OA治疗药物和软骨组织Wnt/β-catenin信号阻断剂,ICA与PRP联合干预的效果优于两种药物单独干预。
PRP能够调整Wnt/β-catenin通路信号强度,抑制IL-1β和TNF-α等的过度募集,切断炎症级联反应等恶性循环,炎症急性期之后可有效阻断炎症细胞-炎症介质之间的效应放大环。PRP还可调控胶原纤维的合成,抑制胶原裂解酶(如基质金属蛋白酶)的分泌,因此将PRP用于改善骨关节炎症和软骨降解的前景较为理想。目前,PRP联合药物的OA治疗方案也有了更多实质性进展[12]。本研究将ICA与PRP联合干预兔的OA,发现ICA与PRP联合治疗或者ICA和PRP分别单独治疗均逆转了模型中的有害变化,修复了兔的软骨损伤,减少了软骨细胞的凋亡,而联合治疗的优势明显大于ICA或PRP单独治疗。本研究结果证明,PRP联合药物治疗可能是一种更有价值的OA治疗策略。
本研究将软骨细胞暴露于IL-1β在体外模拟OA模型。软骨细胞受到IL-1β的作用,增殖能力下降,凋亡增加,且IL-1β诱导软骨细胞TNF-α表达显著升高。炎症与骨关节炎软骨损伤的进展有关,不同的介质协同放大和延续这一过程。本研究结果表明,ICA联合PRP的抗炎作用与PRP类似,可以下调促炎细胞因子TNF-α的水平,且效果更优。
本研究结果表明,ICA组、PRP组和ICA+PRP组可以减轻OA的炎症反应、软骨细胞凋亡和软骨损伤。而OA中炎症反应、软骨细胞凋亡和软骨损伤的分子机制尚不完全清楚[13]。研究结果表明,Wnt/β-catenin信号通路通过控制软骨细胞的增殖和凋亡在抗炎作用中发挥重要作用[14]。Wnt/β-catenin信号通路对软骨细胞分化的促进作用依赖于下游关键丝氨酸激酶蛋白GSK-3β的表达[15]。本研究结果发现,与正常组比较,模型组软骨组织中β-catenin和Wnt1的表达水平升高,但GSK-3β和COL-Ⅱ的表达水平降低,表明OA中Wnt/β-catenin对软骨细胞的分化作用被阻断,抑制了胶原合成,而ICA+PRP组、ICA组和PRP组逆转了这一现象,ICA+PRP组对GSK-3β和COL-Ⅱ的逆转作用优于ICA组和PRP组,而ICA+PRP组对Wnt1和β-catenin的抑制作用也明显强于ICA组和PRP组。一些研究得出了类似的结论,如Ⅰ期临床试验观察到特异性抑制Wnt/β-catenin信号通路可以有效治疗重度OA[16]。本研究中,ICA联合PRP是抑制Wnt/β-catenin通路的有效药物,可通过Wnt/β-catenin信号通路改善OA。
综上所述,ICA联合PRP可通过促进软骨细胞增殖、抑制炎症损伤和细胞凋亡来发挥抗OA的作用,其中Wnt/β-catenin信号通路密切参与此过程。本研究结果为ICA和PRP在OA临床治疗中的联合应用提供了实验基础,为ICA联合PRP关节腔内注射技术的应用提供了指导依据。

