太湖流域浮游植物功能类群分布特征及其与环境因子的关系*
罗敏纳,孙蓓丽,朱冰川,宋 挺,蔡 琨,吕学研,张 咏,张 玮,石浚哲,张虎军,刘 妍,陆欣鑫,范亚文,张军毅2,
(1:哈尔滨师范大学生命科学与技术学院,黑龙江省植物学省级重点实验室,哈尔滨 150025) (2:江南大学环境与土木工程学院,无锡 214122) (3:东南大学无锡分校,无锡市生物芯片重点实验室,无锡 214135) (4:江苏宏众百德生物科技有限公司,无锡 214028) (5:江苏省无锡环境监测中心,无锡 214121) (6:江苏省环境监测中心,南京 210019) (7:上海海洋大学水产与生命学院,农业农村部鱼类营养与环境生态研究中心,上海 201306)
浮游植物作为水生态系统的初级生产者[1],对环境变化敏感[2],其群落结构特征已成为反映水环境状况的重要指标[3],浮游植物常被用来评估水体健康状况[4]. 但基于传统的物种分类方法对浮游植物在水生态系统中的功能较难有全面的认识[5]. 为了更好地分析浮游植物对环境变化的响应,Reynolds等[6]把形态、生理和生态特征相似的浮游植物归为一组,形成了31个具有相同生态位特征的分组,即“功能类群(functional group,FG)”. Padisák 等[7]基于前人研究,完善并更正了部分在分组上被错配的物种. 目前,大家公认的FG分组已达39个[2]. 功能类群分类法划分高效,生态特征明显[8-9],使得越来越多的学者利用该方法对湖泊[10]、河流[11]、水库[12]等水生态系统的浮游植物群落分布和演替进行研究. 刘毛亚[5]使用FG、MFG(morpho-functional group)、MBFG(morphology-based functional group)3种划分方法研究了东太湖、太浦河及金泽水库的典型湖库联通水域浮游植物的分布特征;夏莹霏[10]和杨丽[13]使用FG分别研究了太湖和淀山湖浮游植物的季节演替;钱烁统[14]使用MBFG对太湖流域黄昌河、长寿河、祝塘河的藻类组成进行了研究. 浮游植物功能类群研究方法已逐渐成为探索水生态系统结构与功能的有效研究手段[2].
浮游植物群落组成主要受空间和环境因子共同影响[15]. Chang等发现在受人为干扰最小的山中池塘,空间因子在浮游植物分布格局中起主要作用[16]. Huszar等发现在大型亚热带河流系统中,只有环境可以显著解释浮游植物群落组成[17]. Xiao等研究了中国3个淡水湖泊区域,发现在单一湖泊区域,浮游植物群落格局主要由环境因子解释;而在大尺度的3个湖泊区域,空间变量只能通过物种分类来展现,而环境变量既能通过功能类群结构也能通过物种结构来展现[9]. 太湖流域作为长江三角洲的核心区域,幅员辽阔,水系发达,各水体间物质能量交换和生态联系紧密,水生态系统既具有相互影响的整体性特征,又存在区域之间的差别[18]. 近年来由于高强度的发展所带来的水环境污染与生态恶化问题受到人们广泛关注. 而目前关于太湖流域浮游植物的研究几乎都围绕环境因子展开,且以单一地点的研究居多. 因此,以湖泊及流域系统为整体单元,开展流域内湖泊、河流、水库和溪流等水体浮游植物系统的调查和研究,评估空间及环境的贡献大小,识别影响流域浮游植物分布的关键环境因子尤为重要.
本研究选择丰水期对太湖流域主要湖泊、河流、水库和溪流等4种不同类型水体开展浮游植物和水质调查,使用FG归类法对太湖流域浮游植物进行类群划分,分析浮游植物群落组成在水体间的差异及在全流域空间的分布格局,评估空间及环境的贡献大小,以及影响浮游植物功能类群空间分布的关键环境因子,旨在揭示太湖流域浮游植物功能类群的地理分布格局,并为太湖流域生态学研究及水域生态系统的监测和治理提供基础资料.
1 材料与方法
1.1 研究区域采样点设置
太湖流域地跨江苏、浙江、安徽、上海3省1市,西部多丘陵山地,东部以平原水网为主,是长江三角洲的核心区域,也是全国人口稠密、经济发达和城市化程度最高的地区之一[19]. 流域面积3.69万 km2,水域面积为6134 km2,属于亚热带季风气候,年均温度15~17℃,年均降水量1177 mm,全年日照时数2000~2200 h[20]. 结合太湖流域的地理形态和水文条件,本研究共设置了85个采样点,涵盖河流(45个采样点)、湖泊(30个采样点)、水库(4个采样点)、溪流(6个采样点)4类不同的水体,具体设置如图1所示,各采样点信息见附表Ⅰ.

图1 太湖流域采样点Fig.1 Sampling sites in Taihu Basin
1.2 样品采集、处理及鉴定
本研究于2019年8-9月对太湖流域85个采样点进行定性样品和定量样品的采集. 定性样品使用25#浮游生物网在选定采样点的水面下0.5 m处作“∞”形循环缓慢拖动1~3 min,用甲醛溶液固定保存[21]. 使用1 L的采水器在水面以下0.5 m处进行定量样品采集,现场加入1.5%的Lugol’s试剂固定,带回实验室沉淀24 h后,浓缩至50 mL. 对于水深小于0.5 m的较浅水体,例如溪流等位点,在水深一半处采样.
样品使用Algae-Hub藻类人工智能分析仪(AH-20-S,宏众百德)扫描分析,得到全片电子化图像. 然后,根据Algae-Hub藻类数据库(Algae-Hub V3.2),采用仪器的“人工智能图像识别技术”和人工校验功能,对样品进行定性和定量分析. 藻类人工智能分析仪对每个浮游植物细胞的形态大小进行自动测量和体积计算,并根据109μm3≈1 mg换算为生物量(mg/L). 每个样品的原始图像数据及定量分析结果已上传至Algae-Hub数据库[注]www.algaehub.cn (https://phylum-preview.algaehub.cn/#/sampleLibrary).(项目编号:DSATH210709). 功能类群的划分参考文献[2,6].
1.3 理化指标的测定

1.4 数据分析
使用Excel 2016与Origin 2018软件进行数据统计分析和图表的绘制. 使用ArcGIS 10.2软件绘制采样点地图,将浮游植物功能类群生物量数据lg(x+1)转换后,利用反距离权重法(Inverse Distance Weighting, IDW)绘制优势功能类群的平面分布图. 根据各采样点浮游植物功能类群生物量的数据矩阵,利用R 4.0 中的ade4包计算Bray-Curtis距离矩阵,使用vegan包进行层次聚类分析、相似性百分比分析(SIMPER)、相似性分析检验(ANOSIM),以研究太湖流域浮游植物功能类群的空间分布特征. 基于聚类结果,通过SPSS 22.0对水体理化因子进行非参数检验(Kruskal-Wallis检验).
在R中利用vegan包和geosphere包,对环境变量和空间变量(PCNM)进行方差膨胀因子检验,在基于距离的冗余分析(db-RDA)中使用前向选择保留显著的环境变量和空间变量,使用变差分解(Variation partitioning)确定环境变量与空间变量对浮游植物群落变化的解释率. 将浮游植物优势功能类群生物量和环境因子数据(除pH)进行lg(x+1)转换,采用CANOCA 4.5软件进行去趋势对应分析(DCA),排序轴长度小于3,蒙特卡洛置换检验后,通过冗余分析(RDA)研究优势功能类群与环境因子之间的关系.
2 结果与分析
2.1 太湖流域浮游植物群落组成
共鉴定浮游植物250个分类单位,包括242种6变种2变形,隶属于9门13纲28目57科110属,其中绿藻门种类最多,为47属108种5变种1变形,占浮游植物种类总数的45.6%;其次为硅藻门,26属46种1变种1变形,占19.2%;蓝藻门21属41种,占16.4%;裸藻门5属31种,占12.4%;隐藻门3属7种,占2.8%;甲藻门3属3种,占1.2%;黄藻门1属2种,占0.8%;金藻门2属2种,占0.8%;轮藻门2属2种,占0.8%. 物种丰富度呈现流域西部(山丘地区的溪流)最低、太湖及长江沿岸的河湾次之、中部平原河网最高的格局. 在4类水体中,浮游植物种类组成均以绿藻门、硅藻门和蓝藻门为主,河流的浮游植物种类数最多,达到224种,其次为湖泊166种,水库为83种,溪流的种类数最低,仅34种.
浮游植物平均生物量为7.63 mg/L,在0.02~233.10 mg/L之间波动,以蓝藻门、硅藻门、绿藻门为主,整体呈现流域西部(山丘地区的溪流)水体浮游植物生物量最低,除北太湖以外的太湖、中部平原河网和长江沿岸的河湾次之,北太湖及沿岸区域最高的空间格局. 在4类水体中,河流的平均生物量最高,为(9.76±34.12)mg/L,其次为湖泊(6.57±6.36)mg/L,水库为(3.17±0.33)mg/L,溪流为(0.25±0.18)mg/L.
2.2 太湖流域功能类群组成及优势功能类群分布特征
根据Reynolds等[6]提出的FG划分方法对太湖流域浮游植物进行划分,可分为31个功能类群,分别为M、D、J、S1、C、Y、F、P、X3、MP、X1、X2、H1、W2、Lo、T、N、SN、W1、W0、G、K、TB、Q、TD、Xph、WS、E、LM、S2、TC. 某一功能类群出现的采样点数与总采样点数的比率为该功能类群的出现频率. 在所有采样点中,M、D、J、S1、C类群出现频率超过90%,是夏季太湖流域的绝对优势类群;Y、F、P、X3、MP、X1、X2、H1类群出现频率在50%~90%之间,是夏季太湖流域的常见功能类群;W2、Lo、T、N、SN、W1类群出现频率在30%~50%之间,W0、G、K、TB、Q、TD、Xph、WS、E、LM、S2、TC类群出现频率小于30%,这些功能类群仅在适宜的生境中出现(图2).

图2 太湖流域浮游植物功能类群出现频率及代表种属Fig.2 The frequency of occurrence and representative species of phytoplankton functional groups in Taihu Basin
将至少在一个采样点相对生物量大于10%的功能类群定义为优势功能类群[23]. 本次研究共划分15个优势功能类群,分别是M、D、J、S1、C、Y、F、P、MP、H1、SN、W1、G、K、TB类群,它们在各采样点及太湖流域的分布如图3、4所示(图4仅展示贡献率高的优势类群,其余优势类群分布见附图Ⅰ). M、D、C类群主要分布在北太湖-滆湖区域内,S1类群在梅梁湖和元荡分布较多,SN类群主要分布在东潘桥和五里湖,J、F类群主要分布在阳澄湖、太湖西部和水库区域内,Y、W1类群在漕桥和钓渚大桥附近分布较多,H1类群主要分布在流域东部,P、G、K类群在东西氿、昆承湖和傀儡湖等小型湖泊中分布较多,MP、TB类群在西太湖及沿岸区域分布较多.
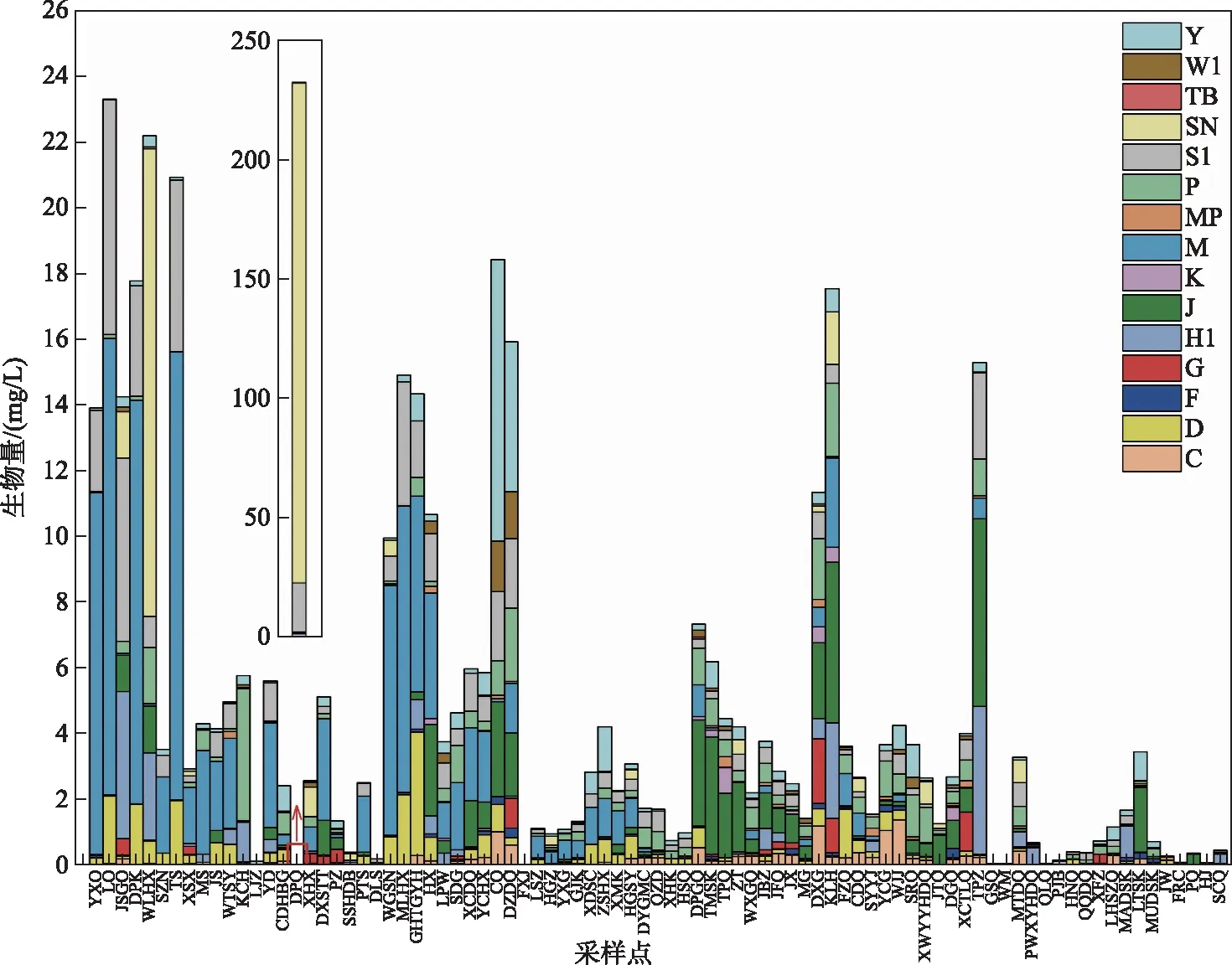
图3 太湖流域各采样点浮游植物优势功能类群及生物量Fig.3 Dominant functional groups and biomass of phytoplankton at sampling sites in Taihu Basin
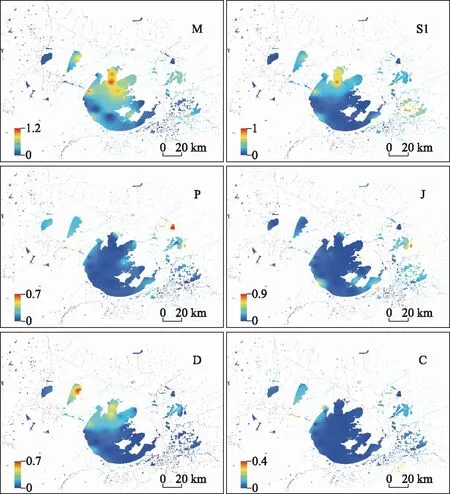
图4 太湖流域浮游植物优势功能类群分布Fig.4 Distribution of dominant functional groups of phytoplankton in Taihu Basin
在4类水体中,湖泊的主要功能类群为M、S1、SN、D、P,相对生物量最高的是M类群(微囊藻属Microcystis)(40.19%);河流的主要类群为SN、S1、M、J、Y,相对生物量最高的是SN类群(拉氏拟柱孢藻Cylindrospermopsisraciborskii)(48.75%);溪流的主要类群为J、H1、MP、D、S1,J类群(四足十字藻Crucigeniatetrapedia)(25.22%)相对生物量最高;水库的主要类群为J、Y、P、H1、S1,J类群(十字藻属Crucigenia)(44.54%)的相对生物量最高(附图Ⅱ). 太湖流域各水体间功能类群组成差异显著(ANOSIM,P<0.05),差异主要来自M、J、S1、Y、P、H1类群(SIMPER).
2.3 太湖流域功能类群及环境因子特征分析
功能类群聚类结果显示,85个采样点被分为3个聚类组(图5,附图Ⅲ). 组Ⅰ包括太湖东部及湖心区、梅梁湖沿岸、昆承湖、长荡湖北干、元荡及周围水域、东潘桥、林家闸;组Ⅱ包括梅梁湖心、竺山湖心、贡湖及沿岸区、太湖南部和西部及沿岸区、阳澄湖心、钱资荡-滆湖-新河口等区域水体、江边闸-锡常大桥-沙墩港等区域水体;组Ⅲ包括长江沿岸区、水库区域、溪流区域. 总体来说,太湖湖心、东部和部分北部及沿岸区域功能类群组成相似,太湖南部、西部、部分北部及沿岸、距太湖较近的平原河网区域功能类群组成相似,太湖以西的水库、溪流和临近长江的区域功能类群组成相似. SIMPER分析显示,M、S1类群为组Ⅰ的主要贡献类群,M、S1、P、J为组Ⅱ的主要贡献类群,P、S1、J、D、C为组Ⅲ的主要贡献类群(贡献率均在10%以上),且3组间的功能类群组成存在明显差异(ANOSIM,P<0.05).
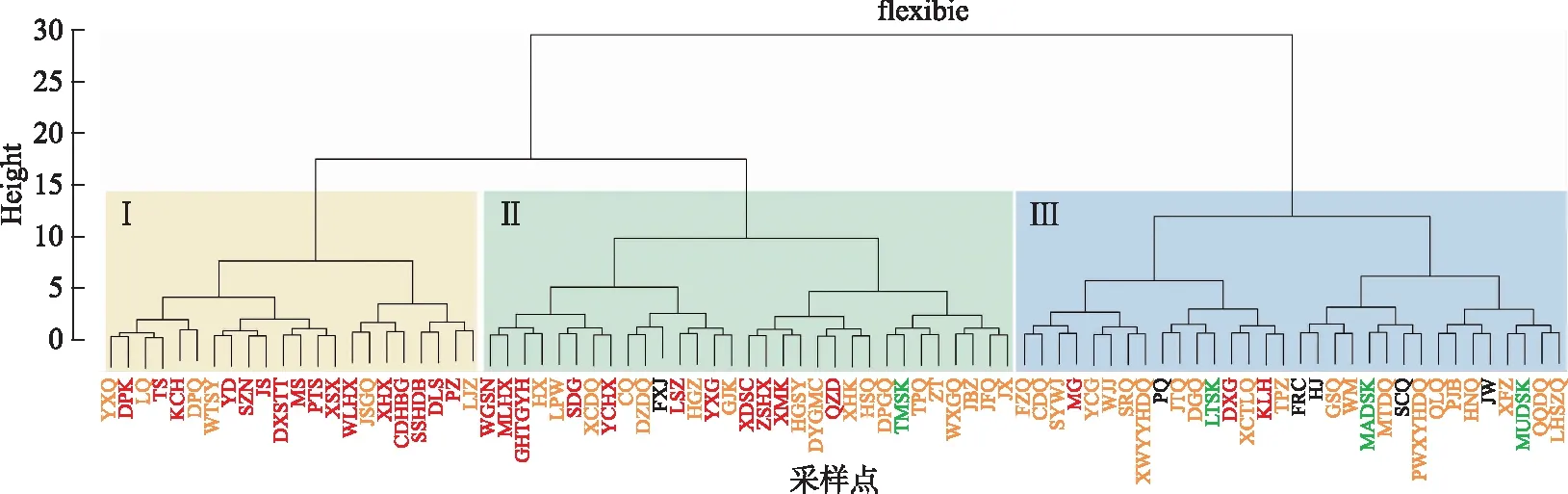
图5 基于功能类群的太湖流域85个采样点的聚类分析 (红色代表湖泊,黄色代表河流,绿色代表水库,黑色代表溪流)Fig.5 Cluster analysis of 85 sampling sites in Taihu Basin based on functional groups (Red represents lakes, yellow represents rivers, green represents reservoirs, and black represents streams)
基于聚类结果,对3个聚类组的环境因子进行分析. Kruskal-Wallis检验表明,从组Ⅰ到组Ⅲ,水温显著升高(P<0.01),DO、BOD5、CODMn显著下降(P<0.05),有机污染逐渐降低,组Ⅱ的Chl.a和NH3-N显著高于其他两组(P<0.05),其余环境因子无明显差异(图6).

图6 基于聚类组的环境因子分析Fig.6 Environmental factor analysis based on cluster groups
2.4 空间和环境因子对浮游植物功能类群的影响
变差分解结果(图7)显示,环境因子和邻体矩阵主坐标(PCNM)共解释太湖流域浮游植物功能类群变化的25.7%,环境因子和PCNM分别单独解释了2.4%和13.1%. 因此,对于太湖流域而言,空间因子比环境因子对浮游植物功能类群组成的影响更大. 组Ⅰ分析结果显示,环境因子和PCNM共解释功能类群变化的22.6%,环境因子和PCNM分别单独解释了9.5%和0.2%. 组Ⅱ分析结果显示,环境因子和PCNM共解释功能类群变化的35.3%,环境因子和PCNM分别单独解释了15.5%和13.4%. 组Ⅲ分析结果显示,环境因子和PCNM共解释功能类群变化的10.7%,环境因子和PCNM分别单独解释了2.3%和4.8%.
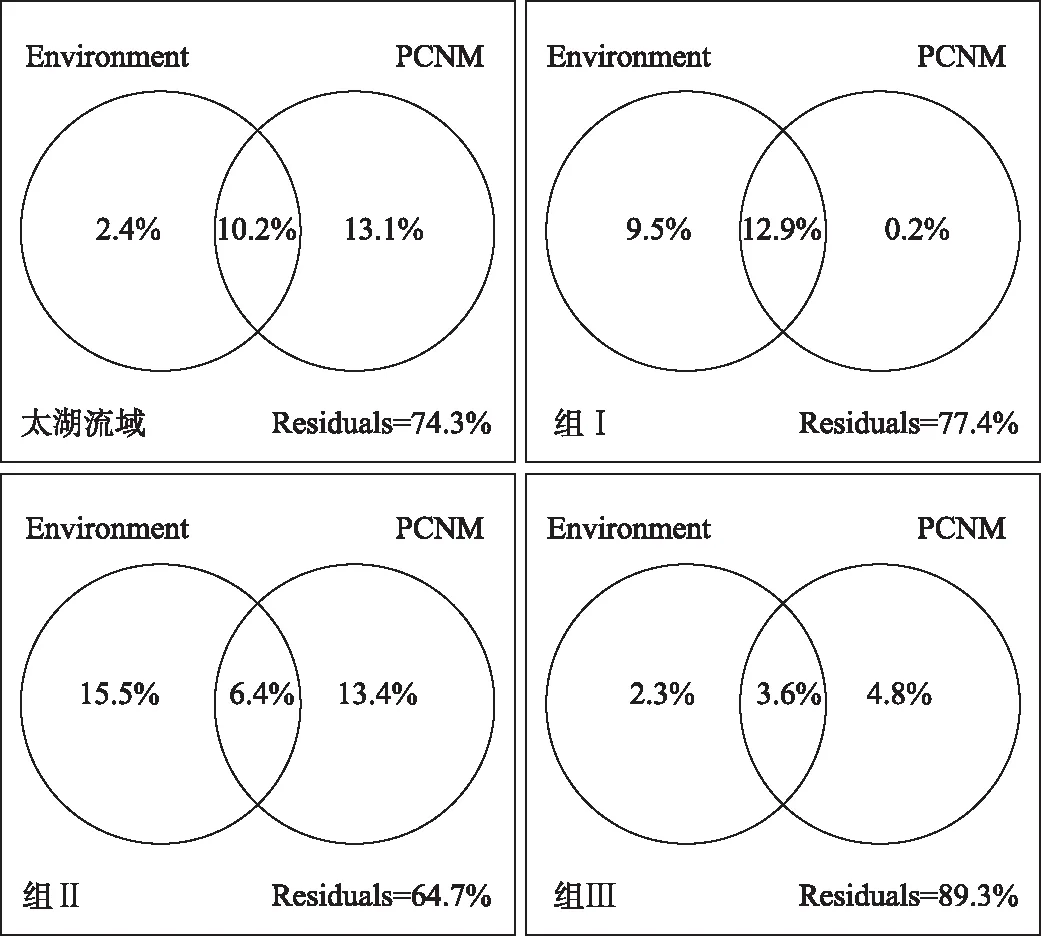
图7 太湖流域环境变量与空间变量的变差分解Fig.7 Variation partitioning of environmental and spatial variables in Taihu Basin


图8 太湖流域优势功能类群与 环境因子的RDA分析Fig.8 Redundant analysis of dominant functional groups and environmental factors in Taihu Basin
3 讨论
3.1 太湖流域浮游植物功能类群空间分布特征
基于功能类群的聚类分析将太湖流域浮游植物分为3组. 组Ⅰ为太湖湖心、东部和部分北部及沿岸区域,浮游植物群落结构为蓝藻型,物种较为单一,M、S1类群为主要贡献类群(微囊藻属、土生假鱼腥藻Pseudanabaenamucicola和阿氏浮丝藻Planktothrixagardhii). 太湖流域夏季水温较高,受入湖河流营养盐输入和湖体污染物滞留的影响[24],该区域水体营养盐充沛,使耐受高温的M类群在资源竞争中占据绝对优势. M类群利用伪空胞上浮到表层获得充足的光照,限制其他藻类的光合作用[25],加上夏季多风浪扰动导致水体浑浊,从而利于耐受低光、混合生境的S1类群生长繁殖. 值得注意的是,S1类群中的土生假鱼腥藻常与M类群的铜绿微囊藻伴生形成水华(附图Ⅳ),舒惠琳等[26]发现铜绿微囊藻向周围环境分泌的化感物质可以促进土生假鱼腥藻的生长. 在暴发的蓝藻水华中,浮丝藻常常混合在微囊藻水华中,成为某些水体的优势种类[27]. 张军毅[28]对太湖浮游植物的多年系统研究发现,M类群为夏季太湖的第一优势类群,且S1中的土生假鱼腥藻和阿氏浮丝藻分别为太湖和五里湖的优势类群. 邓乐等[29]在对程海湖夏季浮游植物功能类群研究时发现,8月程海湖出现大量S1类群. 国内外众多湖泊也发现S1类群为夏季优势功能类群[10,30].
太湖南部、西部和部分北部及沿岸、距太湖较近的平原河网地区构成第Ⅱ聚类组,该组采样点多位于河湖交替地带和平原河网地区,群落构成属于蓝藻-绿藻-硅藻型. 研究表明,扩散作用使相互连接的水体中浮游植物群落的相似性增强[31],持续扩散能够促进浮游植物局部共存[32]. 受入湖河流营养盐输入和扩散作用的影响,M类群在该组仍占优势. 在河湖交替地带,风浪扰动和水文交互等因素引起大量底泥悬浮[25],以及夏季“台风降雨”和“引江济太”等工程措施的影响[33-34],水体浊度增加[35]. 此外,在平原河网地区,河水流动、船只往来、降雨和地表径流等因素造成水体扰动浑浊[24,36]. 因此,适宜混合生境的S1类群和适宜营养程度较高的混合生境的P、J类群在该区域也占据优势. 本研究在对河流浮游植物的调查中发现,东潘桥出现大量的S1、SN类群(泽丝藻属Limnothrix和假鱼腥藻属Pseudanabaena、尖拟柱孢藻Cylindrospermopsiscuspis),造成河流水体中S1、SN类群生物量占比过多. 除去这两个类群,M、J、Y、P类群在河流中占据优势,代表种属分别为微囊藻属、链带藻属(Desmodesmus)和十字藻属、隐藻属(Cryptomonas)、沟链藻属(Aulacosei-ra),这与邓建明等[37]关于夏季太湖流域主要河道浮游植物的调查结果基本一致.
组Ⅲ距离太湖较远,主要为太湖以西的水库、溪流和临近长江的水域,浮游植物群落结构为绿藻-硅藻-蓝藻型. 河流来水为水库带来一定的营养盐[38];降雨使土壤表层的营养物质流入溪流[36];临近长江的水域由于工农业和人类活动的影响,水体浑浊,营养盐浓度较高. 丰富的营养盐和混合生境满足了J、P、S1、D、C类群的生长. 另外,该组区域TN相对较高. 据报道,谷皮菱形藻(Nitzschiapalea)和梅尼小环藻(Cyclotellameneghiniana)属于氮异养生物[39],对氮盐的亲和力要大于对磷盐的亲和力,这可能也是D类群和C类群贡献较高的原因之一.
3.2 太湖流域浮游植物功能类群与空间、环境因子的相关性
变差分解表明,环境因子对太湖流域浮游植物功能类群变化的解释率小于空间因子. 太湖流域涵盖4种不同类型的水体,且不同水体分布区域不同,这使得依靠被动扩散的浮游植物在一定程度上受到空间扩散限制[40],从而影响浮游植物群落结构. 另外,空间和环境因子共同解释率为10.2%,说明环境因子受空间因素的影响也具有一定的空间分布规律,特别是在水体类型分布区域不同的太湖流域. 在较小尺度的组Ⅰ和组Ⅱ区域,环境因子的解释率均高于空间因子,说明环境因子在较小的空间尺度上对浮游植物群落的影响更大. 对组Ⅲ而言,空间的解释率略大于环境,且解释率较低,可能与不同水体间的差异及其分布区域有关.
不同的浮游植物种类所需的pH范围不同. 一般情况下,浮游植物在弱碱性水体中光合作用效率更高,生长繁殖得更好[13]. RDA排序显示,TB类群与DO、pH呈正相关. TB类群为附生硅藻,研究发现,一些硅藻种类受pH影响显著[46]. 这一结论在对西藏巴松错浮游植物功能类群研究中也得到证明[23]. 夏季温度较高,藻类大量繁殖,在pH升高的同时,DO往往会出现超饱和状态[47],这可能是大多数优势类群与DO、pH呈正相关的原因. 研究发现,在富营养化浅型水体中,pH和DO呈显著正相关[48],这一结论在本研究得到证明.
3.3 不同功能类群的水生态管理
对于夏季太湖流域水生态管理而言,首要面对的是以M优势类群微囊藻属为特征的蓝藻水华防控. M类群在太湖流域水体中几乎均有分布,尤其是在夏季太湖西北部水域会形成大量的水华,造成较高的环境风险. 当在饮用水源地出现M类群大面积聚集时,一旦生物量达到处理阈值,水厂必须提高沉淀和过滤措施,必要时还需采取“调水引流”和“人工打捞”等措施来缓解处置压力. 此外,太湖西南部水域S1类群生物量较高,该类群中丝状蓝藻的危害不容忽视. 假鱼腥藻属和浮丝藻属可以产生2-甲基异茨醇(2-MIB),其在极低剂量下(10 ng/L)就会使水体产生土腥气味,对供水有较大影响[49]. 2021年8月中旬,太湖部分水源地及上海金泽水库出现大量湖生假鱼腥藻(附图Ⅴ),细胞密度达到1×108cells/L,2-甲基异茨醇(2-MIB)的浓度超过1000 ng/L(未公开发表). 上海市水务集团和江苏省生态环境厅启动应急监测和预警,采取提升水位、提浊降光、加大流量降低风险区水龄等原位抑藻控嗅措施,同时紧急升级活性炭吸附和臭氧处理措施,成功应对此事件. 这很好地体现了针对不同水体类型和不同功能类群应采取因地制宜的管控模式.
4 结论
本研究揭示了太湖流域浮游植物功能类群的地理分布格局. 在太湖流域丰水期共划分31个功能类群,15个优势类群,其分布具有一定的空间异质性. 以太湖为中心向外形成3个聚类组,内是以M、S1类群为主的湖泊组,中是以M、S1、P、J类群为主的与湖泊密切相连的河流组,外是以P、S1、J、D、C类群为主的河流和水库组. 在涵盖4种类型水体的太湖流域,空间因子和环境因子均能单独解释浮游植物功能类群的变化,但空间因子影响更大. 在较小的局部区域,浮游植物功能类群的变化主要由环境因子解释. 优势功能类群多为适宜富营养或混合浑浊生境的物种,说明太湖流域仍然存在富营养化问题. 湖泊中M、S1类群生物量占52.6%,说明夏季湖泊依然面临蓝藻水华问题. 因此,在进行流域水生态管理时,应同时考虑空间和环境因素,尤其是针对不同水体类型和浮游植物功能类群开展因地制宜的管控模式.
致谢:本文采样点地图绘制得到江苏省无锡环境监测中心徐源的帮助,R语言的使用及数据分析得到江苏宏众百德生物科技有限公司张佩佩,及哈尔滨师范大学贾鹏、李祯祥等的指导,在此表示衷心感谢.
5 附录
附表Ⅰ和附图Ⅰ~Ⅴ见电子版(DOI: 10.18307/2022.0506).

