miR-21在心血管疾病中作用的研究进展
马明仁,焦丕奇,王 菲,刘 燕,宋 佳,弓 宵,马 凌 解放军联勤保障部队第九四〇医院 心血管内科,甘肃兰州 730050; 西北民族大学 医学部,甘肃兰州 730000
全球每年因心血管疾病(cardiovascular disease,CVD)死亡的人数约占疾病死亡总数的31.5%,约是癌症死亡人数的2倍[1]。CVD已成为严重影响公共卫生的重要问题[2]。常见CVD主要包括急性心肌梗死 (acute myocardial infarction,AMI)、扩张性心肌病 (dilated cardiomyopathy,DCM)、心力衰竭 (heart failure,HF)、肺动脉高压 (pulmonary arterial hypertension,PAH) 和心房颤动 (atrial fibrillation,AF)等[3]。近年来CVD的发病率虽然得到了一定控制,但仍需全面阐明发病机制以制订更加简捷、快速、有效的防控和诊疗措施。微RNA(miRNA/miR)是进化上保守的一类长度为18~25个核苷酸的非编码RNA(non-coding RNA,ncRNA),其中miR-21是较早发现且被广泛关注的miRNA之一[4]。大量研究佐证了miR-21与CVD密切相关,但其复杂调控网络尚未阐明,极大地限制miR-21在临床上推广应用。鉴于此,本文聚焦miR-21与CVD的相关性,梳理汇总当前研究进展,以期为miR-21在CVD中的相关研究和临床应用提供新思路。
1 miR-21概述
miR-21编码基因定位于染色体17q23.2区域的空泡膜蛋白1基因座内[5],具有5'-UAG CUUAUCAGACUGAU-3'保守序列,是长度为22个核苷酸的ncRNA。miR-21序列中鉴定出了保守增强子元件,包括激活蛋白1、Ets家族转录因子PU.1、CCAAT/增强子结合蛋白-α、核因子I、血清反应元件、p53、信号转导与转录激活因子3。miR-21是机体表达最丰富的miRNA,在大多数细胞中存在, 在CVD、肿瘤和炎症诱导疾病中均能观察到miR-21表达变化,也有研究证实miR-21参与调节各种免疫、发育和中枢神经系统疾病进展[6]。细胞特异性研究表明miR-21在巨噬细胞、单核细胞和树突状细胞中表达水平最高[7],miR-21在所有心血管细胞中均有分布,在心肌成纤维细胞(cardiac fibroblast,CF)中的表达水平明显高于心肌细胞[8]。miR-21的分布特性使其容易在血浆、血清等体液中被鉴定,因此也成为CVD特异性诊疗靶点最佳研究对象。
2 miR-21与心肌细胞凋亡
心肌细胞为了更好地适应环境会启动自身程序性细胞凋亡,这种凋亡受到机体的严密监控,miRNA在其中扮演重要的“监控”职责。miR-21作为心肌细胞丰富表达的miRNA,在抑制心肌细胞凋亡中发挥关键调控作用。早期动物实验表明大鼠心肌梗死 (myocardial infarction,MI)区域与梗死边缘区域miR-21差异表达,上调miR-21表达后MI面积减少29%,表明miR-21对心肌细胞具有抗凋亡和修复作用[9]。Song等[10]同样验证了miR-21在MI中抑制心肌细胞凋亡、改善心脏功能的关键调控作用。心肌细胞对缺氧极为敏感,miRNA测序研究缺氧应激对大鼠心肌细胞(H9C2)及其相应外泌体的影响发现,低氧诱导的外泌体miRNA (包括 miR-21-5p、miR-378-3p、miR-152-3p和let-7i-5p)具有潜在抗心肌细胞凋亡作用[11]。Gu等[12]研究证实血清来源的细胞外囊泡(extracellular vesicle,EV)显著减少AMI细胞模型和AMI小鼠模型的心肌细胞凋亡,并减轻AMI小鼠心脏梗死面积,AMI后小鼠心脏中miR-21表达与血清EV呈负相关,miR-21可降低血清EV抑制心肌细胞凋亡的作用,血清EV通过调节miR-21/PDCD4信号通路保护AMI。Hinkel等[13]在猪的MI和HF模型中发现miR-21在左心室心肌的远端和边缘区逐渐上调,这与miR-21发挥抗心肌细胞凋亡作用密切相关。Zhang等[14]探讨了miR-21介导的成纤维细胞生长因子 1(fibroblast growth factor 1,FGF1)对冠状动脉粥样硬化性心肌病(coronary atherosclerotic heart disease,CHD)大鼠心肌缺血的保护作用,发现miR-21可特异性介导FGF1表达,从而减轻心肌缺血/再灌注(ischemia-reperfusion,I/R)损伤,发挥抗心肌细胞凋亡和保护心脏的功能。大量研究已证实红景天苷对心肌损伤、心肌缺氧和I/R损伤具有保护作用,Liu等[15]研究数据表明红景天苷预处理逆转了缺氧/复氧(hypoxia/reoxygenation,H/R)诱导的miR-21下调,减弱心肌细胞毒性和凋亡,抑制了心肌I/R损伤,miR-21有助于红景天苷对H9C2细胞中H/R诱导的氧化应激的保护作用。Huang等[16]也验证了在H/R损伤期间H9C2细胞中miR-21表达下调自噬显著增加,miR-21及其前体的过表达可通过激活AKT/mTOR通路,抑制自噬活性并减少细胞凋亡。研究发现miR-21在缺血后处理(ischemic postconditioning,IPost)小鼠心脏中显著上调,IPost可以减少I/R损伤引起的左心室梗死面积,改善心脏功能,抑制心肌细胞凋亡,敲低miR-21可以逆转IPost对小鼠I/R损伤的保护,miR-21通过PTEN/Akt信号通路在心肌细胞凋亡中发挥保护作用[17]。转染miR-21模拟短发夹RNA(short hairpin RNA,shRNA)的人心肌细胞凋亡率明显下降,这与下调p-JNK、p-p38 MARK和Caspase-3的蛋白表达有关,表明miR-21通过激活JNK/p-38 MARK/Caspase-3信号通路抑制肿瘤坏死因子-α诱导的凋亡[18]。
3 miR-21与CVD相关脂类代谢
脂质代谢紊乱是CVD的重要风险因素之一,已证实miRNA能够在多个器官中调节脂类代谢,改变机体低密度脂蛋白 (low density lipoprotein,LDL)和 高 密度 脂蛋白 (high density lipoprotein,HDL)的含量从而参与CVD进程,是脂质稳态的重要调节因子。心血管相关病变是慢性肾脏病(chronic kidney disease,CKD) 患者死亡的主要原因,Surina等[19]描述了5/6肾切除大鼠CKD模型的左心室病理学特征,发现miR-21-5p在左心室表达上调,并证实miR-21-5p通过靶向PPARα改变许多与脂肪酸氧化和糖酵解相关的转录物的表达,在H9C2细胞中进一步研究发现miR-21-5p的过表达减弱了H9C2细胞中的脂质含量和脂质过氧化,对糖酵解和脂肪酸氧化途径的依赖可通过细胞内miR-21-5p的丰度来调节。长链非编码 RNA(long noncoding RNA,LncRNA)GAS5 及其靶miR-21调节血脂、巨噬细胞、Th细胞、血管平滑肌细胞,参与动脉粥样硬化(atherosclerosis ,AS)及相关CHD发生发展,Jiang和Du[20]进一步探讨其循环表达与CHD患者常见生化指标、狭窄严重程度、细胞因子的相关性,发现Lnc-GAS5与CHD患者的miR-21水平呈负相关,循环中的Lnc-GAS5及其靶miR-21有望作为治疗CHD潜在靶点。氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导的血管内皮损伤、氧化应激和炎症反应在AS的病理生理中起着至关重要的作用。miR-21可介导CASC7许多病理生理机制,Pei等[21]采用ox-LDL刺激HUVEC和VSMC来建立AS体外模型检测CASC7水平,分析CASC7/miR-21轴中 TLR4/NF-κB 和 PI3K/AKT 通路的潜在功能,结果表明LncRNA-CASC7通过抑制miR-21表达,调节TLR4/NF-κB和PI3K/AKT信号通路,影响ox-LDL诱导的AS细胞模型病理进展。Feng等[22]也证实不同剂量和次数的脂多糖刺激巨噬细胞后,miR-21通过TLR4-NF-κB途径负调节脂多糖诱导的巨噬细胞脂质积累和炎症反应,表明过表达miR-21可作为预防和治疗AS疾病新方案。诸多研究证据表明miR-21与脂类代谢密切相关,而脂类代谢异常又是CVD重要危险因素,尤其是在CHD病理进程中。因此,阐明miR-21与CVD相关脂类代谢机制或许会为CVD诊疗提供更多可行方案。
4 miR-21与心肌纤维化
心肌纤维化是心脏重塑中的重要事件,包括成纤维细胞激活和细胞外基质(extracellular matrix,ECM)过度产生[23],CF向肌成纤维细胞转化是纤维化的关键机制。ECM由多种结构蛋白、基质细胞分子、蛋白聚糖、乙酰透明质酸以及各种糖蛋白组成,它们相互协作和连接以产生生物活性聚合物。研究表明ncRNA(miR-19、miR-21、miR-26、miR-29、miR-30、miR-133、miR-140等)在与 ECM破坏或分解相关的疾病(如心/肺纤维化、心肌病、骨关节病和癌症等)中表达失调,ncRNA在调节ECM构象、改变位于该环境中细胞表型方面发挥重要调控作用[24]。转化生长因子-β(transforming growth factor-β,TGF-β)诱导 miR-21 表达,TGF-β信号转导的SMAD效应子与DROSHA相互作用以促进初级miR-21加工成前体miR-21(pre-miR-21),TGF-β/Smad2/3依赖或非依赖性通路是心肌纤维化发病机制中的主要信号分子核心[25]。Yuan等[26]发现miR-21在体内MI后梗死区表达上调,生物信息学、蛋白质印迹分析和荧光素酶报告基因检测表明Smad7是miR-21直接靶标,miR-21过表达促进了TGF-β1诱导的CF激活,miR-21通过 TGF-β/ Smad7 信号通路在 MI后 CF 激活和心脏纤维化过程中起关键作用。另一项研究也表明miR-21通过靶向Jagged1和SMAD7介导TGF-β引起的成纤维细胞活化。心脏巨噬细胞(cardiac macrophage,cMP)是心肌稳态和疾病的重要调节因子,RNA测序显示miR-21是cMP中表达最高的miRNA。Ramanujam等[27]探讨巨噬细胞miR-21在心肌稳态和疾病相关重塑中的功能,发现cMP在压力超负荷的心脏纤维化和功能障碍中起重要作用,并揭示巨噬细胞miR-21是cMP促纤维化作用的关键分子。心脏纤维化是糖尿病性心肌病的主要特征之一,表现为心脏细胞外基质蛋白的过度积累。miR-21、miR-150-5p、miR-155、miR-451等在糖尿病患者心脏中上调,并通过靶向CF、内皮细胞和心肌细胞中的信号通路促进心脏纤维化[28]。心肌纤维化是CVD发生发展的主要病理表现,miR-21在其中发挥的重要调控作用毋庸置疑,其表达水平与组织纤维化程度密切相关,虽然miR-21在细胞研究模型中被证实具有促纤维化作用,但能否将其作为诊疗心肌纤维化相关疾病的特异性靶点有待更多研究佐证。
5 结语
本文以心肌细胞凋亡、脂类代谢异常、心肌纤维化为切入点总结了miR-21与CVD的最新研究进展。miR-21在CVD中发挥的关键调控作用已有大量研究报道(表1),通过文献总结发现当前对于miR-21在CVD中的相关研究大多停留在生物信息预测、细胞和动物模型验证水平,尚未全面系统反映miR-21在机体内发挥的整体调控作用,限制了其在临床上的推广应用。心肌细胞内部凋亡信号通路的复杂性使得miR-21在调控心肌细胞凋亡方面存在差异性。已有实验数据证实miR-21在心肌细胞中起到抗凋亡作用,而在另外一些细胞类型中发挥促凋亡作用,对此现象合理的解释是miR-21具有多个靶基因,靶基因也同时受到多个miRNA调控,miR-21在心肌细胞凋亡中只是一个节点,其复杂的调控机制尚未阐明。miR-21是协同指数最高的miRNA,其在高协同miRNA对中频繁出现,如miR-21与miR-1协同在抗心肌细胞凋亡方面作用显著,miR-21与miR-146协同调节p38-Caspase3信号通路发挥抗心肌细胞凋亡作用[40]。miR-21在脂类代谢异常中发挥的关键调控作用已被证实,也有研究报道miR-21抑制冠心病炎症过程的同时参与冠状动脉斑块形成,导致斑块不稳定性增加,miR-21参与CVD调控具有复杂性和两面性。miR-21无疑是心肌纤维化领域的明星分子,但当前研究主要集中于miR-21对心肌纤维化病理性进程调控,而忽略了miR-21如何调节CF的生理功能,今后有待深入研究以更加系统地阐明miR-21调控心肌纤维化机制。
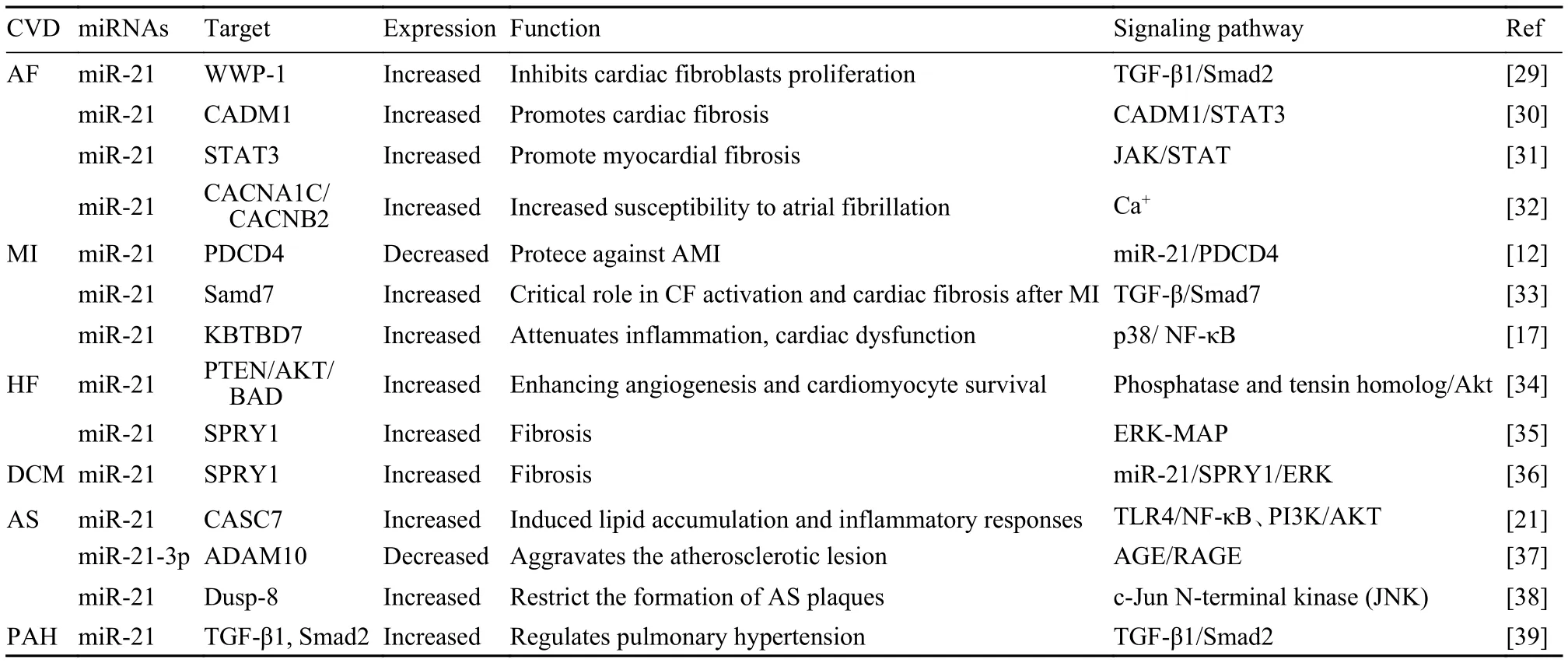
表1 miR-21在CVD中的靶点、表达、作用和信号通路Tab.1 The target, expression, role and signaling pathway of miR-21 in CVD
miR-21在CVD事件发生、发展中的关键调控作用已有大量研究证据佐证,但应用在临床还存在诸多问题,例如miR-21是组织高表达的miRNAs,其作为CVD生物标志物的特异性如何?实现临床转化用于治疗CVD,miR-21在体内安全性如何评价,是否会产生毒性不良反应仍然未知。此外,miR-21在CVD相关疾病中往往会呈现动态变化表达,不同病理时期其表达会发生相应变化,对于此变化临床应用后该如何监测[41]?这些问题有待于深入开展临床研究以逐步解决。

