阻塞性睡眠呼吸暂停合并肥胖相关睡眠低通气的影响因素和预测指标分析
王乐,陈杏,梁茂丽,张静,王彦,陈宝元,曹洁
肥胖低通气综合征(OHS)是病态肥胖的严重并发症。除外其他疾病引起的高碳酸血症,若同时满足体质量指数(BMI)≥30 kg/m2和清醒时动脉血二氧化碳分压[p(CO2)]≥45 mmHg(1 mmHg=0.133 kPa)即可诊断为OHS[1]。根据目前的诊断标准,OHS仅包括存在日间高碳酸血症的肥胖人群。然而有研究提出存在单纯夜间低通气而无日间高碳酸血症的肥胖人群可能是OHS的早期人群,最终也可进展为OHS[2-3]。欧洲呼吸学会(ERS)工作组也提出肥胖相关低通气疾病主要分为5类:0类,单纯阻塞性睡眠呼吸暂停(OSA),不伴有夜间睡眠低通气和日间高碳酸血症;Ⅰ类和Ⅱ类,肥胖相关睡眠低通气(ORSH),合并或不合并OSA,伴有夜间睡眠低通气而不伴有日间高碳酸血症;Ⅲ类和Ⅳ类,即OHS,合并或不合并OSA,伴有日间高碳酸血症[p(CO2)≥45 mmHg)][4]。据报道超过80%的OHS患者合并严重的OSA[4]。与单纯OSA相比,OHS患者合并症较多,致残率和病死率高[5-6]。早期识别ORSH人群,并及时采取有效的治疗手段对延缓甚至逆转其进展为更严重的OHS非常必要,但目前关于ORSH人群的研究较少见。本研究旨在分析OSA合并ORSH人群的临床特征和OSA合并ORSH的影响因素,探究预测OSA合并ORSH的指标,为临床诊治提供参考。
1 对象与方法
1.1 研究对象 纳入2019年1月—2021年12月因打鼾就诊于天津医科大学总医院呼吸与危重症医学科的患者。排除标准:(1)年龄<18岁。(2)BMI<30 kg/m2。(3)合并引起高碳酸血症的其他疾病,如神经系统疾病、骨骼肌肉疾病、阻塞性肺部或气道疾病等。(4)非OSA[呼吸暂停低通气指数(AHI)<5次/h]患者。(5)肺功能第1秒用力呼气容积(FEV1)/用力肺活量(FVC)≤70%。(6)临床资料不完整。按上述标准,最终纳入研究对象185例,其中男130例(70.3%),女55例(29.7%),年龄18~79岁,平均(45.24±12.93)岁。本研究经我院伦理委员会批准(IRB2021-WZ-068),所有程序均按照《赫尔辛基宣言》(2013年修订版)进行,所有受试者均签署知情同意书。
1.2 一般临床资料收集 所有患者均由医护人员测量身高、体质量、颈围、腰围,询问吸烟、饮酒、高血压、冠心病、糖尿病、脑卒中等相关病史并详细记录,计算BMI。
1.3 动脉血气分析 所有患者均进行白天清醒状态下动脉血气分析,采血前平静休息20 min,由专业人员按照操作标准由桡动脉穿刺取血,并于10 min内完成检测。检测指标包括氢离子浓度指数(pH值)、碳酸氢根离子(HCO3-)、动脉血氧分压[p(O2)]、p(CO2),p(CO2)≥45 mmHg表示有CO2潴留。
1.4 肺功能检查 由专业技术人员使用德国耶格MasterScreen肺功能仪对所有患者进行肺功能检查,检测指标包括第1秒用力呼气容积占预计值百分比(FEV1%)、用力肺活量占预计值百分比(FVC%)。
1.5 多导睡眠监测(PSG)所有患者均进行不少于7 h的睡眠监测(美国飞利浦Alice 5多导睡眠监测系统),记录患者睡眠监测过程中的脑电、心电、肌电信号,口鼻气流、胸腹运动、鼾声、体位、血氧饱和度变化情况。纳入的PSG指标包括Epworth嗜睡量表评分(ESS)、AHI、氧减指数(ODI)、微觉醒指数(MAI)、呼吸暂停指数(AI)、平均呼吸暂停时间(MAT)、最长呼吸暂停时间(LAT)、低通气指数(HI)、平均低通气时间(MHT)、最长低通气时间(LHT)、最低血氧饱和度(minSpO2)、平均血氧饱和度(meanSpO2)、血氧饱和度小于0.90的时间占总时间的百分比(T90)。所有监测结果由2位专业睡眠医师根据标准进行判读,呼吸暂停定义为口鼻气流暂停或明显减弱,持续时间≥10 s;低通气定义为口鼻气流较基础水平下降超过30%,同时伴有微觉醒或(和)血氧饱和度下降≥3%[7]。根据PSG结果,如果患者诊断为中重度OSA,即AHI>15次/h,则首先接受持续气道正压通气(CPAP)呼吸机模式,若不能达到理想治疗效果,则改为双水平气道正压通气(BI-PAP)呼吸机模式[8]。
1.6 经皮二氧化碳(TcCO2)监测 所有受试者PSG监测的同时进行TcCO2测定(丹麦雷度TCM4经皮CO2监护仪)。睡眠低通气(SH)诊断标准:成人睡眠期TcCO2上升至>55 mmHg并持续超过10 min,或与清醒期仰卧位相比TcCO2上升幅度>10 mmHg,达50 mmHg以上且持续超过10 min[9]。
1.7 分组 根据PSG、动脉血气、TcCO2监测结果,将患者分为3组,单纯OSA组(109例):AHI≥5次/h,p(CO2)<45 mmHg,TcCO2不符合夜间SH诊断标准;OSA合并ORSH组(46例):AHI≥5次/h,p(CO2)<45 mmHg,TcCO2符合夜间SH诊断标准;OSA合并OHS组(30例):AHI≥5次/h,p(CO2)≥45 mmHg。
1.8 统计学方法 采用SPSS 25.0软件进行数据分析,正态分布的计量资料用±s表示,非正态分布计量资料用M(P25,P75)表示,计数资料用例(%)表示。多组间计量资料比较采用单因素方差分析(One-way ANOVA)或Kruskal-Wallis检验,计数资料采用χ2检验,组间多重比较采用Bonferroni事后检验;多因素Logistic回归分析OSA合并ORSH的影响因素并建立模型;受试者工作特征(ROC)曲线分析其预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者一般资料比较 与单纯OSA和OSA合并ORSH组相比,OSA合并OHS组的腰围、BMI、脑卒中患者比例显著升高(P<0.05),而3组间性别、年龄、颈围、吸烟史、饮酒史、高血压、冠心病、糖尿病患者比例差异无统计学意义,见表1。
2.2 3组患者动脉血气分析比较 OSA合并OHS组的p(O2)显著低于单纯OSA组,而p(CO2)、HCO3-显著高于单纯OSA组和OSA合并ORSH组(P<0.05);与单纯OSA组比较,OSA合并ORSH组的p(CO2)和HCO3-显著增高(P<0.05),而p(O2)差异无统计学意义;3组间pH值差异无统计学意义,见表2。
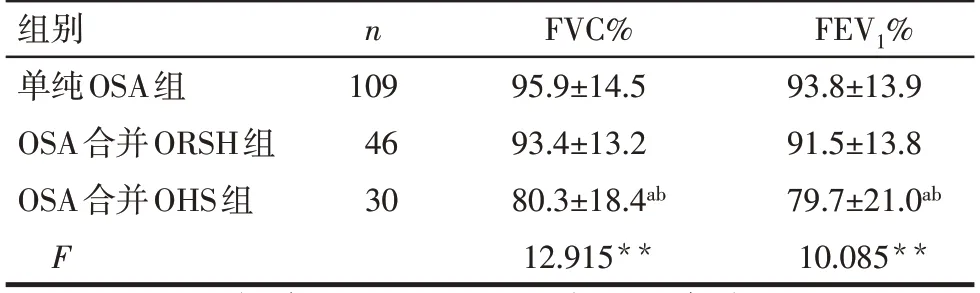
2.3 3组患者肺功能比较 OSA合并OHS组的FVC%、FEV1%显著低于单纯OSA组和OSA合并ORSH组(P<0.05),单纯OSA组和OSA合并ORSH组间FVC%、FEV1%差异无统计学意义,见表3。

Tab.1 Comparison of basic data between the three groups of patients表1 3组患者一般资料比较
Tab.2 Comparison of arterial blood gases between the three groups of patients表2 3组患者动脉血气分析比较 (±s)

Tab.2 Comparison of arterial blood gases between the three groups of patients表2 3组患者动脉血气分析比较 (±s)
**P<0.01;a与单纯OSA组相比,b与OSA合并ORSH组相比,P<0.05。
组别单纯OSA组OSA合并ORSH组OSA合并OHS组F n 109 46 30 pH值7.41±0.02 7.41±0.02 7.39±0.03 5.477 p(O2)(mmHg)75.43±9.24 73.20±7.82 68.90±8.51a 6.567**组别单纯OSA组OSA合并ORSH组OSA合并OHS组F p(CO2)(mmHg)39.86±2.89 41.57±2.34a 50.60±10.24ab 59.296**HCO3-(mmol/L)24.53±1.87 25.60±1.67a 31.86±12.42ab 23.261**
2.4 3组患者PSG指标的比较 与单纯OSA组比较,OSA合并OHS组ESS升高,OSA合并ORSH组和OSA合并OHS组的ODI、AHI、MAI、AI、MAT、LAT、T90和BI-PAP模式呼吸机治疗比例均升高,而minSpO2和meanSpO2均降低(P<0.05)。与OSA合并ORSH组比较,OSA合并OHS组CPAP模式治疗比例降低,BI-PAP模式治疗比例升高(P<0.05),见表4。
Tab.3 Comparison of lung function between the three groups of patients表3 3组患者肺功能比较 (±s)
Tab.3 Comparison of lung function between the three groups of patients表3 3组患者肺功能比较 (±s)
**P<0.01;a与单纯OSA组相比,b与OSA合并ORSH组相比,P<0.05。
n 组别单纯OSA组OSA合并ORSH组OSA合并OHS组F 109 46 30 FVC%95.9±14.5 93.4±13.2 80.3±18.4ab 12.915**FEV1%93.8±13.9 91.5±13.8 79.7±21.0ab 10.085**
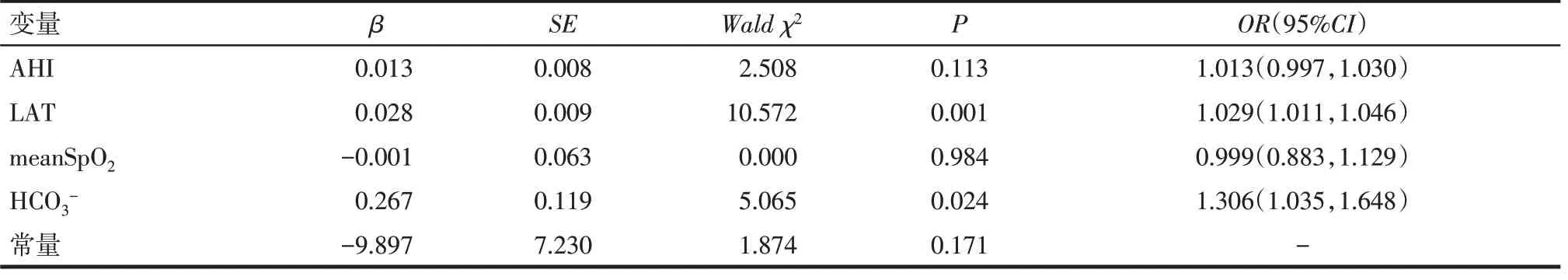
2.5 OSA合并ORSH的影响因素分析 以OSA是否合并ORSH为因变量(不合并ORSH单纯OSA=0,合 并ORSH=1),临 床 较 为 常 用 的AHI、LAT、meanSpO2和HCO3-为自变量,Logistic回归分析显示LAT延长和HCO3-升高是OSA合并ORSH的独立危险因素,见表5。
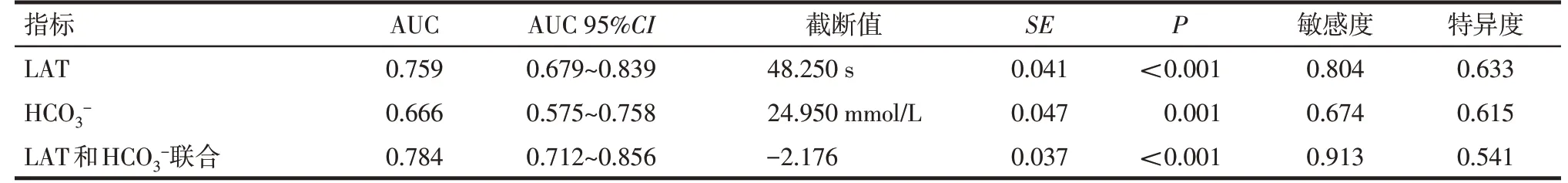
2.6 LAT、HCO3-水平对OSA合并ORSH的预测效能 Logistic回归建立的LAT、HCO3-联合预测模型为logit(P)=-9.897+0.028×LAT+0.267×HCO3-。LAT和HCO3-联合检测时ROC曲线下面积(AUC)最大为0.784,见表6,图1。

Tab.4 Comparison of PSG indexes between the three groups of patients表4 3组PSG指标比较
Tab.5 Multiple-factor Logistic regression analysis of factors affecting ORSH in patients with OSA表5 OSA合并ORSH危险因素的多因素Logistic回归分析
Tab.6 The predictive efficiency of LAT and HCO3-levels analyzed by ROC for OSA patients combined with ORSH表6 ROC分析LAT和HCO3-水平对OSA合并ORSH的预测效能
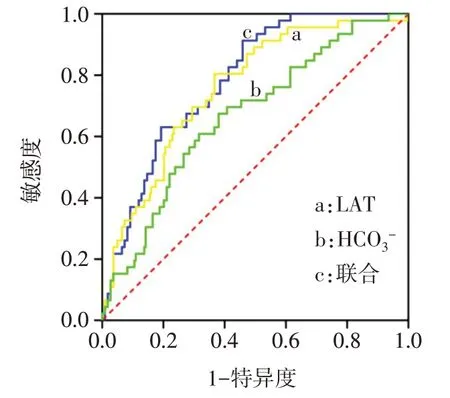
Fig.1 ROC curves of LAT and HCO3-levels for predicting OSA combined with ORSH图1 LAT和HCO3-预测OSA合并ORSH的ROC曲线
3 讨论
肥胖已成为全球性公共健康问题,我国约46%的成人和15%的儿童存在肥胖或超重[10]。肥胖导致上气道阻力升高,呼吸系统负荷增加,呼吸中枢驱动减弱,容易出现SH[11]。OHS是病态肥胖的常见并发症之一,其危害性大,致病率和致死率高,在未治疗的患者中,18个月的病死率高达23%,所以早期诊治极为重要[12]。
根据ERS提出的关于肥胖低通气疾病的新分类标准,本研究将受试者分为单纯OSA组、OSA合并ORSH组和OSA合并OHS组3组,占比分别为58.9%、24.9%和16.2%。既往有3项研究使用了此分类标准,澳大利亚的一项肥胖人群研究(BMI>40 kg/m2)显示单纯OSA、OSA合并ORSH和OSA合并OHS的比例分别为61%、19%和17%[13];印度的一项针对肥胖人群(BMI>30 kg/m2)研究发现单纯OSA、OSA合并ORSH和OSA合并OHS的比例分别为64.8%、23.4%和11.8%[11];法国的一项研究显示29.2%的肥胖(BMI≥40 kg/m2)人群罹患ORSH[14]。由于纳入标准和研究人群的不同,患病比例虽略有差异,但不能忽视的是根据现有诊断标准,确有部分OHS高风险人群即日间p(CO2)正常而存在夜间睡眠低通气者被忽略。在本研究中,3组间性别比例、年龄、颈围、吸烟、饮酒史等一般临床指标差异无统计学意义;OSA合并OHS组的FVC%和FEV1%低于单纯OSA和OSA合并ORSH组;OSA合并ORSH和OSA合并OHS组PSG指标如ODI、AHI、AI、MAT、LAT、T90均高于单纯OSA组,minSpO2和meanSpO2低于单纯OSA组,而OSA合并ORSH组和OSA合并OHS组间差异无统计学意义,与既往研究[11,13]结果一致。此外,本研究中10.8%的ORSH组患者CPAP呼吸机治疗失败,需要使用BI-PAP呼吸机,这一比例在单纯OSA组和OSA合并OHS组分别为4.5%和33.3%。既往研究发现单纯OSA、OSA合并ORSH和OSA合并OHS患者CPAP呼吸机治疗失败并使用BI-PAP呼吸机的比率分别为9%、53.3%和66.6%[11]。OHS合并症多、危害性大,甚至在明确诊断前即出现多种严重的并发症[6]。本研究中OSA合并OHS组并发脑卒中的比例明显高于单纯OSA组和OSA合并ORSH组,而3组间高血压、糖尿病、冠心病比例差异无统计学意义。Goyal等[11]发现单纯OSA、OSA合并ORSH和OSA合并OHS组间心脑血管疾病和糖尿病比例差异无统计学意义。这可能是研究中OSA合并ORSH组和OSA合并OHS组样本量偏小所致。上述研究结果表明OSA合并ORSH的病情较单纯OSA严重,应该得到足够的重视。
Tc CO2监测是反映患者睡眠中p(CO2)变化最直接的方法,但其监测过程中需要频繁校准且价格昂贵[11]。为探究能预测OSA合并ORSH的简易指标,本研究采用Logistic回归分析发现LAT延长和HCO3-升高是OSA合并ORSH的独立危险因素。OSA患者夜间睡眠时反复出现间断的呼吸暂停和(或)低通气,呼吸暂停时间越长,肺活量降低和功能残气量减少越明显,肺通气/血流比例失调越严重,导致CO2潴留,引起高碳酸血症。既往多项研究表明OSA患者睡眠中p(CO2)变化与AHI无相关性,而与呼吸暂停时间、呼吸暂停间隔时间和呼吸暂停与间隔时间的比值明显相关[15-17]。日常动脉血气采血检测p(CO2)过程中,患者可能因疼痛而过度换气,造成假性p(CO2)正常。而HCO3-因p(CO2)升高而代偿性升高,且肾脏调节HCO3-所需的时间较肺脏调节CO2的时间长,所以可出现p(CO2)在正常范围而HCO3-升高的现象。故部分研究提出HCO3->27 mmol/L对于预测OHS有较高的敏感度和特异度[18-19]。本研究结果表明LAT和HCO3-对OSA合并ORSH有较好的预测效能,且2项指标联合检测的预测价值优于其单独预测。本研究存在一定局限性,一是由于夜间TcCO2监测不是常规检查,排除临床资料不全的患者后,样本量偏小,在今后的研究中尚需进一步扩大样本量;二是本研究为单中心回顾性研究,今后需进行多中心人群验证。
综上所述,OSA合并ORSH的病情较单纯OSA严重,LAT延长和HCO3-升高对OSA合并ORSH人群有较好的预测价值,根据预测模型,当LAT和HCO3-的联合指标≥-2.176时,建议行夜间TcCO2监测,尽早诊治可逆转ORSH向OHS转变,延缓病程,提高患者生活质量,降低病死率。

