抑制miR-33表达对急性呼吸窘迫综合征大鼠肺纤维化的影响及机制研究
龙光文,张谦,杨秀林,吉春玲,董裕康
急性呼吸窘迫综合征(ARDS)是急性肺损伤(ALI)较为严重的临床表现,常伴有炎症反应、肺纤维化和肺功能降低,其中肺纤维化是导致ARDS发病和死亡的主要原因[1]。ARDS的治疗方式主要有机械通气、肺水清除与液体管理等[2-3],但这些支持性治疗并不能逆转ARDS的病理生理过程,且目前仍然无有效的治疗药物。有研究发现,转化生长因子(TGF)-β1/Smad信号通路在ARDS肺纤维化中发挥着重要作用[4]。TGF-β1通过激活下游Smad信号通路促进肺成纤维细胞过度增殖和分化,进而促进胶原等细胞外基质在肺间质和肺泡细胞过度积累,导致肺纤维化发生和发展[5]。Hu等[6]发现抑制TGF-β1/Smad通路可减轻ARDS肺纤维化的炎症反应,是改善ARDS肺纤维化的有效措施。miR-33是一种高度保守的miRNA,可调节脂质代谢和炎症反应,同时促进组织纤维化[7-8]。Nishiga等[9]发现,抑制miR-33表达可抑制心肌成纤维细胞的增殖,进而抑制心肌纤维化。然而,miR-33是否通过调控TGF-β1/Smad信号通路参与ARDS肺纤维化过程目前尚不明确。本研究采用脂多糖(LPS)颈部气管滴注构建ARDS模型,探讨抑制miR-33表达对ARDS大鼠肺纤维化的影响及其可能作用机制,以期为ARDS提供潜在的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 60只SPF级雄性SD大鼠,6周龄,体质量190~210 g,购于西南医科大学动物实验中心,动物生产许可证号SYSK(川)2018-065。所有大鼠均在12 h昼夜循环,温度(24±2)℃和湿度45%~55%的环境下饲养,正常给予食物和水。
1.1.2 主要试剂与仪器 miR-33 antagomir及其阴性对照(antagomir-NC)购自上海GenePharma公司;LPS购自上海阿拉丁试剂有限公司;兔抗TGF-β1、Smad2、磷酸化Smad2(p-Smad2)、Smad3、磷酸化Smad3(p-Smad3)、α-平滑肌肌动蛋白(α-SMA)、GAPDH及辣根过氧化物酶(HRP)标记山羊抗兔IgG(H+L)抗体均购自英国Abcam公司;Masson染色试剂盒购自南京建成生物工程研究所;白细胞介素(IL)-1β、IL-6和肿瘤坏死因子(TNF)-α酶联免疫吸附试验(ELISA)试剂盒均购自上海生工生物工程股份有限公司;miRcute miRNA提取分离试剂盒购自北京天根生化科技有限公司;RT2miRNA First Strand Kit(331401)购自美国SABiosciences公司;GoTaq qPCR Master Mix试剂盒购自美国Promega公司;iScript cDNA Synthesis和SYBR Green试剂盒均购自美国BIO-RAD公司;羟脯氨酸(Hyp)含量检测试剂盒购自北京索莱宝科技有限公司;PT1000血气分析仪购自武汉明德生物科技股份有限公司;化学发光凝胶成像系统和实时荧光定量PCR(qPCR)仪器均购自美国BIO-RAD公司;光学显微镜购自日本Nikon公司。
1.2 方法
1.2.1 动物模型制备与分组 采用随机数字表法将60只大鼠分成假手术组(Sham组)、ARDS模型组(Model组)、antagomir阴性对照组(antagomir-NC组)和miR-33 antagomir组(antagomir组),每组15只。除Sham组外,其他组大鼠均通过颈部气管滴注10 mg/kg LPS建立ARDS模型[10],而Sham组经颈部气管滴注同体积的生理盐水。若造模大鼠出现食欲下降,精神萎靡,呼吸急促等症状且氧合指数(OI)<200 mmHg(1 mmHg=0.133 kPa),说明ARDS模型构建成功,剔除不成功大鼠并及时补充。造模成功后,antagomir-NC组和antagomir组大鼠分别经尾静脉注射80 nmol脂质体包被的antagomir-NC和miR-33 antagomir,注射体积为200μL,而Sham组和Model组大鼠经尾静脉注射等量的生理盐水,1次/周,干预2周后处死大鼠,取材检测。
1.2.2 动脉血氧分压[p(O2)]及OI检测 充分麻醉大鼠后,打开腹腔,暴露腹主动脉,用含肝素钠的注射器抽取1 mL主动脉血,采用血气测定试剂盒和PT1000血气分析仪检测p(O2)和OI,OI=p(O2)/吸入气中的氧浓度分数(FiO2)。
1.2.3 HE及Masson染色 处死大鼠后取肺组织,用生理盐水冲洗,置于10%福尔马林溶液中固定,石蜡包埋,制成约3μm厚的切片,分别进行HE和Masson染色,二甲苯透明,中性树脂封片,在光学显微镜下观察肺组织病理学变化和纤维化程度,其中Masson染色中胶原纤维显示为蓝色。
1.2.4 碱性水解法检测Hyp含量 取适量肺组织,用生理盐水冲洗后,加入适量的6 mol/L盐酸于100℃下水解5 h,再按照Hyp检测试剂盒操作说明测定Hyp含量。
1.2.5 ELISA检测炎性因子水平 处死大鼠后,打开胸腔并结扎肺组织肺门,颈部气管做“V”型切口后放入静脉留置针套管,用500μL的0.9%NaCl溶液反复灌洗支气管肺泡3次,收集肺泡灌洗液(BALF),4℃,3 000×g离心10 min,取上清液,按照ELISA试剂盒操作说明测定BALF中IL-1β、IL-6和TNF-α炎性因子水平。
1.2.6 qPCR检测miR-33及TGF-β1、胶原(Collagen)Ⅰ和CollagenⅢmRNA水平 采用miRNA提取分离试剂盒提取肺组织中的miRNA,Trizol法提取总RNA,分别取2.0μg进行逆转录反应,以cDNA为模板进行qPCR反应。引物均由上海生工生物工程股份有限公司合成,见表1。采用20μL反应体系,95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,30个循环。miR-33以U6为内参对照,TGF-β1、CollagenⅠ、CollagenⅢmRNA均以GAPDH为内参对照,采用2-ΔΔCt法计算各基因的相对表达水平。

Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.2.7 Western blot检测肺组织中TGF-β1、Smad2、p-Smad2、Smad3、p-Smad3、α-SMA蛋白表达水平 使用含有蛋白酶抑制剂的RIPA裂解缓冲液处理肺组织提取总蛋白,用BCA蛋白分析试剂盒进行蛋白定量。将等量的蛋白质加载到12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上,然后通过湿转法转移到聚偏氟乙烯膜上,将膜放入5%脱脂奶粉中室温封闭2 h,TBST洗涤3次,分别加入TGF-β1抗体(1∶1 000)、Smad2抗体(1∶1 000)、p-Smad2抗体(1∶2 000)、Smad3抗体(1∶1 000)、p-Smad3抗体(1∶2 000)、α-SMA抗体(1∶1 000)和GAPDH抗体(1∶1 000),4℃下孵育过夜,然后加入HRP标记的山羊抗兔lgG二抗(1∶10 000)在室温下孵育1 h,再次冲洗后,将膜放置于凝胶成像系统中,加入200μL ECL显色液覆盖膜表面,显影拍照,使用Image 6.0软件计算各蛋白条带灰度值,以GAPDH为内参对照计算各蛋白相对表达水平,蛋白磷酸化水平用磷酸化蛋白和各自的总蛋白之间的比率表示。
1.3 统计学方法 采用SPSS 22.0软件进行数据分析,计量资料以±s表示。多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠p(O2)及OI比较 与Sham组比较,Model组大鼠p(O2)和OI均降低(P<0.05);与Model组和antagomir-NC组比较,antagomir组大鼠p(O2)和OI升高(P<0.05)。见表2。
Tab.2 Comparison of p(O2)and OI between the four groups of rats表2 各组大鼠p(O2)及OI比较(n=15,mmHg,±s)
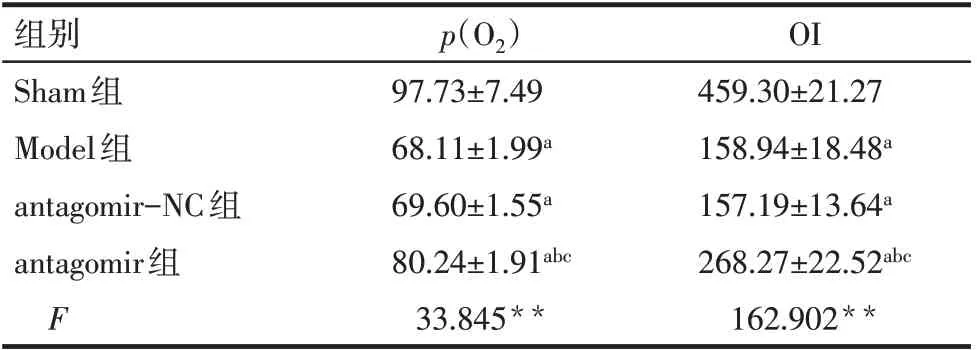
Tab.2 Comparison of p(O2)and OI between the four groups of rats表2 各组大鼠p(O2)及OI比较(n=15,mmHg,±s)
**P<0.01;a与Sham组比较,b与Model组比较,c与antagomir-NC组比较,P<0.05。
组别Sham组Model组antagomir-NC组antagomir组F p(O2)97.73±7.49 68.11±1.99a 69.60±1.55a 80.24±1.91abc 33.845**OI 459.30±21.27 158.94±18.48a 157.19±13.64a 268.27±22.52abc 162.902**
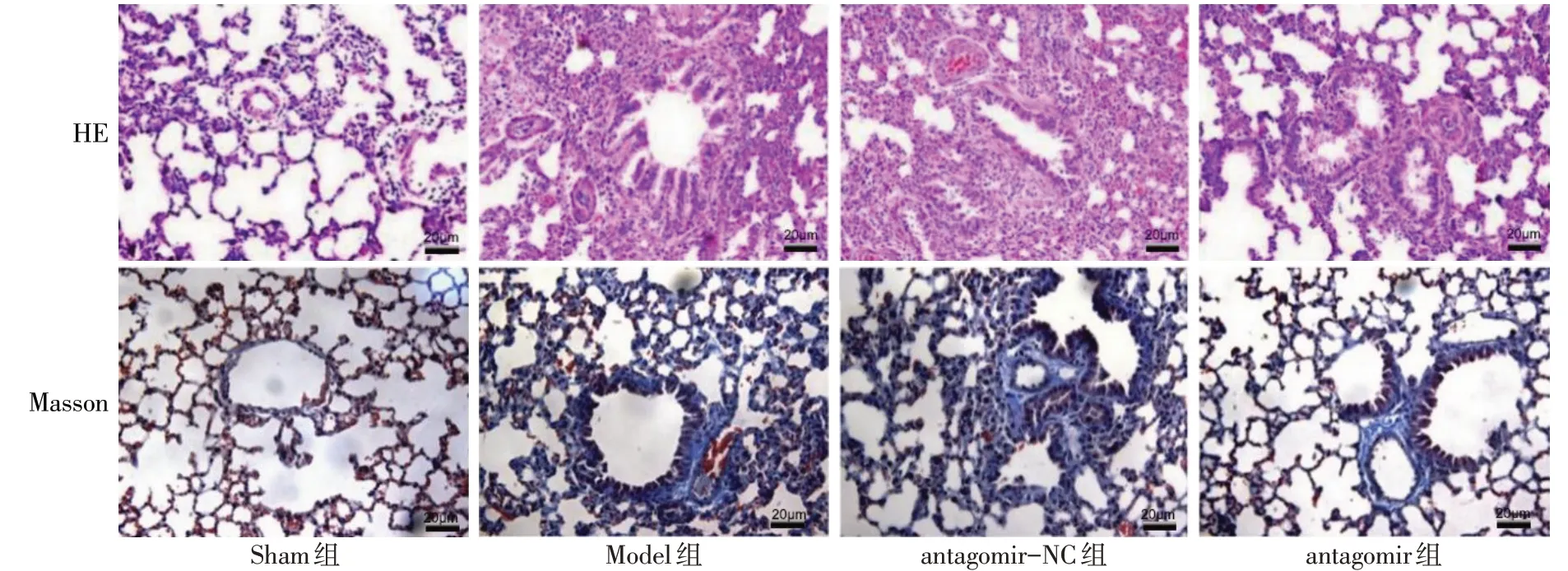
Fig.1 HE staining and Masson staining of lung tissue(×200)图1 肺组织HE染色及Masson染色(×200)
2.2 各组大鼠肺组织病理学变化比较 见图1。HE染色结果显示,Sham组无明显肺泡结构损伤、炎症或出血;Model组和antagomir-NC组大鼠肺组织损伤严重,肺泡间隔明显水肿增厚,炎性细胞浸润,红细胞增多,肺泡结构不完整,部分肺泡间隔破裂;与Model组和antagomir-NC组比较,antagomir组大鼠肺组织炎性细胞浸润、出血、肺间质肿胀明显减少,肺组织损伤明显改善。Masson染色结果显示,Sham组大鼠肺泡结构完整且无明显的胶原纤维沉积;与Sham组比较,Model组和antagomir-NC组大鼠肺泡结构被破坏且肺间质明显有大量蓝色胶原纤维;与Model组和antagomir-NC组比较,antagomir组大鼠蓝色胶原分布明显减轻。
2.3 各组大鼠肺组织中Hyp含量比较 Sham组、Model组、antagomir-NC组和antagomir组大鼠肺组织中Hyp含量(μg/g)分别为412.04±31.92、812.67±28.67、810.63±38.51和537.68±29.04,组间比较差异有统计学意义(n=15,F=116.472,P<0.05)。与Sham组比较,Model组大鼠肺组织中Hyp含量升高(P<0.05);与Model组和antagomir-NC组比较,antagomir组大鼠肺组织中Hyp含量降低(P<0.05)。
2.4 各组大鼠BALF中炎性因子水平比较 与Sham组比较,Model组大鼠BALF中炎性因子IL-1β、IL-6和TNF-α表达水平均升高(P<0.05);与Model组和antagomir-NC组比较,antagomir组大鼠BALF中炎性因子IL-1β、IL-6和TNF-α表达水平均降低(P<0.05)。见表3。
Tab.3 Comparison of inflammatory cytokinesin in lung tissue between the four groups of rats表3 各组大鼠肺组织中炎性因子水平比较(n=15,ng/L,±s)
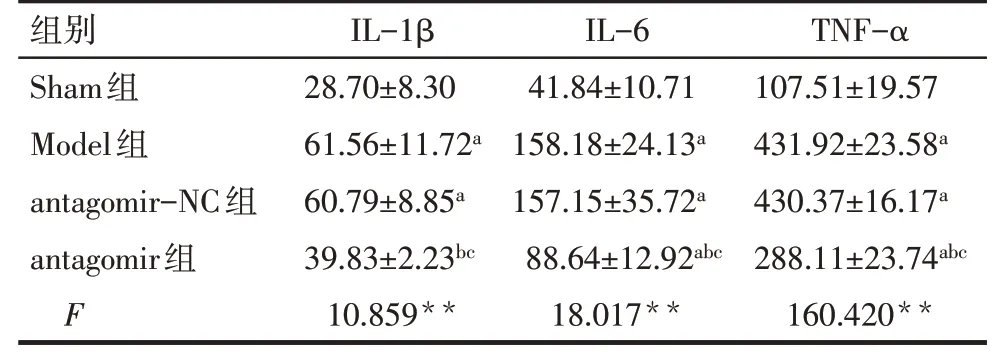
Tab.3 Comparison of inflammatory cytokinesin in lung tissue between the four groups of rats表3 各组大鼠肺组织中炎性因子水平比较(n=15,ng/L,±s)
**P<0.01;a与Sham组比较,b与Model组比较,c与antagomir-NC组比较,P<0.05。
组别Sham组Model组antagomir-NC组antagomir组F IL-1β 28.70±8.30 61.56±11.72a 60.79±8.85a 39.83±2.23bc 10.859**IL-6 41.84±10.71 158.18±24.13a 157.15±35.72a 88.64±12.92abc 18.017**TNF-α 107.51±19.57 431.92±23.58a 430.37±16.17a 288.11±23.74abc 160.420**
2.5 各组大鼠肺组织中miR-33及TGF-β1、CollagenⅠ和CollagenⅢmRNA水平比较 与Sham组比较,Model组大鼠肺组织中miR-33及TGF-β1、CollagenⅠ和CollagenⅢmRNA表达水平均升高(P<0.05);与Model组和antagomir-NC组比较,antagomir组大鼠肺组织中miR-33及TGF-β1、CollagenⅠ和CollagenⅢmRNA表达水平均降低(P<0.05)。见表4。
2.6 各组大鼠肺组织中TGF-β1/Smad信号通路相关蛋白表达水平比较 与Sham组比较,Model组大鼠 肺 组 织 中TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3和α-SMA蛋白表达水平均上调(P<0.05);与Model组和antagomir-NC组比较,antagomir组大鼠肺组织中TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3和α-SMA蛋白表达水平均下调(P<0.05)。见图2,表5。
Tab.4 Comparison of the expression level of miR-33 and mRNA expression levels of TGF-β1,CollagenI and CollagenⅢbetween the four groups of rats表4 各组大鼠肺组织中miR-33及TGF-β1、CollagenI和CollagenⅢmRNA表达水平比较(n=15,±s)

Tab.4 Comparison of the expression level of miR-33 and mRNA expression levels of TGF-β1,CollagenI and CollagenⅢbetween the four groups of rats表4 各组大鼠肺组织中miR-33及TGF-β1、CollagenI和CollagenⅢmRNA表达水平比较(n=15,±s)
**P<0.01;a与Sham组比较,b与Model组比较,c与antagomir-NC组比较,P<0.05。
组别Sham组Model组antagomir-NC组antagomir组F miR-33 1.00±0.27 2.21±0.26a 2.21±0.20a 0.08±0.02abc 71.948**TGF-β1 1.01±0.05 2.18±0.24a 2.15±0.21a 1.38±0.17abc 30.299**CollagenⅠ1.00±0.07 1.80±0.17a 1.80±0.15a 1.46±0.06abc 29.265**CollagenⅢ1.00±0.09 1.97±0.21a 1.94±0.12a 1.35±0.11abc 34.497**
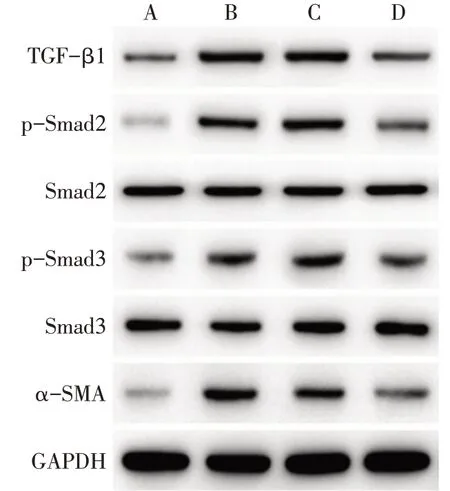
Fig.2 Western blot assay of TGF-β1,Smad2,p-Smad2,Smad3,p-Smad3 andα-SMA in lung tissue of rat in each group图2 各组大鼠肺组织TGF-β1、Smad2、p-Smad2、Smad3、p-Smad3和α-SMA蛋白印迹图
3 讨论
ARDS是急性肺损伤的一种危险并发症,具有很高的发病率和病死率。ARDS的主要病理特征是肺纤维化,ARDS肺纤维化是由肺部炎症和细胞外基质的反复破坏和修复引起的持续性肺泡损伤,临床表现为进行性低氧血症和呼吸窘迫[11]。在ARDS过程中,当肺部受到感染或创伤时,炎症通路就会被激活。炎症反应有助于清除病原体,但过度的炎症也会导致肺泡损伤和肺泡水肿液的积累,ARDS肺泡水肿液中含有高水平的炎性细胞因子,包括IL-1β、IL-6、TNF-α和TGF-β1等,当细胞因子水平过高时,可诱导上皮细胞向成纤维细胞转化,引起肺泡损伤,并伴有Hyp和胶原含量增加,发生纤维化沉积,发展成肺纤维化,最终导致急性呼吸衰竭[12]。即使在最大支持容许性高CO2通气和体外膜氧合的治疗情况下,ARDS患者仍表现出肺功能不可逆的恶化[13],目前还没有可以完全改善ARDS肺纤维化的治疗方法。
Tab.5 Comparison of protein expression levels of TGF-β1,p-Smad2/Smad2,p-Smad3/Smad3 andα-SMA in lung tissue between the four groups of rats表5 各组大鼠肺组织中TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3和α-SMA蛋白表达水平比较(n=15,±s)

Tab.5 Comparison of protein expression levels of TGF-β1,p-Smad2/Smad2,p-Smad3/Smad3 andα-SMA in lung tissue between the four groups of rats表5 各组大鼠肺组织中TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3和α-SMA蛋白表达水平比较(n=15,±s)
**P<0.01;a与Sham组比较,b与Model组比较,c与antagomir-NC组比较,P<0.05。
组别Sham组Model组antagomir-NC组antagomir组F TGF-β1 0.31±0.05 0.75±0.07a 0.74±0.05a 0.37±0.02bc 61.722**p-Smad2/Smad2 0.32±0.03 0.87±0.10a 0.87±0.11a 0.56±0.10abc 26.354**p-Smad3/Smad3 0.41±0.06 0.79±0.06a 0.79±0.07a 0.61±0.06abc 23.452**α-SMA 0.21±0.02 0.49±0.05a 0.50±0.07a 0.30±0.04bc 22.852**
miR-33是一种非编码RNA,也是M1巨噬细胞表型的炎性介质。研究发现miR-33的表达与IL-6和TNF-α等炎性因子含量呈正相关,miR-33抑制剂可以促进巨噬细胞从M1表型分化为M2表型并减少THP-1细胞中IL-6和TNF-α等炎性因子的表达[14]。同时miR-33也被认为是一种促纤维化miRNA[15]。有研究报道,miR-33参与了肝脏动脉粥样硬化病变和纤维化反应的炎症过程[16]。Yu等[17]通过基因敲除发现miR-33a的缺失可通过抑制TGF-β/Smad信号通路的激活,从而抑制心肌成纤维细胞的增殖和纤维化。然而抑制miR-33表达可否改善ARDS肺纤维化尚不清楚。因此,本研究构建LPS诱导的ARDS大鼠肺纤维化模型,采用miR-33 antagomir通过与miR-33靶向互补来沉默miR-33,探讨抑制miR-33表达对ARDS大鼠肺纤维化的影响及其作用机制。结果显示,Model组大鼠中p(O2)和OI均降低,肺组织中Hyp含量升高,HE染色和Masson染色结果也显示肺组织损伤和纤维化严重,表明ARDS造模成功。抑制miR-33表达后ARDS大鼠中p(O2)和OI升高,Hyp含量降低,且肺组织损伤和纤维化情况明显改善,说明抑制miR-33表达可改善ARDS大鼠肺纤维化。
TGF-β1/Smad信号通路被认为是组织纤维化的主要调节因子,有助于肌成纤维细胞的激活和胶原蛋白等细胞外基质的过度生成,从而促进组织纤维化的形成[18]。TGF-β1激活的Smad信号通路可使Ⅰ型受体介导的Smad2和Smad3磷酸化,从而增加CollagenⅠ和CollagenⅡ等纤维化相关基因以及IL-1β、IL-6和TNF-α等炎性因子的表达[19]。TGF-β1/Smad信号通路在ARDS肺纤维化过程中发挥着关键作用[20]。TGF-β1可促进LPS诱导的ARDS大鼠早期肺纤维化的发展[21]。抑制TGF-β1/Smad信号通路的激活可以有效改善组织纤维化。Mu等[22]研究发现,肝素能有效抑制TGF-β1和p-Smad2、p-Smad3的表达从而减轻LPS诱导的急性肺损伤。研究发现白藜芦醇可通过抑制TGF-β1/Smad信号通路改善LPS诱导的ARDS肺纤维化[23]。本研究进一步对抑制miR-33表达改善ARDS大鼠肺纤维化的作用机制是否与TGF-β1/Smad信号通路有关进行探讨。结果发现,ARDS大鼠BALF中炎性因子IL-1β、IL-6和TNF-α的表达升高,说明有严重的炎症反应,肺组织中TGF-β1、CollagenⅠ和CollagenⅢmRNA表达水平及TGF-β1、p-Smad2/Smad2、p-Smad3/Smad3和α-SMA蛋白表达水平均升高,表明TGF-β1/Smad信号通路处于激活状态。抑制miR-33表达后TGF-β1/Smad信号通路被抑制,炎症反应也明显减轻。因此,抑制miR-33表达后ARDS大鼠肺纤维化的改善可能与抑制TGF-β1/Smad信号通路的激活有关。
综上所述,抑制miR-33的表达可能通过抑制TGF-β1/Smad信号通路的激活,减少炎性因子的产生和异常胶原表达和分布,从而减轻LPS诱导的ARDS大鼠肺损伤和肺纤维化,miR-33表达抑制剂可能成为ARDS肺纤维化患者的一种新的治疗选择,但miR-33与TGF-β1/Smad信号通路分子之间的具体作用关系以及miR-33在ARDS发病机制中的作用尚需进一步研究。

