慢病毒转染调控FoxM1表达对人肝内胆管细胞癌增殖、侵袭及MMPs表达的影响
刘凌云,毛涵,朱袭嘉
在人类肝脏原发肿瘤中,肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)发病率仅次于肝细胞癌(hepatocellular carcinoma,HCC),占肝脏原发恶性肿瘤的10%~15%[1]。全球范围内ICC发病率及病死率呈快速增长趋势[2]。由于ICC恶性程度高,根治性切除术后患者的5年生存率仅为20%~40%[3]。叉头盒蛋白M1(forkhead box protein M1,FoxM1)是叉头基因家族成员,人类FoxM1基因位于染色体12p13.3末端着丝粒区域,长约25 kb,包括10个外显子。FoxM1在细胞由G1期至S期分化过程中及保持染色体稳定性方面起到关键作用,是调节细胞增殖和凋亡的重要转录因子[4]。FoxM1可通过增强细胞增殖能力促进肿瘤形成,而且在晚期肿瘤中促进肿瘤侵袭和转移[5]。目前研究发现FoxM1在多种实体瘤中高表达,如乳腺癌[6]、HCC[7]及胃癌[8]等,并且与其预后、复发及转移相关。然而,FoxM1在ICC中的作用及机制尚未完全清楚。基质金属蛋白酶(matrix metalloproteinases,MMPs)是锌钙依赖肽链内切酶家族成员,其中MMP-9和MMP-2与肿瘤转移密切相关[9]。阻断FoxM1信号转导能通过抑制MMP-2表达,从而降低肝细胞癌干细胞样细胞的迁移和侵袭[10]。目前MMP-9和MMP-2在ICC中的作用尚不十分清楚,探索其对ICC的影响及是否与FoxM1相互关联具有重要意义。本研究利用慢病毒载体转染ICC细胞株,构建FoxM1上调及下调的稳定转染细胞株,并观察FoxM1表达变化对ICC细胞生物学行为及MMP-9和MMP-2表达的影响,为临床ICC的诊治奠定实验基础。
1 材料与方法
1.1 材料 人ICC细胞株HCCC-9810、RBE和SSP-25(中国科学院上海生命科学研究院);RPMI 1640培养基、胎牛血清(美国Life Technologies公司);LV-FoxM1-RNAi、FoxM1过表达慢病毒、聚凝胺(中国吉凯基因公司);Trizol(美国Invitrogen公司);SYBR®Premix Ex TaqTMⅡ(Tli RNase H Plus,货号RR820A,日本TaKaRa公司);RIPA蛋白提取试剂盒、PMSF蛋白酶抑制剂、BCA蛋白含量检测试剂盒(南京凯基生物科技公司);超敏ECL化学发光试剂盒(美国Millipore公司);FoxM1兔抗人多克隆抗体(英国Abcam公司);MMP-9及MMP-2兔抗人多克隆抗体(美国Proteintech公司);山羊抗兔二抗、GAPDH抗体(北京博奥森生物有限公司);MTT细胞增殖及细胞毒性检测试剂盒(南京凯基生物科技公司);Transwell小室(美国Corning公司)。
1.2 方法
1.2.1 细胞培养 将复苏的HCCC-9810、RBE和SSP-25细胞分别置于含10%胎牛血清的RPMI1640培养基中,在37℃、5%CO2的恒温培养箱中进行常规的细胞培养和传代。
1.2.2 Western blot检测ICC细胞系FoxM1及MMP-9、MMP-2蛋白表达 收集各种生长状态良好的ICC细胞,加入RIPA和PMSF提取总蛋白,然后BCA法检测总蛋白含量,将已定量的总蛋白液与加样缓冲液以5∶1比例混合,经蛋白变性后制成待检测样品。配制5%浓缩胶和10%分离胶,将蛋白质样品加入各孔道配平,进行SDS-PAGE电泳。电泳产物以恒压电转至PVDF膜(80 V 30 min,110 V 60 min),室温下用5%蛋白封闭液于摇床上缓慢封闭2 h,用TBST漂洗后加入稀释的一抗(FoxM1、MMP-9、MMP-2:1∶1 000;GAPDH:1∶2 000)低速水平摇床上4℃孵育过夜,次日TBST漂洗后加入稀释的山羊抗兔二抗(1∶10 000),室温低速摇床孵育1 h,洗膜后滴加配好的ECL化学发光液曝光成像。以GAPDH为内参,图像处理软件Image J对蛋白条带进行半定量分析。
1.2.3 慢病毒转染ICC细胞株 慢病毒载体带有绿色荧光蛋白基因和嘌呤霉素抗性等特征,即转染成功后的细胞可以正常表达绿色荧光并对嘌呤霉素耐药。按照慢病毒转染手册,转染前24 h,选取生长状态良好的目标细胞,常规培养条件下,24孔板每孔加入(2~10)×104个细胞进行培养。24 h后细胞融合率达到70%~90%时,吸除旧培养基,每孔加入0.5 mL悬浮稀释的慢病毒(5~8 mg/L,已加入含有聚凝胺的无血清RPMI 1640培养基,分为上调组HCCC-9810-FoxM1及下调组SSP-25-shFoxM1),同时以对照阴性慢病毒(加有聚凝胺)转染目的细胞建立对照组细胞株(分为HCCC-9810-Control组及SSP-25-Control组),细胞常规于37℃、5%CO2培养箱培养。转染后12 h观察细胞生长状态,如无明显毒性作用,约48 h后更换常规培养基。转染后96 h可在倒置相差荧光显微镜下观察细胞绿色荧光蛋白表达情况。细胞绿色荧光蛋白表达亮度较好并生长稳定情况下,加入嘌呤霉素(1 mg/L)筛选去除转染差的细胞,Western blot检测各组转染后细胞中FoxM1蛋白表达变化情况,细胞荧光高表达及生长稳定后可继续培养进行后续细胞实验。
1.2.4 MTT法检测转染后各组ICC细胞增殖力 取各组对数生长期的细胞计数,96孔板中每孔加入(5~10)×103个细胞(100μL),边缘孔加入无菌PBS液,每组细胞设5个平行对照孔,5%CO2、37℃条件下培养,倒置显微镜观察48 h和72 h细胞生长情况。实验结束前4 h加入5 g/L MTT液10μL,继续培养4 h后弃去培养液,每孔加入200μL DMSO,37℃摇床震荡10 min,待结晶充分溶解后在酶标仪上检测490 nm波长下每孔的光密度(OD)值,绘制生长曲线。
1.2.5 Transwell实验检测FoxM1对ICC细胞侵袭的影响 将预冷的RPMI 1640无血清培养基与Matrigel Matrix基质胶按体积比1∶8比例充分混匀稀释,每孔加入50μL上述稀释液至小室聚碳酸酯膜(小室底膜)的上室面,37℃培养箱中放置4 h使其聚合成凝胶。上室加入准备好的细胞悬液(HCCC-9810组,1×105个/孔,100μL;SSP-25组,5×104个/孔,50μL)。下室加入600μL含10%胎牛血清的RPMI 1640培养基。种板时需避免产生气泡,常规细胞培养48 h后取出小室,用棉签头轻柔擦掉小室上层细胞,4%多聚甲醛固定小室30 min,再用0.1%结晶紫染色30 min,PBS洗净风干后显微镜下随机读取5个视野(上、中、下、左及右)小室下表面细胞计数并拍照。该实验同样条件下重复3次。
1.2.6 qPCR检测FoxM1变化对ICC细胞MMP-9及MMP-2 mRNA表达的影响 收集各组对数生长期细胞,用Trizol法提取其总RNA,按照逆转录试剂盒说明书合成cDNA。取逆转录产物2μL,总体系20μL,使用TaKaRa公司SYBR Green染料法进行qPCR反应,GAPDH为内参,反应条件为:95℃预变性30 s;95℃变性5 s,60℃退火30 s,72℃延伸30 s,40个循环。使用NCBI在线Primer Blast设计引物,反应体系中引物序列见表1。每个样本均设3个复孔,重复3次取平均值。记录各阶段Ct值,用2-ΔΔCt法计算mRNA相对表达量。

Tab.1 qPCR sequence of primers表1 qPCR检测引物序列
1.3 统计学方法 使用GraphPad Prism 6.0和SPSS 20.0软件包进行数据分析。符合正态分布的计量资料采用均数±标准差(±s)表示,2组间均数比较采用配对t检验,多组间均数比较采用单因素方差分析,组间多重比较采用Tukey法,以P<0.05为差异有统计学意义。
2 结果
2.1 ICC细胞株中FoxM1蛋白表达情况 Western blot检测3种ICC细胞株HCCC-9810、RBE和SSP-25的FoxM1蛋白表达水平分别为0.24±0.05、0.82±0.04、1.74±0.10(F=347.600,P<0.01),SSP-25细胞株表达最高,HCCC-9810表达最低,见图1。
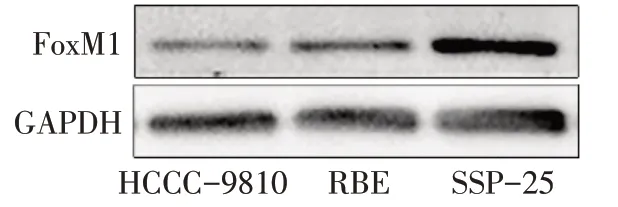
Fig.1 Expression levels of FoxM1 protein in ICC cell lines图1 ICC细胞株中FoxM1蛋白表达情况
2.2 ICC稳定转染细胞株的建立及鉴定 选取HCCC-9810作为上调FoxM1目标细胞株(HCCC-9810-FoxM1组),SSP-25作为下调FoxM1目标细胞株(SSP-25-shFoxM1组)。2株细胞转染效率均达90%以上,进一步使用添加嘌呤霉素的RPMI 1640培养基(1 mg/L)筛选,2株细胞均能持续表达绿色荧光蛋白且生长状态良好,见图2。Western blot检测结果提示HCCC-9810-FoxM1组较HCCC-9810-Control组FoxM1表达稳定上调(1.53±0.11vs.0.38±0.05,t=13.990,P<0.01),而SSP-25-shFoxM1组较SSP-25-Control组FoxM1表达稳定下调(0.20±0.05vs.0.87±0.07,t=10.480,P<0.01),见图3。
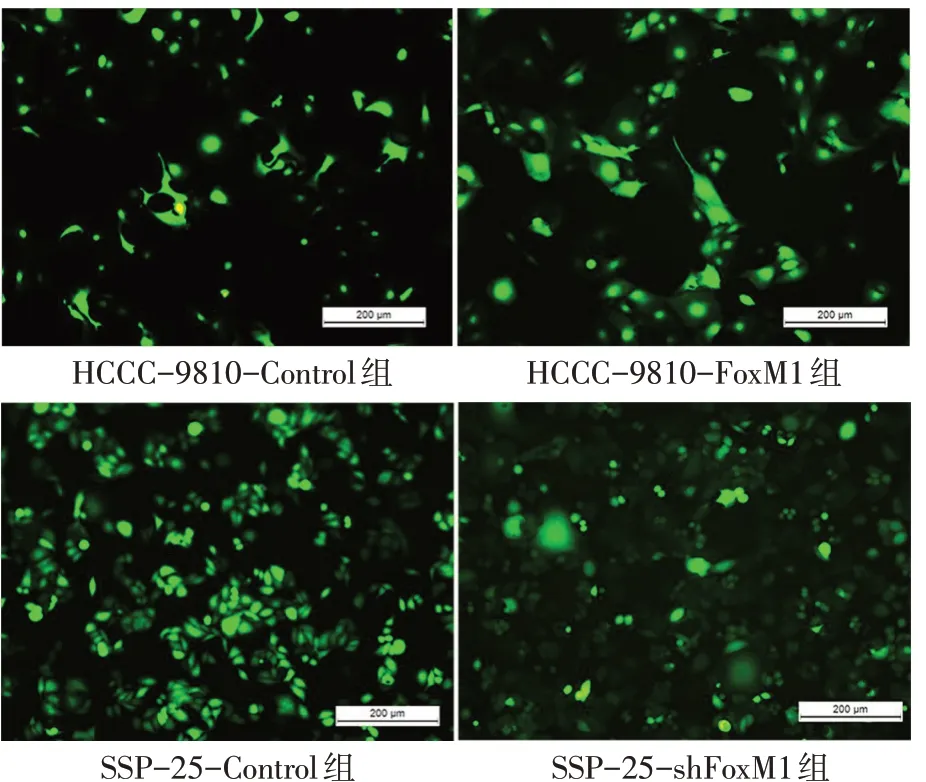
Fig.2 Representative graph of green fluorescent protein expression in ICC cell lines after lentivirus transfection图2 慢病毒转染后ICC细胞株绿色荧光蛋白表达图
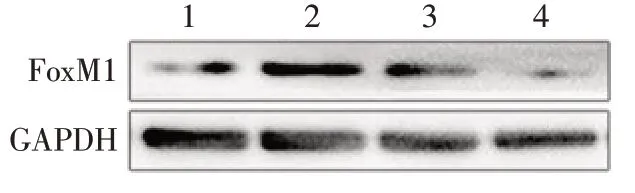
Fig.3 Expression of FoxM1 in ICC stably transfected cell lines图3 ICC稳定转染细胞株FoxM1表达情况
2.3 ICC细胞增殖能力比较 MTT实验结果显示,实验开始48 h后HCCC-9810-FoxM1组增殖能力明显高于HCCC-9810-Control组,而SSP-25-shFoxM1组增殖能力明显低于SSP-25-Control组(均P<0.05),见表2。
Tab.2 Comparison of the proliferation ability between the four groups of ICC cells表2 各组ICC细胞增殖能力对比(n=3,OD490,±s)

Tab.2 Comparison of the proliferation ability between the four groups of ICC cells表2 各组ICC细胞增殖能力对比(n=3,OD490,±s)
*P<0.05,**P<0.01。
组别HCCC-9810-Control组HCCC-9810-FoxM1组t SSP-25-Control组SSP-25-shFoxM1组t 24 h 0.36±0.01 0.34±0.02 1.107 0.35±0.01 0.36±0.01 0.725 48 h 0.76±0.07 1.07±0.10 4.544*0.81±0.06 0.59±0.06 3.908*72 h 1.21±0.08 2.08±0.08 11.322**1.65±0.09 1.02±0.09 7.288**
2.4 FoxM1表达变化影响ICC细胞的侵袭能力 Transwell小室侵袭实验结果表明,HCCC-9810-FoxM1组的穿透细胞数目明显高于HCCC-9810-Control组(单 位:个/视 野,394.00±9.64vs.219.00±12.53,t=21.650,P<0.01);而 SSP-25-shFoxM1组穿透细胞数目明显低于SSP-25-Control组(197.00±10.58vs.463.67±20.50,t=32.000,P<0.01),见图4。
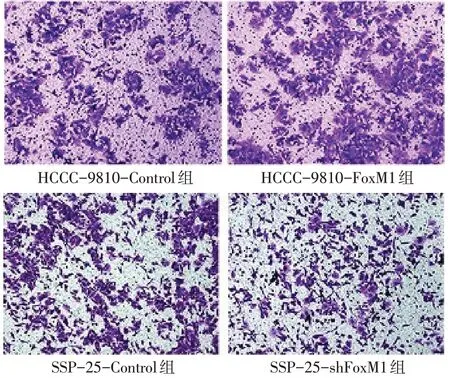
Fig.4 Transwell cell invasion test(×100)图4 Transwell小室侵袭实验(×100)
2.5 FoxM1表达变化影响ICC细胞MMP-9及MMP-2 mRNA表达 HCCC-9810-FoxM1组中MMP-9及MMP-2 mRNA表达水平较HCCC-9810-Control组明显升高,而SSP-25-shFoxM1组中MMP-9及MMP-2 mRNA表达水平较SSP-25-Control组明显降低(均P<0.01),见表3。
3 讨论
ICC的生物学行为较HCC更具侵略性,预后较HCC更差[11]。而ICC肝切除术后复发及转移是导致ICC术后生存率低的主要因素[3,12]。目前,由于缺乏敏感性和特异性高的生物标志物,ICC早期诊断困难[11],从而直接影响ICC的后续治疗及预后。因此,寻找有效的生物标志物,对于提高ICC早期诊断率及疗效具有重要的临床意义。
Tab.3 Effects of FoxM1 expression changes on the relative expression levels of MMP-9 and MMP-2 mRNA in ICC cells表3 FoxM1表达变化对ICC细胞MMP-9及MMP-2 mRNA相对表达量的影响 (n=3,±s)
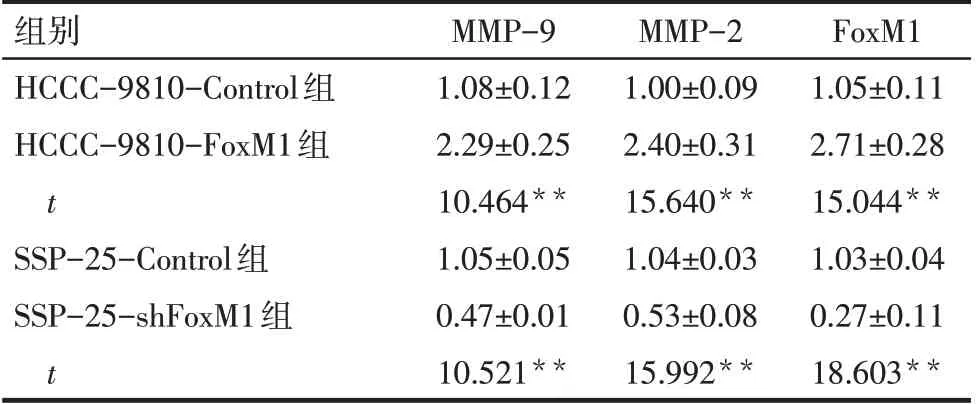
Tab.3 Effects of FoxM1 expression changes on the relative expression levels of MMP-9 and MMP-2 mRNA in ICC cells表3 FoxM1表达变化对ICC细胞MMP-9及MMP-2 mRNA相对表达量的影响 (n=3,±s)
**P<0.01。
组别HCCC-9810-Control组HCCC-9810-FoxM1组t SSP-25-Control组SSP-25-shFoxM1组t MMP-9 1.08±0.12 2.29±0.25 10.464**1.05±0.05 0.47±0.01 10.521**MMP-2 1.00±0.09 2.40±0.31 15.640**1.04±0.03 0.53±0.08 15.992**FoxM1 1.05±0.11 2.71±0.28 15.044**1.03±0.04 0.27±0.11 18.603**
FoxM1在恶性肿瘤细胞发生、增殖和侵袭转移等方面发挥重要作用。一项研究通过siRNA干扰非浆液性上皮性卵巢癌细胞株FoxM1表达,发现下调FoxM1表达可抑制肿瘤细胞生长和克隆形成[13]。另一项研究报道FoxM1影响HCC组织染色体稳定性,在HCC发生发展中起到促进作用[14]。Yu等[15]发现FoxM1在高转移潜能HCC细胞MHCCLM3中的表达较低转移潜能细胞SMMC7721明显升高,并且与HCC细胞迁移及侵袭密切相关,从而促进HCC转移。FoxM1在多种恶性肿瘤包括HCC的发生发展及侵袭转移等演进过程中具有重要作用,深入研究其特点及机制具有重要价值。而目前FoxM1影响ICC细胞恶性表型方面的功能尚不清楚,在ICC细胞的增殖、侵袭转移方面的作用机制尚需进一步阐明。
本研究首先运用Western blot技术分别检测3种ICC细胞株中FoxM1蛋白表达水平,发现SSP-25细胞株中FoxM1表达最高,HCCC-9810中表达最低,决定选取HCCC-9810作为上调FoxM1细胞株,SSP-25作为下调FoxM1细胞株。笔者选用目前已经广泛使用且稳定性高、特异性强的慢病毒载体作为FoxM1转染实验手段,经过反复实验及摸索最佳转染条件,成功建立了FoxM1稳定转染ICC细胞株。随后经Western blot验证,HCCC-9810-FoxM1、SSP-25-shFoxM1及两种相应对照细胞株HCCC-9810-Control、SSP-25-Control均能持续稳定表达FoxM1,且HCCC-9810-FoxM1上调FoxM1表达明显,SSP-25-shFoxM1则下调明显,达到后续实验要求。接下来一系列体外细胞功能实验证实,过表达HCCC-9810-FoxM1细胞较Control组细胞在增殖及侵袭能力上明显增强,而下调FoxM1表达的SSP-25-shFoxM1细胞较Control组细胞在增殖及侵袭能力上明显降低。上述实验结果表明FoxM1能够体外促进ICC细胞生长增殖及转移。
研究表明,下调FoxM1表达降低了MMP-9及MMP-2的表达和活性,从而抑制了肾透明细胞癌的迁移及侵袭[16]。本研究发现,FoxM1过表达增强ICC细胞侵袭能力,而MMP-9和MMP-2表达增加,表明MMP-9及MMP-2表达变化可能在FoxM1参与调控ICC侵袭过程中起到一定作用,但MMP-9和MMP-2表达是否为FoxM1直接调控或者是间接控制,目前尚不明确。
综上,本研究初步阐明了FoxM1在ICC中上调可明显增强ICC细胞增殖及侵袭能力,而下调FoxM1表达可显著抑制其增殖及侵袭能力,FoxM1可能促进ICC中MMP-9及MMP-2表达,促进ICC增殖及侵袭,并可能通过MMP-9及MMP-2起作用,但相关具体机制尚需进一步研究。FoxM1有望成为ICC新的生物标志物及ICC治疗的新靶点。本研究为揭示ICC发生发展的分子机制提供了一定的理论基础,并为探索ICC有效的诊治策略提供了新思路。

