三维 标测系统指导射频消融治疗左后间隔基底部起源的室性心律失常
张涛 赵华 韩智红 汪烨 王云龙 吴永全 任学军
特发性室性心律失常(ventricular arrhythmias,VAs)以流出道起源最多见,射频消融治疗效果较好[1-3],现已成为特发性VAs治疗的主要方法之一。而左后间隔基底部起源的VAs报道较少[4-5]。本文旨在观察起源于左后间隔基底部的VAs患者心电图特征及三维标测系统指导下射频消融治疗的效果。
1 对象与方法
1. 1 研究对象
2018年12月至2021年1月在首都医科大学附属北京安贞医院接受射频消融治疗的左后间隔基底部起源的VAs患者6例。所有患者均有不同程度的VAs相关 症状,曾服用1~3种抗心律失常药物无效,既往无射频消融史。常规体格检查、血生化未发现异常,所有患者均为窦性心律体表心电图QRS波未见异常。超声心动图检查除1例患者左心室扩大(58 mm)、射血分数轻度下降(50%)外,其余均未见明显异常。本研究通过了北京安贞医院伦理委员会批准。所有患者术前均签署知情同意书,停用抗心律失常药物至少5个半衰期,如术前服用 胺碘酮则停用至少4周。
1. 2 体表心电图分析
记录术前VAs的同步12导联心电图,心电图走纸速度25 mm/s。心电图分析主要集中在以下几个方面:(1)各导联QRS波的形态;(2)QRS波的持续时间;(3)胸前 导联R波的移行部位等。
1. 3 心内VAs标测及射频消融治疗
术前确保准确放置心电图电极片。1%利多卡因局部麻醉下常规穿刺右侧股静脉置入8 F动脉鞘,手术中根据VAs发作情况酌情给予静脉滴注异丙肾上腺素(2~5 μg/min)和(或)程序刺激[6]。程序刺激时将4极电极导管放置在右心室心尖部和(或)流出道进行,术中必要时通过该通路进行右心室标测。常规穿刺右股动脉置入8 F动脉鞘行主动脉逆行途径标测左心室。首先静脉给予普通肝素3000~4000 U,以后根据每小时监测活化凝血时间(activate coagulation time,ACT)补充肝素,使ACT控制在250~350 s。用三维电解剖标测系统(Carto,美国强生公司)进行手术,心内双极电图滤波设定为16~500 Hz,单极电图滤波2~240 Hz。送入SmartTouch压力监测导管(美国强生 公司)进行左心室激动 标测,在激动领先局部进行精细激动标测,进一步确定最早激动点。心室最早激动时间为消融导管头端双极电图起始处到QRS波起始的距离。此后通过窦性心律下基质标测观察左心室有无异常电压区(电压在0.5~1.5 mV为低电压区,<0.5 mV为瘢痕区),基质标测时在导管压力≥5 g下进行采点以保证确切贴靠。如由于压力导管较硬不能充分对后间隔局部进行标测时,可更换为普通非压力盐水灌注导管(美国强生公司)进行标测。起搏标测时的起搏周长为500 ms,刺激电流为起搏阈值+1 mA。确定靶点后消融功率为30~40 W,温度设定为43℃,盐水灌注速度为17~30 ml/min。如果放电开始15 s内VAs消失或明显减少,则持续放电60~90 s, 并在其四周行补点消融,每点60 s,否则停止放电并调整导管位置。
1. 4 随访和判断标准
即刻消融成功标准为消融完成后观察20 min VAs消失,静脉滴注异丙肾上腺素(2~5 μg/min)使心率上升30%~50%和程序刺激不能诱发VAs。长期消融成功标准为术后随访6个月,停用抗心律失常药物下心悸等VAs相关症状消失,术后3个月、6个月复查24 h动态心电图,未见同 形态VAs或其负荷减少90%以上[6]。
1. 5 靶点判断
判断靶点位于左后间隔基底部的指标包括:左前斜位和右前斜位X线透视下,消融导管头端影像学位置符合左后间隔基底部特征,三维标测显示靶点位于左侧His点下方,头端高度在冠状窦口水平或以下(图1)。
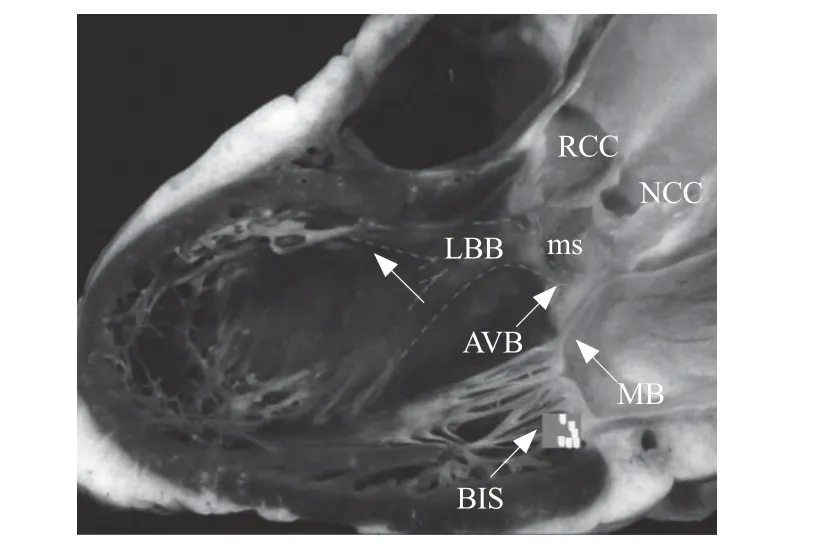
图1 左后间隔基底部解剖及靶点位置
1. 6 统计学处理
所有数据使用SPSS 19统计软件进行分析。计量参数以均值±标准差表示,计数资料采用率或构成比表示。
2 结果
2. 1 患者临床特征
本组患者共6例,其中男4例,女2例,平均年龄(52.5±12.1)岁,1例患者既往有高血压病史。平均24 h室性心律次数(18 219.7±5 149.0)次,所有患者均有频发室性期前收缩,其中2例合并有同形态的短阵室性心动过速。6例患者VAs均为术中自发,发作时血流动力学均稳定(表1)。

表1 6 例起源于左后间隔基底部室性心律失常患者的基本资料和心电图特点
2. 2 患者心电图特征
6例V As的QRS波时限为(140.0±13.0)ms,VAs时QRS波均表现为完全性右束支传导阻滞,电轴左偏,Ⅰ、aVL导联呈高大的R型,Ⅱ导联呈rS型,Ⅲ、aVF导联呈rS型或QS型,Ⅲ导联S波振幅>Ⅱ导联S波振幅,Ⅲ导联r波振幅<Ⅱ导联r波振幅,aVR导联呈Qr型,V1导联呈r’sR型或R型,V2~V4导联呈高大R型,V5导联呈Rs型或R型,V6导联呈Rs型,R/s>2,胸前导联中V2和V3导联R波振幅最大(图2)。
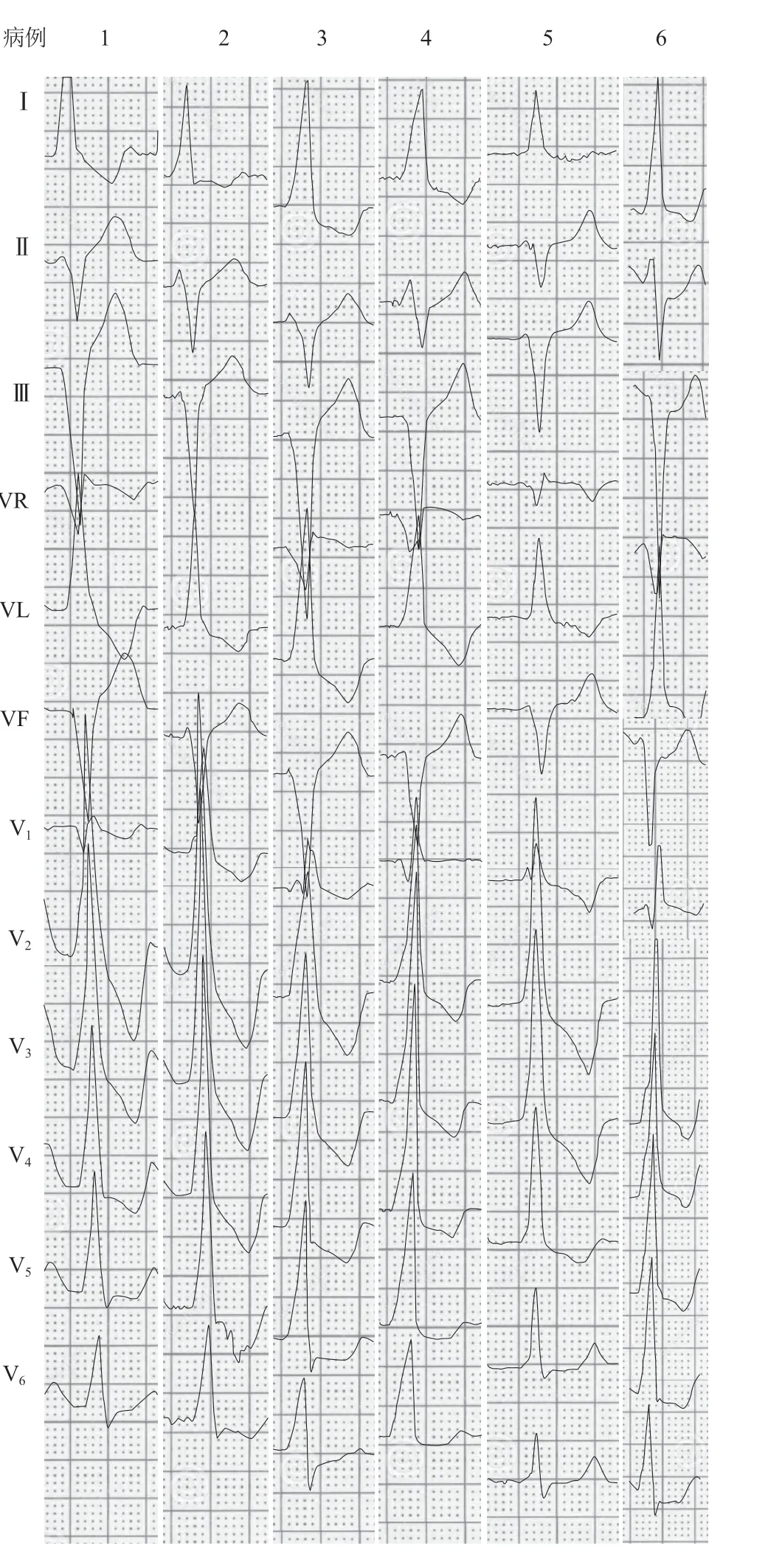
图2 6 例患者的12 导联体表心电图
2. 3 心内标测及射频消融
所有患者左心室电压标测未见低电压区。3例(3/6)患者使用压力导管完成标测和消融,其他3例患者(病例2、3、5)由于压力导管头端过硬不能充分对后间隔局部进行标测而更换为头端较软的普通盐水灌注导管进行后续标测和消融。消融靶点至体表QRS波起始时限为20~34(29.5±5.1)ms。双极电图靶点处在窦性心律下3例患者呈小A大V,另外3例患者只有V波,无小A波,所有患者VAs时靶点处V波前无领先于QRS波的P电位(图3)。其中5例患者单极电图均呈QS型,且于最早激动点起搏时12导联心电图与自发VAs的心电图QRS波图形基本一致(≥11个导联相同),另外1例(病例3)单极电图均呈rS型,且于最早激动点起搏时12导联心电图与自发VAs的心电图QRS波图形不一致。6例患者均即刻消融成功,患者的放电次数1~5(2.0±1.5)次。其中病例3放电10 s后室性期前收缩消失,继续巩固放电90 s,停止放电1 min后室性期前收缩再发,再次消融无效,对右心室及冠状静脉系统进行激动标测,激动均落后于左心室最早激动点,最早激动点位于心中静脉近端,阻抗200 Ω。再次行左后间隔基底部标测消融,功率40 W,消融12 s后室性期前收缩消失,巩固消融120 s,术后观察20 min未见室性期前收缩,术后2 d复发(图4)。
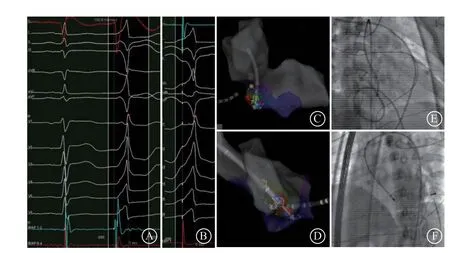
图3 左后间隔基底部起源室性心律失常(病例2) A. 12 导联心电图及成功消融靶点图,室性心律失常时QRS 波呈完全性右束支传导阻滞,电轴左偏,Ⅰ、aVL 导联呈R 型,Ⅱ、aVF 导联呈rS 型,Ⅲ呈QS 型,V1 导联呈r’sR 型,V2~V4 导联呈R 型,V5、V6 导联呈Rs 型,R/s >2,成功消融靶点双极电图领先于 QRS 波33 ms;B. 成功消融靶点处起搏12 导联心电图与自身室性心律失常 12导联心电图QRS 波形一致;C~D. 左心室激动图及消融靶点导管形态;E~F. 消融导管于靶点处左前斜和右前斜影像示导管位于间隔左侧偏后位置
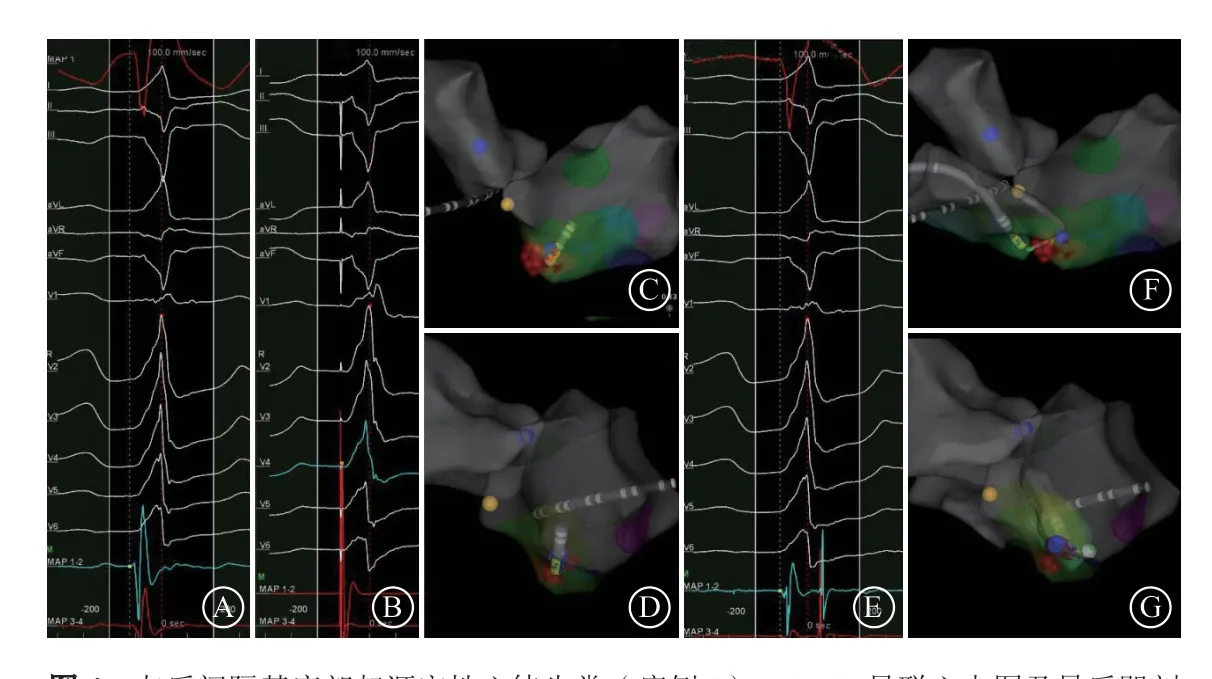
图4 左后间隔基底部起源室性心律失常(病例3) A. 12 导联心电图及最后即刻成功消融靶点图,室性心律失常时QRS 波呈完全性右束支传导阻滞,电轴左偏,Ⅰ、aVL 导联呈R 型,Ⅱ、aVF 导联呈rS 型,Ⅲ呈QS 型,V1 导联呈r’sR 型,V2~V4导联呈R 型,V5、V6 导联呈Rs 型,R/s >2,即刻成功消融靶点位于左后间隔基底部,双极电图领先于QRS 31 ms;B. 消融靶点处起搏12 导联心电图与自身室性心律失常 12 导联心电图QRS 波形不完全一致;C~D. 左心室激动图及普通盐水灌注导管消融靶点形态;E. 右心激动标测最早激动点位于心中静脉近端,双极电图领先于 QRS 波17 ms;F~G. 右心激动图及压力导管位于最早激动点时的形态
2. 4 术后随访
6例患者均成功随访,术后3个月、6个月随访并复查动态心电图,除上述病例3患者术后2 d复发外,其他5例(5/6)患者均停用抗心律失常药物且无VAs发作。所有患者均未出现并发症。
3 讨论
心室后间隔基底部解剖结构复杂,与其相关的VAs并非十分少见[5,7]。解剖学上,心室后间隔基底部上部是膜部室间隔、底部是房室交点的心外膜结构。房室交点是冠状沟、后室间沟和房间沟的汇合处,是左右心房和左右心室的分界标志。因为房间沟和后室间沟不在一条垂直线上,房间沟偏左,因此房室交点并不很局限,内有右冠状动脉的后降支及冠状动脉窦、心中静脉和心小静脉的近端[8]。围绕后间隔基底部的一些解剖比邻结构起源的VAs心电图比较近似,如本文描述的起源于左后间隔基底部的VAs往往需要与起源于右后间隔基底部、后间隔心外膜区域及左后分支的VAs鉴别。左后间隔与右后间隔虽然只有“一墙之隔”,但与左后间隔完全显性预激和右后间隔完全显性预激心电图有明显差别类似,左后间隔基底部和右后间隔基底部起源VAs的体表心电图形态也有明显 差别。Sa to等[5]研究显示,右后间隔基底部起源的V As V1导联呈左束支 样图形,胸前导联转折多在V3~V4导联。而本研究这组左后间隔基底部起源的VAs心电图V1导联则表现为右束支样图形,V2导联呈现R波。二者心电图形态明显不同,临床较易鉴别。Kawamura等[7]研究表明,起源于房室交点基底部VAs的心电图虽然胸前导联转折位于V2导联、V3~V6导联呈R/Rs型,但V1导联全部呈负向或等电位线,这与本研究这组起源于左后间隔基底部VAs心电图V1导联表现为右束支样图形不同,可用于二者鉴别。另外,起源于房室交点基底部VAs的心电图下壁导联均为QS型,而本研究这组病例中Ⅱ导联均呈rS型,这与房室交点较左后间隔基底部更偏心室下部相关。左后分支位于心室基底部和心尖部之间,该部位远端起源的VAs虽然表现为右束支样形态,Ⅱ、Ⅲ、aVF导联呈rS型,但V5~V6导联常常表现为RS/rS型,R/S<1[9],这与本研究这组左后间隔基底部起源的VAs心电图V6导联呈Rs型,并且R/s>2明显不同。造成这一心电图不同的主要原因是左后间隔基底部较左后分支更偏心室基底部,导致除极向量不同所致。另外起源于左后分支的VAs QRS波更窄、胸导联上升支更快速,这与该部位VAs起源于希浦系统有关。
由于左心室流出道的解剖特征,导致经 逆行主动脉途径送入消融导管后,导管多指向心尖方向,如果要到达左后间隔基底部区域,需要顺时针转动导管贴靠间隔并逐步打弯到位。但由于压力导管头部较硬且左心腔空间有限,可能导致顺时针转动导管时无法稳定贴靠间隔或猛然弹离间隔而 无法到位。这种情况下可选用头端较软的盐水灌注大头进行标测,亦可选用双弯大头到位。本研究中3/6的病例因压力导管不能到位而最终使用头端较软的盐水灌注导管进行到位及消融,盐水灌注导管的使用率明显高于既往本中心消融其他部位起源的VAs时该种消融导管的使用率[2,10]。
由于左后间隔基底部特殊的解剖位置,该部位起源的VAs的消融途径有主动脉逆行途径、房间隔途径和右心房途径,其中以主动脉逆行途径最常用。经房间隔途径消融时,由于距离后间隔较远,因此往往需要可调弯鞘才能到位。虽然房间隔途径能够 降低起源于左侧希氏束旁VAs射频消融损伤希氏束的风险,但由于后间隔距离希氏束较远,消融损伤希氏束的风险极小,因此较少使用房间隔途径消融该部位VAs。二尖瓣环和三尖瓣环不在同一水平面,三尖瓣环较二尖瓣环更偏前偏下,并且房间沟和后室间沟不在一条垂直线上,房间沟偏左,因此左心室后间隔部分结构与右心房比邻。通过右心房途径进行解剖消融可能对部分起源于左后间隔基底部VAs的患者有效,尤其后间隔心肌很厚,起源点可能位于深部心肌,这可能导致常规途径消融无法达到有效损伤深度而导致消融效果不佳或远期复发。这种情况下右心房途径有可能更接近VAs的起源点而获得消融成功,尤其对于常规消融途径失败的患者可以尝试右心房途径。Santangeli等[4]研究中包括了5例经右心房途径消融成功的起源于左中后间隔VAs患者,其中3例患者既往消融失败。术中部分患者 于左后间隔基底部进行标测和消融失败,最终经右心房途径消融成功。而本研究中除1例(病例3)因左后间隔消融效果不佳而行右心标测外,其他患者均经主动脉逆行途径消融成功,未行右心标测,病例3右心房侧激动标测局部心室电位未发现明显提前。考虑到本研究经右心房标测该部位VAs的病例较少,今后需要更多的病例来验证该途径的有效性。
综上所述,左后间隔基底部起源的VAs在心电图上有典型的特点,较易与周边比邻结 构起源的VAs鉴别,术前通过心电图可进行初步定位。通过三维标测系统指导消融该部位起源的VAs安全有效。由于解剖结构的影响,部分患者需要使用头端较软的普通盐水灌注导管进行标测消融。
利益冲突所有作者均声明不存在利益冲突

