基于机体状态和功能因素探讨药物诱导肝损伤的研究进展
蔡 琼,杨星月,李芝奇,范琦琦,陈美琳,戴胜云,林瑞超*,赵崇军*
基于机体状态和功能因素探讨药物诱导肝损伤的研究进展
蔡 琼1,杨星月3,李芝奇1,范琦琦1,陈美琳1,戴胜云2,林瑞超1*,赵崇军1*
1. 北京中医药大学 中药品质评价北京市重点实验室,北京 102488 2. 中国食品药品检定研究院,北京 102629 3. 北京中医药大学,北京 102488
药物性肝损伤(drug-induced liver injury,DILI)是急性肝衰竭和药物退出市场的主要原因。大量研究已经从药物的理化性质、体内代谢和作用机制等方面对DILI进行深入研究,为药物研发提供了充分的生物信息。即便如此,DILI尤其是中药诱导肝损伤事件依旧时有发生。机体与药物的相互影响和作用是DILI发生的主要因素。因此,从临床患者和实验动物等角度入手,系统整理和分析不同影响因素,如生活习惯、生理病理状态,年龄、遗传差异、性别等对DILI的影响,评价其与DILI之间的关系,以期为未来中药系统安全性评价技术和方法的完善、中药安全使用提供参考。
中药;肝毒性;机体功能;生活习惯;生理病理状态;年龄;遗传差异;性别差异
肝脏是代谢毒素、环境污染物、化学物质和药物等外源性物质的主要器官。药物性肝损伤(drug-induced liver injury,DILI)是一种罕见的不良事件,从轻微的无症状肝酶升高到严重的肝损伤和肝衰竭,可导致肝移植或死亡[1],而漏报和低估药物的不良反应均能够引起DILI。一般情况下,DILI的发生率根据药物的不同而改变,如异烟肼的发生率为0.5%~2%,而二甲胺四环素和他汀类药物的发生率为0.01%~0.1%,药物研发的平均费用甚至达到2.6亿元[2-3]。然而,在商业化药物上市后接受商业化药物治疗的患者中,DILI合并肝衰竭的发生会导致上市后药物退市和巨大的经济损失。因此,DILI研究对于药物研发和临床安全具有非常重要的意义和价值。
随着生活水平的改善,中药高效、安全的特点和人类生活理念、方式向绿色、自然的转变,一定程度上促进了中药及其相关膳食补充剂等产品在世界范围内的广泛应用。但是,中药不良反应的报道又限制了中药及其相关产品在世界范围内的推广和发展。本课题组前期从中药肝毒性的现状和问题出发,阐述了中药肝损伤在临床上的关键特征和临床诊断中所面临的主要挑战,同时阐述了部分中药肝毒性机制以及中药肝毒性生物标志物筛选等方面的研究进展[4]。事实上,目前,DILI研究大多基于中药主要化学成分的理化性质、固有的毒性和药效特征进行分析[5],往往忽略了患者或机体本身对中药“有效性和安全性”的影响。此外,中医药强调以“治未病”为主,同时在临床治疗疾病过程中注重“辨证论治”,更加强调机体本身、机体状态与中药之间关系的重要性。因此,本文通过整理已报道的药物(包括中药)以及化合物的肝损伤发生的影响因素(图1),从临床患者和实验动物等机体的角度来总结和分析药物肝毒性的影响因素,以期为未来中药系统安全性评价的完善、保证中药安全使用提供参考。
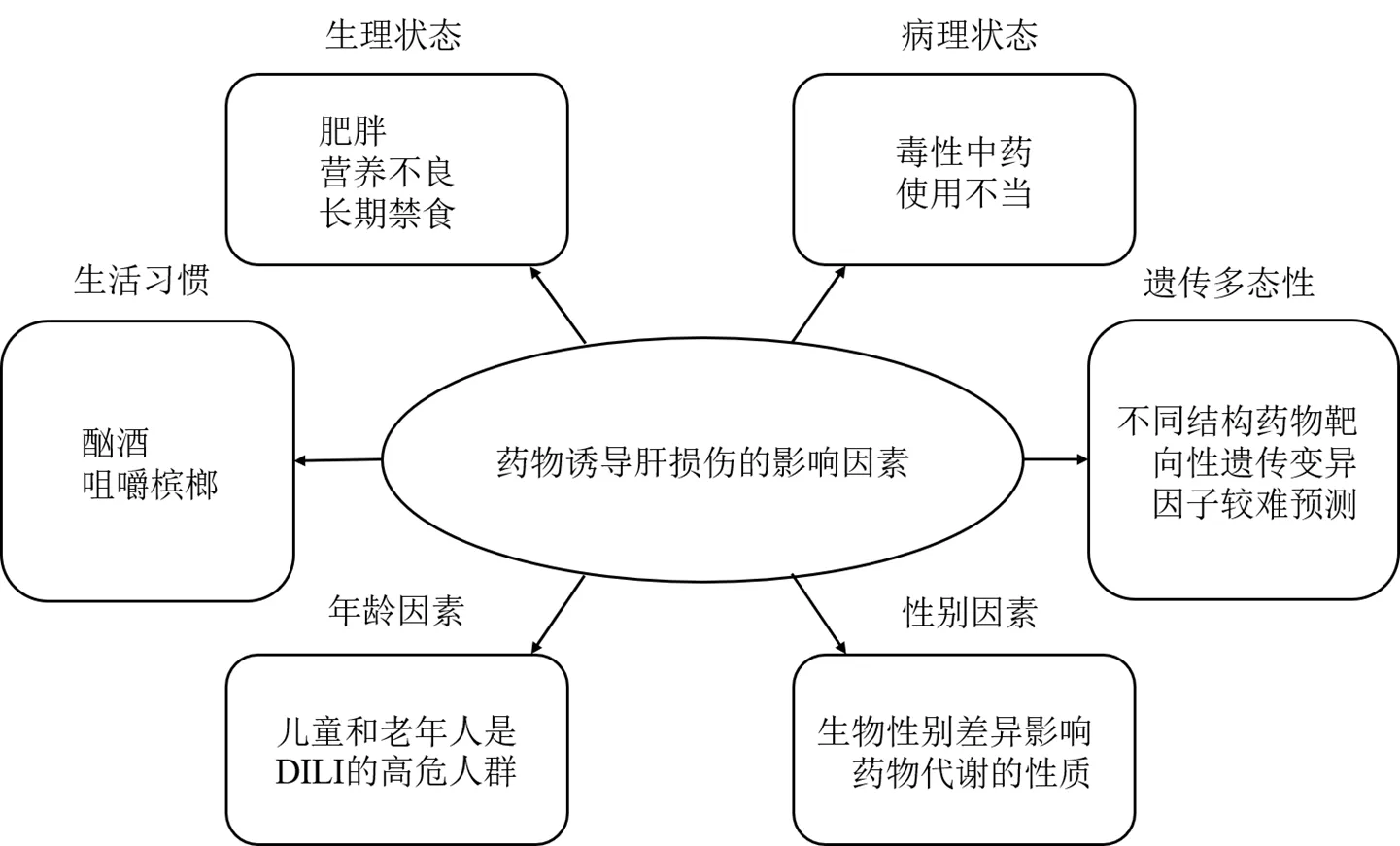
图1 药物诱导肝损伤的影响因素
1 生活习惯
随着中国经济的快速发展,人们的生活水平、习惯发生了翻天覆地的变化,酒已经成为生活中不可或缺的物品。大量研究已经表明无论是急性饮酒还是长期饮酒都会影响肝脏的脂质代谢水平,引起脂肪变性、肝纤维化等一系列疾病。而且,饮酒也会干扰药物在体内的代谢过程,促使DILI的发生。如双稠吡咯啶生物碱(pyrrolizidine alkaloids,PAs)是最常见的植物源毒素,它能污染土壤、水源、植物及其相关衍生食品,进而引起人类DILI的发生。He等[6]发现膳食酒精暴露可加重PAs诱导慢性肝毒性的发生。酒精摄入不会影响PAs诱导肝毒性的起始机制-肝细胞色素P450(cytochrome P450,CYP450)介导的生物激活,但能显著扰乱肝内谷胱甘肽(glutathione,GSH)稳态,诱发肝脏的氧化应激损伤,增强PAs诱导肝毒性。同样,研究表明在治疗剂量条件下,饮酒也会促使对乙酰氨基酚(acetaminophen,APAP)造成的肝损伤[7]。究其原因,酒精能够损伤机体的适应机制,反复给药可使亚临床酒精性脂肪肝累积损伤,进而损害肝脏正常功能,最终发展为严重的肝损伤。虽然抗氧化剂、内质网线粒体应激反应拮抗剂以及调节炎症和再生等适应途径可以抑制致病因素,但是慢性酒精滥用者的适应反应能力因反复用药可能存在受损风险[8]。此外,咀嚼槟榔是亚洲及西方国家移民人群中非常盛行的一种习惯。长期咀嚼槟榔与代谢紊乱、心血管疾病和癌症等慢性疾病等相关。Chou等[9]发现长期槟榔暴露能够增加代谢综合征受试者发生肝纤维化的相关风险。
相反,良好的生活习惯在一定条件下能够预防机体肝损伤的发生。维生素是一组结构相关分子,是维持人体生命活动必须的一类多酚类物质,也是保持人体健康的重要活性物质。大量研究已经证实不同形式的维生素具有不同的辅助因子活性,在吸收、运输、细胞摄取、组织分布和周转等过程中表现不同。Dosumu等[10]发现膳食摄入维生素K能够对抗7,12-二甲基苯蒽诱导的肝毒性,能够改善7,12-二甲基苯蒽对过氧化氢酶(catalase activity,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、GSH--转移酶(glutathione-transferase,GSTs)和GSH过氧化物酶(glutathione peroxidase,GPX)的活性抑制作用,可促进炎症生物标志物(粒细胞巨噬细胞集落刺激因子和白细胞介素-17A)的上调,降低肝脏损伤水平。此外,研究报道维生素E也可降低肝脏组织的氧化应激标志物,增强肝脏组织的抗氧化和抗炎能力,进而改善各种毒性物质,如曲马多所致的肝损伤[11]。Abd等[12]发现维生素D能缓解肝脏三酰甘油和胆固醇的含量、血清miRNA-122和丙氨酸氨基转移酶(alanine transaminase,ALT)活性变化水平,从而缓解脂滴积累、灶性坏死和肝细胞炎症细胞浸润的状态。同时,预处理还能调节肝脏中的关键转录因子过氧化物酶体增殖物激活受体-α(peroxisome proliferator activated receptor-α,PPAR-α)、固醇调节元件结合蛋白基因1(sterol regulatory element binding factor 1,Srebf1)和核因子-κB(nuclear factor-κB,NF-κB)及其下游基因/蛋白Fas、肉毒碱棕榈酰基转移酶-1A(carnitine palmitoyltransferase-1A,CPT-1A)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),降低肝脏脂质,抑制促炎信号转导,进而减轻肿瘤相关巨噬细胞诱导的脂肪性肝炎。维生素D3和钙元素的联用不仅能够通过增强抗氧化和抗炎能力,还可以通过改善钙代谢通路来缓解镉暴露引起的肝损伤[13]。
2 生理状态
肥胖是目前影响人类健康的主要问题之一,因为它与多种代谢紊乱有关,其中包括胰岛素抵抗、2型糖尿病和非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)等。越来越多证据表明,肥胖可增加多种药物(如APAP)所致肝损伤的风险和严重程度[14]。此外,CYP2E1活性与药物的代谢水平密切相关,且肥胖个体肝脏中CYP2E1活性明显增强。因此,脂肪蓄积和CYP2E1诱导可能是肝敏感性的主要原因。Aubert等[15]使用雄性和雌性的正常组、ob/ob组和db/db组小鼠分别进行探讨,发现雌性bd/bd组小鼠体内的CYP2E1选择性升高,而其体内三酰甘油含量要显著低于ob/ob组小鼠。ig不同剂量的APAP 8 h,通过肝功酶、病理组织和染色评价发现bd/bd组小鼠的中毒水平更高,APAP葡糖苷酸水平处于在野生型和ob/ob组小鼠之间。因此,在肥胖及相关代谢紊乱的前提下,APAP诱导的肝损伤更容易发生,且肝脏CYP2E1的诱导可能是重要的致病因素。
营养不良也是DILI发生的潜在危险因素之一,因为体质量严重减轻可能导致药物血液浓度增加[16]。一般来说,严重的体质量减轻会引起黏膜结构和功能的改变,如排除基础疾病的影响,体质量明显减轻往往与肠壁变化有关,如肠壁厚度增加、肠通透性增加、肠蠕动改变、内脏灌注减少和转运蛋白功能受损等[17],这些变化进而可能会影响药物的吸收、生物利用度和清除。如在动物和人类中,营养不良会减少APAP清除而增加总暴露浓度,临床表现为T值增加。此外,APAP相关肝毒性被认为主要是由于特定的反应性代谢物形成引起的。在健康年轻人中,大多数APAP经历II期代谢,与葡萄糖醛酸(约55%)结合并被硫酸酸化(约30%),形成无毒代谢物,并从肾脏排出。一小部分(2%~5%)以APAP原型形式从肾脏排出,其余部分(5%~10%)则通过CYP2E1介导I期代谢,形成反应性和潜在毒性的-乙酰-对苯并醌亚胺(-acetyl-p-benzoquinone imine,NAPQI)[18]。正常情况下,NAPQI会立即与GSH结合,形成无毒的半胱氨酸和巯基代谢产物,并从肾脏排出。然而,长期禁食会引起II期代谢能力降低,诱导APAP更多地转向I期代谢,导致NAPQI的形成增加。一旦GSH储存耗尽,NAPQI则与细胞质和线粒体蛋白结合,导致肝细胞坏死[19]。Ma等[20]也发现与喂养大鼠相比,夜间禁食15 h后,千里光碱对空腹大鼠的肝毒性更明显,能引起血浆ALT活性、胆红素水平显著升高,肝脏组织发生明显变化。毒性动力学研究表明禁食显著增强了CYP450酶介导千里光碱的代谢激活,导致PA-蛋白加合物的形成增加。此外,禁食诱导CYP1A2、CYP2B6和CYP2E1酶参与催化化合物相关反应性吡啶代谢产物生成,显著降低了肝脏GSH的含量,限制了GSH与毒性产物的结合和解毒作用,进一步增强了肝毒性。通过考察生理状态(肥胖、营养不良和长期禁食)对DILI发生的影响,提示未来研究应考察机体不同饮食方式对药物毒性测试、代谢介导毒素对药物风险评估产生的影响,警示患者在临床用药过程中要注意养成正确的饮食习惯。
3 病理状态
中药及其相关产品一直被认为是天然的健康产品,临床上具有显著药效。但近年中药不良反应的报道引起了社会各界广泛关注,而且在中药是否存在肝毒性和药物肝毒性诱导因素等方面存在很多相互矛盾的观点和争论,如最近的热点研究大黄及其主要活性物质大黄素[21-22]。大量证据表明大黄素具有显著的抗炎、抗氧化、抗纤维化和抗糖尿病等作用。Shen等[23]发现C57BL/6小鼠给予大黄素15、30 mg/kg,连续预治疗5 d,能够有效缓解APAP 300 mg/kg对小鼠肝功酶、氧化应激相关生化指标的影响,降低促炎因子水平,抑制NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、α干扰素(interferon-α,IFN-α),环GMP-AMP合成酶(cyclic GMP-AMP synthase,cGAS)及其下游信号效应刺激干扰素基因的表达水平,进而通过抑制炎症反应和细胞凋亡实现肝保护作用。此外,Ruan等[24]发现大黄素10、30 mg/kg能够缓解CCl4诱导的肝脂肪变性,还表现出与调脂效果相关的减肥功效。进一步研究发现大黄素主要通过调节糖、脂和氨基酸代谢,改善小鼠肝脏氧化应激和能量代谢障碍,抑制过度炎症反应,进而实现对CCl4诱导损伤的保护作用。然而,在健康小鼠中,大黄素在高剂量时表现出肝毒性,干扰肝脏抗氧化稳态,尤其是GSH和黄嘌呤代谢。与此相似,在急性和慢性肝炎大鼠模型进行长期毒性实验中研究者证实它在治疗肝炎和肾功能衰竭等方面也能发挥良好作用,但大剂量大黄确实能导致大鼠肝脏和肾脏损害,且肝损伤大鼠对大黄的忍耐度与正常组相比得到显著改善[25]。这恰恰印证了“有故无殒”理论在中医中的应用[26]。此外,临床使用毒性中药是中医药的特色,虽然毒性中药的药效峻烈,使用不当很容易引起明显的不良反应,但是在传统中医药理论指导下,合理使用仍可以正确地用于治疗相应的疾病或证候,最终产生治疗效果而没有任何危险。因此,在探讨药物肝毒性时,单独考虑机体的状态或单独研究中药的肝保护和肝毒性是没有意义的。评价中药肝毒性的关键不仅仅是评价其对正常动物的绝对毒性,还要时刻关注药物作用和疾病症状之间的关系,综合考虑疾病模型中模拟临床情况,研究合理用药的途径和机制。
4 遗传多态性
DILI相关的急性肝衰竭能够引起显著的发病率、高死亡率和高额的医疗保健服务费用。事实上,所有候选药物上市前都要经过严格的体外和体内的临床和非临床试验,以确定其DILI风险。然而,上市药物依然能够引起DILI发生,如曲格列酮和溴芬酸。传统的非临床和临床毒理学研究,主要是采用标准化实验来评价药物所含的固有化学物成分的毒性作用,不能提供可能导致肝毒性药物的完整鉴定,如由于易感因素的个体差异造成的且预测性极低的特异性肝毒性。这种情况下,尽管有明确证据表明该药物存在肝毒性,但影响药物诱导肝毒性易感性差异的因素尚未完全确定,较难预测遗传和环境危险因素复杂交互作用下潜在DILI发生。
顺铂肝毒性的不良反应事件时有报道。对于顺铂肝毒性机制的研究主要集中在其使用方式等方面,如高剂量使用或者低剂量重复使用等。近期,Hwang等[27]将正常大鼠和术后大鼠进行顺铂ig处理,基于肝病理组织结构、肝功能、过氧化氢和P450-2E1水平等相关生化指标,筛选出对顺铂肝损伤作用敏感组和和拮抗组。RNA序列分析发现2组之间存在161个差异表达基因,尤其是碳分解代谢物阻遏4样蛋白(carbon catabolite repression 4 like,Ccrn4l)在顺铂处理之前都会出现遗传性的下降,在敏感组小鼠处理前、后都维持着较低的表达水平,并伴随着抗氧化水平,硝化水平降低和凋亡增加,且Ccrn4l敲出能够促进顺铂诱导的大鼠肝上皮样干细胞WB-F344线粒体凋亡。因此,遗传性的个体肝脏Ccrn4l水平能够成为影响顺铂诱导肝毒性个体差异的新生物因子,而这可能是通过调节线粒体和抗氧化功能实现的。
GSTs是一个具有多基因性质的同工酶复合体的超家族。在人体肝脏中表达水平较高且胞质GSTs含有Mu、Theta、Pi、Sigma、Omega、Alpha和Zeta等同工酶。它们的主要功能是在II期代谢反应中催化GSH与几种分子结合,包括异烟肼代谢和肝毒素的有毒中间体,而GST Mu(M1)、Theta(T1)和Pi(P1)的基因型或多态性缺陷有助于增加对各种疾病的易感性。Chbili等[28]采用临床随机对照实验,发现GSH硫转移酶M1(glutathione-transferase mu1,GSTM1)和GSH硫醇转移酶(glutathione-transferase-theta,GSTT1)纯合子空基因型与抗结核药物性肝损害(antituberculosis drug-induced hepatotoxicity,ATDH)风险之间无统计学意义,但GSTM1和GSTT1双空基因型与ATDH风险之间存在统计学意义,证实了突尼斯人群中GSTM1和GSTT1的双重缺失可能会导致ATDH的发生。此外,与野生型和A向G(AA+AG)基因型转化相比,GSH-转移酶P1(glutathione-transferase P1,GSTP1)中GG纯合突变型的分布与ATDH显著相关,因此,GSTP1 rs1695(A>G)基因分型可预测ATDH的易感性。
CAT是一种催化H2O2分解的酶,在细胞抗氧化防御机制中发挥着重要作用。无过氧化氢酶血症是由过氧化氢酶基因的遗传缺陷引起的。人失弛缓症患者能够清除生理性H2O2,但易受外源性氧化应激损伤。基于此,Ogino等[29]发现在遗传缺陷小鼠模型中,APAP能够引起GSH显著降低,且在模型小鼠中持续时间更长。此外,野生型小鼠肝脏中谷氨酸-半胱氨酸连接酶(一种GSH合成酶)亚基在APAP作用下表达增加,而模型小鼠肝脏中相应的蛋白水平进一步降低。
遗传多态性是临床上DILI发生中最难以预测和把控的因素之一。因此,在未来分子生物技术快速发展的前提下,希望能够基于广泛遗传变异因子的生物数据信息实现不同结构药物靶向性遗传变异因子的准确预测,进而减少特异性DILI的发生[30]。
5 性别
生物性别是肝脏疾病的一种重要调节因子[31]。性别二态性能够影响疾病进展和治疗、药效学和药物不良反应、药物和机体作用过程中分子水平的变化。汞离子在肝脏中的蓄积能够引起肝损伤,而有机阴离子转运蛋白3(organic anion transporter 3,OAT3)和多药耐药相关蛋白2(multidrug resistance protein 2,MRP2)可以参与肝脏对毒素和药物的排泄以及肝脏对汞的处理。Hazelhoff等[32]发现HgCl2对雌性动物的肝脏毒性要明显比雄性严重,而这种性别差异可以归咎于雄性动物肝脏中OAT蛋白表达水平的显著降低,进而阻止汞离子在雌性动物肝脏体内的高浓度蓄积状态。Wang等[33]发现黄药子能够引起肝ALT、AST、肝过氧化脂质(lipid peroxidation,LPO)水平升高,而GSH、GST、SOD和CAT活性呈时间依赖性降低,且雌性小鼠的ALT和门冬氨酸氨基转氨酶(aspartate aminotransferase,AST)活性明显低于雄性小鼠。同时,雌鼠给药12 h后肝脏GSH和CAT活性均高于雄鼠。
-3多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)与各类型肝脏损伤进展密切相关。Liu等[34]发现内源性和外源性-3 PUFAs均能显著加重APAP诱导的雄性小鼠肝损伤,而在雌性小鼠中则有相反的作用。进一步研究表明,雌激素参与了-3 PUFAs对APAP过量剂量调控的性别差异,且主要与不同性别小鼠肝脏中-3 PUFA介导氧化应激反应和自噬调节密切相关。此外,β-连环蛋白(β-catenin)信号激活、表观遗传酶也与-3 PUFAs对APAP肝毒性的调节有关。Huang等[35]发现X染色体三角形四肽重复蛋白(ubiquitously transcribed tetratricopeptide repeat on chromosome X,UTX)和X-链接组蛋白去甲基酶,在APAP过量处理的雌性小鼠肝脏中被显著诱导。雌性小鼠肝脏中UTX缺失可抑制APAP过量诱导的肝毒性,但雄性小鼠无相似效果。RNA测序分析表明,雌性小鼠UTX缺失可上调抗毒II期结合酶,包括磺基转移酶家族2A成员1(sulfotransferase family 2A member 1,Sult2a1),同时通过下调内质网应激基因转录激活因子4、转录激活因子4和同源蛋白的转录来缓解内质网应激,进而缓解APAP的肝损伤效果。
临床上酒精使用与肝脏相关疾病的发生密切相关。核受体孕X受体(pregnane X receptor,PXR)是一种广谱特异性传感器,对有毒物质有特异性反应。Spruiell等[36]通过分析转基因雄性和雌性小鼠急性ig乙醇4.5 g/kg的反应,发现雌性小鼠肝脏中乙醇脱氢酶1和乙醛脱氢酶2的基础蛋白表达水平均较高。因此,雌性小鼠比雄性小鼠可以更有效地消除乙醇,从而减轻急性乙醇肝毒性。
性别差异也是大黄引起肝毒性的原因之一。Wu等[37]发现大黄素对雌性动物组织结构和生化指标等方面的毒性作用显著高于雄性。同时,大黄素的毒代动力学参数也存在显著的性别差异。与雌性组相比,雄性老鼠肝脏和体外细胞中MRP2水平显著增加,这可能是由于尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyl transferase 2B7,UGT2B7)和MRP2发生偶联,加速了大黄素的代谢,消除大黄素在肝脏蓄积。
基于以上内容,建议将性别二态性作为重点考察因素纳入药物安全性评价范围,关注重点是药物对雌性的不良反应。
6 年龄
除性别、药物特征和遗传多态性之外,年龄也是DILI的危险因素[38-39]。年龄能够影响肝脏药物代谢[40]和抗氧化防御系统[41-42],进而引起不同年龄段的DILI发生率。如研究报道儿童对DILI的敏感性要低于成年人,同时也有研究发现儿童发生DILI的比率不足10%,但是死亡率却为4%~31%。这可能是由于儿童发育不成熟,导致其对药物的肝脏响应与成年人显著不同[43-44]。然而,相反证据表明儿童受丙硫氧嘧啶和丙戊酸诱导肝损伤的风险要比成年人受相似损伤的风险要高[45]。此外,Jeong等[46]采用2周断奶小鼠和8周成年雄性小鼠进行CCl4注射,发现幼龄小鼠的肝损伤水平比成年小鼠严重的多,肝功能及氧化应激损伤等生化指标影响显著,组织中细胞凋亡蛋白明显升高。据查阅,年龄因素也是大黄肝毒性的重要影响因素之一。老年患者的药物不良反应发生率通常高于年轻患者[47]。当给予相同剂量大黄时,未成熟大鼠没有出现死亡现象,而近1/5的老龄大鼠死亡。与未成熟小鼠相比,老龄大鼠ig高剂量(40 g/kg)大黄偶尔出现肝细胞坏死和胆道增生,白细胞介素-6和白细胞介素-8剂量相关性升高。此外,Schulte等[48]发现临床上使用培门冬酶治疗白血病时引起的肝损伤作用及损伤强度呈现明显的年龄差异性,与年轻患者相比,老年患者在诱导治疗中患高胆红素血症和转氨酶的风险更高。因此,儿童和老年人是DILI的高危人群。但是,目前关于年龄对DILI影响的研究多关注于临床现象,尚需要对其深入机制进行探讨和研究。因此,在临床前研究中建议增加不同模型的年龄这个考察因素;在药物研发过程中要考虑前瞻性试验设计,重点关注这些人群对药物的耐受性,甚至规定专门的使用建议或药物说明书,建立潜在肝保护的干预措施。
7 结语
天然产物一直是新药发现的重要来源,而中草药是天然产物的重要组成部分。随着中药现代化进程的发展,中药及其相关膳食补充剂产品的应用越来越广泛。然而,中药在对人体健康大有裨益的同时,其不良反应也逐渐成为一个不容忽视、引人注目的话题。尤其是大多数的传统中药,在临床上具有显著的肝保护作用,但近年来,何首乌、山药、雷公藤等中药肝毒性的出现和报道,引起社会的广泛关注和强烈的社会舆论。因此,全面了解和研究潜在毒性药物的药效和肝毒性,对指导临床用药具有重要意义。
大多数研究主要是从中药或复方中固有活性物质、临床使用方式等角度切入,针对药物的本质性肝毒性进行筛选和评价。这种模式确实能提供大多数药物的安全性信息,但是往往忽略了机体因素对药物在体内生物过程的影响。随着现代生活习惯和方式、环境以及疾病图谱的改变,中药传统应用方式和范围的扩展和改变,药物在体内的生物过程也会发生显著变化。如隔日禁食目前已经成为一种短期安全有效的体质量管理和降低代谢性疾病风险的干预手段,研究表明该行为在一定程度上通过多种途径来改善健康、非肥胖人群的衰老生理和分子标记,进而发挥对代谢紊乱的保护作用[49]。但是该模式却能增加肝脏CYPs介导的一些毒性产物的代谢激活和抑制GSH偶联解毒途径。同理,疾病状态、酗酒、性别差异引起的激素水平差异等因素均能够直接或间接的引起药物在体内的代谢过程,进而引起不同的生物效应。因此,对于这些毒素/药物的毒性测试和/或风险评估,应特别注意药物自身性质评价与不同状态动物获得的毒理学数据相结合,充分考察不同因素对评价结果的影响,进而传递到人类临床评价和和安全使用。
本研究从机体的角度出发,总结了DILI发生的常见影响因素,旨在警示药物研发过程中要更多关注以上因素对药物安全性的影响,提醒患者在日常使用药物过程中要密切关注自身的状态,以期为更好的临床合理安全应用、未来临床监测和临床研究提供理论参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Hoofnagle J H, Björnsson E S. Drug-induced liver injury-types and phenotypes [J]., 2019, 381(3): 264-273.
[2] DiMasi J A, Feldman L, Seckler A,. Trends in risks associated with new drug development: Success rates for investigational drugs [J]., 2010, 87(3): 272-277.
[3] DiMasi J A, Grabowski H G, Hansen R W. Innovation in the pharmaceutical industry: New estimates of R&D costs [J]., 2016, 47: 20-33.
[4] 李芝奇, 赵霞, 徐玥, 等. 中药肝毒性评价的现状与挑战 [J]. 中华中医药杂志, 2020, 35(10): 4827-4835.
[5] 李芝奇, 范琦琦, 陈美琳, 等. 中药肝毒性的物质基础与作用机制研究进展 [J]. 中草药, 2021, 52(13): 4082-4095.
[6] He Y S, Long Y, Zhang C Y,. Dietary alcohol exacerbates the hepatotoxicity induced by pyrrolizidine alkaloids: Hazard from food contamination [J]., 2022, 424(Pt D): 127706.
[7] Louvet A, Ntandja Wandji L C, Lemaître E,. Acute liver injury with therapeutic doses of acetaminophen: A prospective study [J]., 2021, 73(5): 1945-1955.
[8] Lee W M, Kaplowitz N. Alcohol, fasting, and therapeutic dosing of acetaminophen: A perfect storm [J]., 2021, 73(5): 1634-1636.
[9] Chou Y T, Sun Z J, Shen W C,. Cumulative betel quid chewing and the risk of significant liver fibrosis in subjects with and without metabolic syndrome [J]., 2022, 9: 765206.
[10] Dosumu O A, Rotimi S O, Adeleye O O,. Vitamin K protects against 7,12-dimethylbenz (A) anthracene induced hepatotoxicity in Wistar rats [J]., 2021, 36(3): 362-373.
[11] Ibrahim M A, Ibrahim H M, Mohamed A A,. Vitamin E supplementation ameliorates the hepatotoxicity induced by tramadol: Toxicological, histological and immunohistochemical study [J]., 2020, 30(3): 177-188.
[12] Abd El-Haleim E A, Sallam N A. Vitamin D modulates hepatic microRNAs and mitigates tamoxifen-induced steatohepatitis in female rats [J]., 2022, 36(2): 338-349.
[13] El-Boshy M, Refaat B, Almaimani R A,. Vitamin D 3 and calcium cosupplementation alleviates cadmium hepatotoxicity in the rat: Enhanced antioxidative and anti-inflammatory actions by remodeling cellular calcium pathways [J]., 2020, 34(3): e22440.
[14] Chomchai S, Chomchai C. Being overweight or obese as a risk factor for acute liver injury secondary to acute acetaminophen overdose [J]., 2018, 27(1): 19-24.
[15] Aubert J, Begriche K, Delannoy M,. Differences in early acetaminophen hepatotoxicity between obese ob/ob and db/db mice [J]., 2012, 342(3): 676-687.
[16] Achterbergh R, Lammers L A, Kuijsten L,. Effects of nutritional status on acetaminophen measurement and exposure [J]., 2019, 57(1): 42-49.
[17] Vinarov Z, Abdallah M, Agundez J A G,. Impact of gastrointestinal tract variability on oral drug absorption and pharmacokinetics: An UNGAP review [J]., 2021, 162: 105812.
[18] Flint R B, Mian P L, van der Nagel B,. Quantification of acetaminophen and its metabolites in plasma using UPLC-MS: Doors open to therapeutic drug monitoring in special patient populations [J]., 2017, 39(2): 164-171.
[19] Zillen D, Movig K L L, Kant G,. Impact of malnourishment on the pharmacokinetics of acetaminophen and susceptibility to acetaminophen hepatotoxicity [J]., 2021, 9(11): e04611.
[20] Ma J, Zhang C Y, He Y S,. Fasting augments pyrrolizidine alkaloid-induced hepatotoxicity [J]., 2022, 96(2): 639-651.
[21] Lin L F, Liu Y L, Fu S,. Inhibition of mitochondrial complex function-the hepatotoxicity mechanism of emodin based on quantitative proteomic analyses [J]., 2019, 8(3): 263.
[22] Sougiannis A T, Enos R T, VanderVeen B N,. Safety of natural anthraquinone emodin: An assessment in mice [J]., 2021, 22(1): 9.
[23] Shen P, Han L, Chen G,. Emodin attenuates acetaminophen-induced hepatotoxicity via the cGAS-STING pathway [J]., 2022, 45(1): 74-87.
[24] Ruan L Y, Jiang L, Zhao W L,. Hepatotoxicity or hepatoprotection of emodin? Two sides of the same coin by1H-NMR metabolomics profiling [J]., 2021, 431: 115734.
[25] Wang J B, Zhao Y L, Xiao X H,. Assessment of the renal protection and hepatotoxicity of rhubarb extract in rats [J]., 2009, 124(1): 18-25.
[26] 夏青, 韩利文, 张云, 等. 基于斑马鱼模型的柴胡皂苷a保肝作用与肝毒性研究 [J]. 中国中药杂志, 2019, 44(13): 2662-2666.
[27] Hwang D B, Won D H, Shin Y S,. Ccrn4l as a pre-dose marker for prediction of cisplatin-induced hepatotoxicity susceptibility [J]., 2020, 148: 128-139.
[28] Chbili C, Fathallah N, Laadhari C,. Glutathione--transferase genetic polymorphism and risk of hepatotoxicity to antitubercular drugs in a North-African population: A case-control study [J]., 2022, 809: 146019.
[29] Ogino N, Nagaoka K, Tomizuka K,. Compromised glutathione synthesis results in high susceptibility to acetaminophen hepatotoxicity in acatalasemic mice [J]., 2021, 156: 112509.
[30] 柏兆方, 高源, 王伽伯, 等. 中药特异质肝损伤评价及风险防控对策研究 [J]. 药学进展, 2020, 44(10): 724-729.
[31] Lefebvre P, Staels B. Hepatic sexual dimorphism-implications for non-alcoholic fatty liver disease [J]., 2021, 17(11): 662-670.
[32] Hazelhoff M H, Torres A M. Gender differences in mercury-induced hepatotoxicity: Potential mechanisms [J]., 2018, 202: 330-338.
[33] Wang J M, Liang Q N, Ji L L,. Gender-related difference in liver injury induced byL. rhizome in mice [J]., 2011, 30(9): 1333-1341.
[34] Liu Y, Chen Y, X Xie,. Gender difference on the effect of omega-3 polyunsaturated fatty acids on acetaminophen-induced acute liver failure [J]., 2020: 8096847.
[35] Huang Y X, Xie Y H, Yang D,. Histone demethylase UTX aggravates acetaminophen overdose induced hepatotoxicity through dual mechanisms [J]., 2022, 175: 106021.
[36] Spruiell K, Gyamfi A A, Yeyeodu S T,. Pregnane X receptor-humanized mice recapitulate gender differences in ethanol metabolism but not hepatotoxicity [J]., 2015, 354(3): 459-470.
[37] Wu L L, Han W C, Chen Y L,. Gender differences in the hepatotoxicity and toxicokinetics of emodin: The potential mechanisms mediated by UGT2B7 and MRP2 [J]., 2018, 15(9): 3931-3945.
[38] Chalasani N, Björnsson E. Risk factors for idiosyncratic drug-induced liver injury [J]., 2010, 138(7): 2246-2259.
[39] George N, Chen M J, Yuen N,. Interplay of gender, age and drug properties on reporting frequency of drug-induced liver injury [J]., 2018, 94: 101-107.
[40] Ferguson G, Bridge W. Glutamate cysteine ligase and the age-related decline in cellular glutathione: The therapeutic potential of γ-glutamylcysteine [J]., 2016, 593: 12-23.
[41] Parkinson A, Mudra D R, Johnson C,. The effects of gender, age, ethnicity, and liver cirrhosis on cytochrome P450 enzyme activity in human liver microsomes and inducibility in cultured human hepatocytes [J]., 2004, 199(3): 193-209.
[42] Xu S F, Hou D S, Liu J,. Age-associated changes in GSH S-transferase gene/proteins in livers of rats [J]., 2018, 23(1): 213-218.
[43] Lu Y, Zhang C, Chen Y H,. Immature mice are more susceptible than adult mice to acetaminophen-induced acute liver injury [J]., 2017, 7: 42736.
[44] Faa G, Ekstrom J, Castagnola M,. A developmental approach to drug-induced liver injury in newborns and children [J]., 2012, 19(27): 4581-4594.
[45] Shi Q, Yang X, Greenhaw J J,. Drug-induced liver injury in children: Clinical observations, animal models, and regulatory status [J]., 2017, 36(5): 365-379.
[46] Jeong T B, Kwon D, Son S W,. Weaning mice and adult mice exhibit differential carbon tetrachloride-induced acute hepatotoxicity [J]., 2020, 9(3): 201.
[47] Ventura M T, Boni E, Cecere R,. Importance of hypersensitivity in adverse reactions to drugs in the elderly [J]., 2018, 16: 7.
[48] Schulte R, Hinson A, Huynh V,. Levocarnitine for pegaspargase-induced hepatotoxicity in older children and young adults with acute lymphoblastic leukemia [J]., 2021, 10(21): 7551-7560.
[49] Wang X, Lv W, Xu J,. Hepatic suppression of mitochondrial complex II assembly drives systemic metabolic benefits [J]., 2022, 9(9): e2105587.
Research progress on discussion of factors influencing drug-induced liver injury based on organismal status and function
CAI Qiong1, YANG Xing-yue3, LI Zhi-qi1, FAN Qi-qi1, CHEN Mei-lin1, DAI Sheng-yun2, LIN Rui-chao1, ZHAO Chong-jun1
1. Beijing Key Laboratory for Quality Evaluation of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China 2. China National Institute for Food and Drug Control, Beijing 102629, China 3. Beijing University of Chinese Medicine, Beijing 102488, China
Drug-induced liver injury (DILI) is a major cause of acute liver failure and drug withdrawal from the market. Numerous studies have been conducted to investigate DILI in depth in terms of the physicochemical properties,metabolism and mechanism of action of drugs, providing sufficient biological information for drug development. Even so, incidents of DILI, especially herbal-induced liver injury, continue to occur. The interaction and effect of organism and drug is the main factor in the occurrence of DILI. Therefore, the effects of different influencing factors, such as lifestyle habits, physiopathological status, age, genetic differences, gender, etc. on DILI from the perspectives of clinical patients and experimental animals were systematically collected and analyzed in this paper, and the relationship between them and DILI was evaluated, in order to provide a reference for the improvement of systematic safety evaluation techniques and methods of traditional Chinese medicine and the safe use of traditional Chinese medicine in the future.
traditional Chinese medicine; hepatotoxicity; organismal function; lifestyle; pathological and physiological conditions; age; genetic differences; sex differences
R285.53
A
0253 - 2670(2022)17 - 5523 - 08
10.7501/j.issn.0253-2670.2022.17.030
2022-05-30
国家科技重大专项(2018ZX09735005);公益性行业科研专项(2015070042);北京中医药大学新教师启动基金资助项目(2020-JYB-XJSJJ-009)
蔡 琼(1999—),女,本科,研究方向为中药安全性评价。E-mail: xqiongc@163.com
赵崇军(1988—),男,助理研究员,研究方向为中药安全性评价及主要活性/毒性物质基础筛选。E-mail: 1014256537@qq.com
林瑞超(1954—),教授,研究方向为中药品质评价。E-mail: linrch307@sina.com
[责任编辑 崔艳丽]

