人参内生真菌Aspergillus terreus RSB2007的次生代谢产物的研究
张 红,毛伟业,郑彬玥,刘 霞,金 璐,李圣宇,傅惠英, *,寿旗扬, *
•化学成分 •
人参内生真菌RSB2007的次生代谢产物的研究
张 红1,毛伟业2,郑彬玥2,刘 霞1,金 璐1,李圣宇1,傅惠英1, 2*,寿旗扬1, 2*
1. 浙江中医药大学附属第二医院,浙江 杭州 310005 2. 浙江中医药大学药学院,浙江 杭州 310053
研究人参内生真菌RSB2007次生代谢产物的化学成分,以期发现新的化合物。该菌大米固体发酵的醋酸乙酯提取物经硅胶、Sephadex LH-20及HPLC等多种色谱技术进行分离纯化,并根据核磁共振谱、质谱、圆二色谱(electronic circular dichroism,ECD)以及计算ECD等方法鉴定化合物的结构。从人参内生真菌RSB2007发酵产物中初步分离鉴定了4个化合物,分别鉴定为7,8′-二羟基-3,4,6-三甲基-7′-苯基-1,3,4,7′-四氢-2-吡喃并[2,3,4-de]色烯-8′-羧酸盐(1)、butyrolactone II(2)、aspernolide A(3)和versicolactone B(4)。化合物1为新的聚酮类化合物,命名为曲霉酮A。
人参;内生真菌;次生代谢产物;聚酮;曲霉酮A
人参C. A. Meyer是五加科人参属多年生草本植物,是吉林省道地药材,以干燥根及根茎入药,《神农本草经》记载:“主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智,久服轻身延年”,具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智等功效,药用价值极高。人参主要化学成分有皂苷、多糖、挥发油、生物碱、黄酮类和甾醇类等[1],人参皂苷和人参多糖是主要药理活性成分,具有抗肿瘤、抗心肌缺血、提高免疫力、降血糖、抗衰老等作用[2]。国内外学者对人参开展了大量研究,主要聚焦于化学成分及药理作用[3]、内生菌多样性及可利用菌株筛选[4]、人参质量标准[5]等方面。人参种植品现已被批准为新资源食品[6],人参根的市场价值受其大小、形状和整体外观影响[7],一般种植4~6年的人参根即可出售。
人参内生真菌是存活于人参组织的不会造成明显症状的真菌,生态系统中真菌与宿主建立了和谐的生态系统并彼此受益,内生真菌可提高宿主的抗病能力和逆境胁迫能力。从人参植株各部位分离鉴定出数量众多的内生真菌,孙剑秋[8]从5年生人参植株中分离出311株内生真菌;明乾良等[9]从5年生园参及15年移山参中得到48株内生真菌;张薇[10]从3~5年生的人参根部分离得到内生真菌30株;Park等[11-12]从人参根部得到共119株内生真菌。这些研究者们都对其分离得到的内生真菌进行了分析与归类。人参内生真菌不仅具有多样性,且次生代谢过程产生多种抗菌[13]、抗肿瘤[14]和抗炎[15]等的生物活性物质;另外,人参内生真菌可产生与人参相同或相近的活性次生代谢产物[16],内生真菌活性产物产量上的差异会影响到植物组织中活性物质的含量,使不同地区人参药材质量存在差异。
本实验对人参根部分离出的1株曲霉属真菌RSB2007进行次生代谢产物的研究。曲霉属sp是丛梗孢目丛梗孢科的一个大属,是最常见且具有重要经济价值的真菌之一,广泛应用于生物工程研究、传统酿造业和现代发酵业等[17]。sp代谢产物类型丰富,代谢途径多样,常见的代谢产物有聚酮、生物碱、肽类和萜类等,其中一些结构新颖的化合物具有细胞毒、抗菌、抗炎、抗病毒等多种生物活性。对RSB2007进行大米固体发酵,醋酸乙酯超声提取得到总浸膏。综合利用硅胶柱色谱、凝胶Sephadex LH-20柱色谱和HPLC制备等方法对其进行分离纯化,从该菌中初步分离得到4个化合物,通过红外、紫外、核磁共振谱、圆二色谱(electronic circular dichroism,ECD)和计算ECD等技术鉴定出化合物的结构,包括1个聚酮(1)和3个aspernolide类型的丁内酯(2~4),分别为7,8′-二羟基-3,4,6-三甲基-7′-苯基-1,3,4,7′-四氢-2-吡喃并[2,3,4-de]色烯- 8′-羧酸盐(7,8′-dihydroxy-3,4,6-trimethyl-7′-phenyl- 1,3,4,7′-tetrahydro-2-pyrano[2,3,4-de] chromene-8′- carboxylate,1)、butyrolactone II(2)、aspernolide A(3)和versicolactone B(4)。其中聚酮类化合物1为新化合物,命名为曲霉酮A。
1 仪器与材料
1.1 仪器
Agilent 1260型高效液相色谱仪(美国Agilent公司);半制备型YMC C18色谱柱(250 mm×10 mm,5 μm;博纳艾杰尔科技有限公司);Bruker AV III-600型核磁共振波谱仪(德国Bruker公司);LDZX-40B1型电热压力蒸汽灭菌锅(上海申安器械厂);MJ-2502-I型霉菌培养箱(上海一恒科学仪器有限公司);ZHWY211B型摇床(上海智城分析仪器制造有限公司);旋转蒸发仪(日本东京EYELA公司);UV-2401A型紫外分光光度计(日本岛津股份有限公司);Nicolet IS50型光谱仪(美国赛默飞世尔科技有限公司);JASCO J-810型圆二色光谱仪(日本分光株式会社);Waters SYNAPT G2-Si质谱仪(美国沃特世科技有限公司)。
1.2 试剂与材料
柱色谱硅胶(100~200、300~400目,青岛海洋化工厂);Sephadex LH-20葡聚糖凝胶(日本GE医疗集团)。甲醇(色谱级,美国Tedia公司);石油醚、醋酸乙酯、甲醇(分析纯,广东光华科技有限公司)。马铃薯葡萄糖琼脂培养基(PDA,杭州百思生物技术有限公司);马铃薯葡萄糖培养基(PDB,杭州百思生物技术有限公司),真菌培养基(青岛高科技工业园海博生物技术有限公司)。
1.3 菌株来源
本研究所用的菌株是2020年9月从吉林长白山区5年生园参C. A. Meyer植物根茎中分离所得,由浙江天科高新技术发展有限公司(原浙江省微生物研究所)王庭璋副研究员鉴定为人参内生真菌土曲霉(GenBank序列号MG991569.1)。该菌株菌落土黄色,在PDA 平板上生长较快;菌丝灰白色,有膈膜;分生孢子近球形,壁光滑;储存于浙江中医药大学第二临床医学院中心实验室。
2 方法
2.1 菌株分离纯化
用清水洗净新鲜人参根的表面,在生物安全柜中依次用0.3%次氯酸钠溶液和75%乙醇进行表面消毒1 min,用无菌水反复冲洗后,用灭菌小刀将根茎切成薄片,接种于双抗PDA培养基上,倒置于28 ℃恒温培养箱中培养,待各组织切面出菌落后于PDA培养基中纯化保存。
2.2 菌株发酵
挑取适量菌丝接种至装有200 mL PDB的锥形瓶中,在恒温培养摇床中培养5 d(20 ℃、130 r/min),得到菌株种子液。将等量种子液接种至无菌大米培养基(80 g/瓶)中,共培养50瓶,室温下发酵30 d。
2.3 菌株发酵物分离
发酵物用醋酸乙酯提取3次,提取液合并浓缩得到粗提物40 g,粗提物经硅胶柱色谱,石油醚-醋酸乙酯(100∶0~0∶1)梯度洗脱,经HPLC分析后合并,共得到6个组分(Fr. 1~6)。Fr. 4(100∶10部分,8.9 g)经Sephadex LH-20得到8个组分Fr. 4.1~4.8。Fr. 4.5经过半制备型HPLC(YMC C18柱,75%甲醇-水,体积流量3.0 mL/min)分离纯化,得到化合物1(R=15.3 min,4.1 mg);Fr. 4.3经过半制备型HPLC(YMC C18柱,70%甲醇-水,体积流量3.0 mL/min)分离纯化,得到化合物2(R=29.5 min,2.5 mg)、3(R=34.1 min,4.2 mg)。Fr. 4.4经过半制备型HPLC(YMC C18柱,70%甲醇-水,体积流量3.0 mL/min)分离纯化,得到化合物4(R=26.9 min,3.5 mg)。
3 结构鉴定
表1 化合物1的核磁共振数据(600/150 MHz, DMSO-d6)
Table 1 1H- and 13C-NMR data of compound 1 (600/150 MHz, DMSO-d6)
碳位δHδC 14.83 (d, J= 11.2 Hz)70.6 33.51 (qd, J= 6.2, 6.4 Hz)78.6 42.71 (qd, J= 6.8, 6.8 Hz)37.7 5 138.7 6 115.1 7 156.2 7-OH9.32 (s) 86.18 (s)99.9 9 147.5 10 112.7 111.08 (d, J= 6.1 Hz)22.0 121.13 (d, J= 6.8 Hz)20.0 132.00 (s)11.5 1′ 136.8 2′, 6′7.33 (m)130.0 3′, 5′7.24 (m)128.3 4′7.28 (m)127.6 7′3.10 (d, J= 11.2 Hz)50.5 8′ 98.7 8′-OH7.74 (s) 9′ 169.0 9′-OCH33.57 (s)52.8

图1 化合物1的结构及主要HMBC、1H-1H COSY和ROESY相关
在NOESY相关谱中,H-3/H3-12, H-4/H3-11, H-1/H-3, H-1/H-2′相关,H-6′/OCH3-9′相关表明H-1, H-4, CH3-11, H-2′和8′-OH位于环系的同侧,而CH3-12, H-3, H-7′和9′-OCH3位于环系的另一侧。经查阅文献报道[18],化合物1的平面结构与penicitrinol P相比,C-7′处多了个苯环,因而多了1个手性碳。通过计算ECD的方法对化合物1的绝对构型进行确证,采用TDDFT和B3LYP/6-311++G(2d, p) 法对化合物1进行ECD计算,计算ECD谱图与实测ECD谱图基本吻合(图2),因此,该化合物的绝对构型确定为1,3,4,7′,8′。经文献调研,化合物1为新化合物,命名为曲霉酮A。
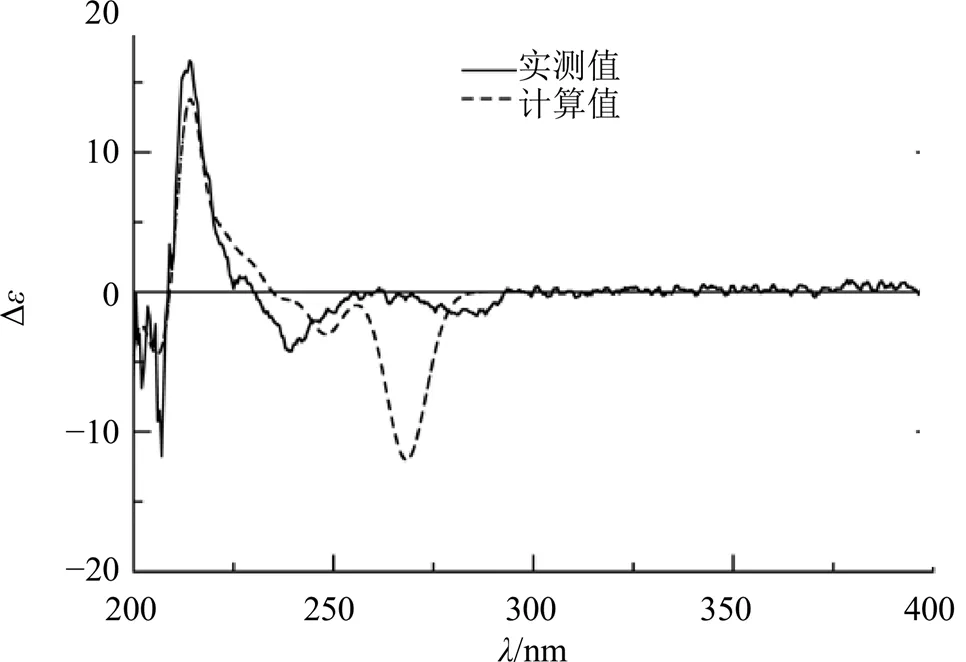
图2 化合物1的实测与计算ECD谱图
化合物2:淡黄色无定形粉末(甲醇);1H-NMR (600 MHz, CD3OD):7.60 (2H, d,= 8.5 Hz, H-2′′, 6′′), 6.91 (2H, d,= 8.5 Hz, H-3′, 5′), 6.68 (2H, d,= 8.2 Hz, H-2′, 6′), 6.53 (2H, d,= 8.2 Hz, H-3′′, 5′′), 3.82 (3H, s, 5-OCH3), 3.48 (2H, s, H-6);13C-NMR (150 MHz, CD3OD):171.7 (C-5), 170.2 (C-1), 159.4 (C-4′), 157.6 (C-4′′), 139.9 (C-2), 132.4 (C-2′, 6′) 130.3 (C-2′, 6′′), 129.2 (C-1′′), 125.4 (C-1′), 123.0 (C-3), 116.5 (C-3′, 5′), 115.5 (C-3′′, 5′′), 86.7 (C-4), 53.7 (OCH3), 39.4 (C-6)。以上波谱数据与文献报道基本一致[19],故鉴定化合物2为butyrolactone II。
化合物3:白色无定形粉末(甲醇);1H-NMR (600 MHz, CDCl3):1.27 (3H, s, Me-4′′′, 5′′′), 1.71 (1H, t,= 6.6 Hz, H-2′′′), 2.57 (2H, m, H-1′′′), 3.50 (2H, m, H-2′′′), 3.81 (1H, d,= 15.5 Hz, H-6a), 6.69 (1H, d,= 8.1 Hz, H-5′′), 6.52 (1H, d,= 8.4 Hz, H-3′, 5′), 6.92 (2H, d,= 8.1 Hz, H-6′′, 2′′), 7.62 (1H, d,= 7.0 Hz, H-2′, 6′);13C-NMR (150 MHz, CDCl3): 169.9 (C-1), 169.5 (C-5), 156.7 (C-3), 153.2 (C-4′′), 131.7 (C-2′, 6′), 129.7 (C-2′′), 129.3 (C-2), 128.3 (C-1′′), 123.7 (C-6′′), 122.4 (C-1′), 120.6 (C-3′′), 116.8 (C-5′′), 116.2 (C-3′, 5′), 86.4 (C-4), 74.5 (C-3′′′), 53.7 (OCH3), 38.8 (C-2′′′), 32.8 (C-6), 26.9 (C-4′′′, 5′′′), 22.3 (C-1′′′)。以上波谱数据与文献报道基本一致[20],故鉴定化合物3为aspernolide A。
化合物4:白色粉末(甲醇);1H-NMR (600 MHz, CDCl3): 7.66 (2H, d,= 7.5 Hz, H-2′, 6′), 7.45 (2H, d,= 7.2 Hz, H-3′, 5′), 7.42 (1H, t,= 7.0 Hz, H-4′), 6.58 (1H, d,= 8.0 Hz, H-6′′), 6.54 (1H, d,= 8.0 Hz, H-5′′), 6.47 (1H, brs, H-2′′), 5.11 (1H, m, H-8′′), 3.81 (3H, s, 6-OCH3), 3.56 (1H, d,= 14.5 Hz, H-5), 3.50 (1H, d,= 14.5 Hz, H-5), 3.13 (2H, d,= 7.7 Hz, H-7′′), 1.70 (3H, s, H-11′′) 1.66 (3H, s, H-10′′);13C-NMR (150 MHz, CDCl3):169.6 (C-6), 169.0 (C-1), 153.6 (C-4′′), 138.8 (C-2), 134.9 (C-9′′), 132.2 (C-2′′), 129.8 (C-1′), 129.6 (C-6′′), 129.5 (C-4′), 129.3 (C-3′, C-5′), 127.9 (C-2′, 6′), 127.6 (C-3), 126.4 (C-3′′), 124.9 (C-1′′), 121.7 (C-8′′), 115.5 (C-5′′), 86.4 (C-4), 53.6 (6-OCH3), 38.5 (C-5), 29.5 (C-7′′), 25.8 (C-11′′), 17.7 (C-10′′)。以上波谱数据与文献报道基本一致[21],故鉴定化合物4为versicolactone B。
4 讨论
本实验对人参内生真菌RSB2007的次生代谢产物的化学成分进行研究,运用多种分离纯化和鉴定技术,初步从RSB2007的次生代谢产物中分离得到4个化合物,其中化合物1是新的聚酮类化合物,化合物2~4是次生代谢产物中常见的3个丁内酯化合物。经活性测试,化合物1对人肝癌HepG2细胞没有明显的细胞毒性。经查阅文献,化合物2~4的生物活性研究较多。有研究表明,化合物2(butyrolactone II)抑菌活性强于阿卡波糖[22],具有较强的NO抑制活性[23],且对胆管癌CCA细胞系的细胞毒性较弱[24];化合物3(aspernolide A)在时间和剂量相关性上抑制人喉癌Hep-2和TU212细胞的增殖且其凋亡机制可能与信号转导和转录激活因子(signal transducer and activator of transcription 3,3STAT3)信号通路有关[25],而且可较强的抑制脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞产生NO的水平[23],对DPPH的抑制活性在5.89~10.07 μmol/L,对4种细菌表现出中等的抑菌活性[26],Chen等[27]测试了化合物的抗病毒活性并首次报道了化合物3对单纯疱疹病毒1型(HSV-1)有明显的抗病毒活性,IC50值为(28.9±0.8)μmol/L,防污生物活性测定结果表明该化合物对藤壶幼虫的附着具有较强的抗附着活性,半数效应浓度(median effective concentration,EC50)为(7.4±0.6)μmol/L[27]。化合物4对PANC-1细胞株有较强的细胞毒作用,IC50值为9.4 μmol/L,其通过诱导S期阻滞抑制PANC-1细胞增殖,有望开发为治疗胰腺导管腺癌的抗癌药物[28]。本研究丰富了对次生代谢产物的认识,后续会展开对该菌株中聚酮类成分的进一步分离,该研究为深入探索人参内生真菌次生代谢产物的化学成分提供了一定的基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Razgonova M P, Veselov V V, Zakharenko A M,.components and the pathogenesis of Alzheimer’s disease (Review) [J]., 2019, 19(4): 2975-2998.
[2] Mancuso C, Santangelo R.and: From pharmacology to toxicology [J]., 2017, 107(Pt A): 362-372.
[3] 严华, 张慧秀, 白宗利, 等. 基于特征图谱的人参属药材西洋参、人参、三七的比较[J]. 世界中医药, 2021, 16(6): 887-895.
[4] 张亚光, 张艳欣, 高崎. 人参内生真菌群落结构及其与有效成分相关性分析 [J]. 人参研究, 2021, 33(3): 2-8.
[5] 陈小玲, 司函瑞, 付东兴, 等. 人参三醇组皂苷质量标准的初步研究 [J]. 特产研究, 2022, 44(1): 20-28.
[6] 中国药典 [S]. 一部. 2020: 8.
[7] Zhou Y, Yang Z M, Gao L L,. Changes in element accumulation, phenolic metabolism, and antioxidative enzyme activities in the red-skin roots of[J]., 2017, 41(3): 307-315.
[8] 孙剑秋. 我国北方常见药用植物内生真菌多样性与生态分布 [D]. 哈尔滨: 东北林业大学, 2007.
[9] 明乾良, 徐丽莉, 韩婷, 等. 人参内生真菌多样性的初步研究 [J]. 人参研究, 2010, 22(2): 2-8.
[10] 张薇. 人参根际土壤真菌与内生真菌的多样性及人参皂苷生物催化活性菌株的筛选 [D]. 大连: 辽宁师范大学, 2011.
[11] Park S U, Lim H S, Park K C,. Fungal endophytes from three cultivars ofMeyer cultivated in Korea [J]., 2012, 36(1): 107-113.
[12] Park Y H, Kim Y C, Park S U,. Age-dependent distribution of fungal endophytes inroots cultivated in Korea [J]., 2012, 36(3): 327-333.
[13] Xu L L, Han T, Wu J Z,. Comparative research of chemical constituents, antifungal and antitumor properties of ether extracts ofand its endophytic fungus [J]., 2009, 16(6/7): 609-616.
[14] 王卓, 于慧美, 刘鼎, 等. 人参内生真菌的分离及其抗肿瘤活性研究 [J]. 中国现代中药, 2013, 15(9): 748-751.
[15] 赵俞. 人参内生真菌发酵产物及其活性研究 [D]. 长春: 吉林农业大学, 2012.
[16] Jin Z X, Gao L, Zhang L,. Antimicrobial activity of saponins produced by two novel endophytic fungi from[J]., 2017, 31(22): 2700-2703.
[17] Roehr M, Kubicek C P, Kominek J. Industrial acids and other small molecules [J]., 1992, 23: 91-131.
[18] Liu F, Tian L, Chen G,. Two new compounds from a marine-derivedT21-03 [J]., 2017, 19(7): 678-683.
[19] Dewi R T, Tachibana S, Darmawan A. Effect on α-glucosidase inhibition and antioxidant activities of butyrolactone derivatives fromMC751 [J]., 2014, 23(1): 454-460.
[20] Wang C, Guo L, Hao J J,. Α-glucosidase inhibitors from the marine-derived fungusHN4-13 [J]., 2016, 79(11): 2977-2981.
[21] Zhou M, Du G, Yang H Y,. Antiviral butyrolactones from the endophytic fungus[J]., 2015, 81(3): 235-240.
[22] Zhang L H, Feng B M, Zhao Y Q,. Polyketide butenolide, diphenyl ether, and benzophenone derivatives from the fungusPJ03-11 [J]., 2016, 26(2): 346-350.
[23] Guo F, Li Z L, Xu X W,. Butenolide derivatives from the plant endophytic fungus[J]., 2016, 113: 44-50.
[24] Chaiyosang B, Kanokmedhakul K, Boonmak J,. A new lumazine peptide penilumamide E from the fungus[J]., 2016, 30(9): 1017-1024.
[25] Liu C, Liu H, Wen Y Z,. Aspernolide A inhibits the proliferation of human laryngeal carcinoma cells through the mitochondrial apoptotic and STAT3 signaling pathways [J]., 2019, 24(6): 1074.
[26] Zeng Q, Zhong W M, Chen Y C,. A new butenolide derivative from the deep-sea fungusSCSIO FZQ028 [J]., 2020, 34(14): 1984-1991.
[27] Chen M, Wang K L, Liu M,. Bioactive steroid derivatives and butyrolactone derivatives from a Gorgonian-derivedsp. fungus [J]., 2015, 12(9): 1398-1406.
[28] Zhang Y H, Zhou Q, Qi C X,. Butenolides from a marine-derived funguswith antitumor activities against pancreatic ductal adenocarcinoma cells [J]., 2018, 26(22): 5903-5910.
The secondary metabolites from endophytic fungusRSB2007 from
ZHANG Hong1, MAO Wei-ye2, ZHENG Bin-yue2, LIU Xia1, JIN Lu1, LI Sheng-yu1, FU Hui-ying1, 2, SHOU Qi-yang1, 2
1.The Second Clinical Medical College & Second Affiliated Hospital, Zhejiang Chinese Medical University, Hangzhou 310005, China 2. Pharmacy Division of Zhejiang Chinese Medical University, Hangzhou 310053, China
To study the secondary metabolites of the endophytic fungusRSB2007 fromC. A. Meyer in order to obtain new compounds.The EtOAc extracts of fungal rice cultures were separated and purified by using various chromatographic methods (silica gel, Sephadex LH-20 and HPLC). The structures of all compounds were determined by chemical and spectroscopic methods (NMR, HRESIMS, CD, ECD, etc.).Four compounds were preliminarily isolated and their structures were identified as 7,8′-dihydroxy-3,4,6-trimethyl-7′-phenyl-1,3,4,7′-tetrahydro-2- pyrano[2,3,4-de]chromene-8′-carboxylate (1), butyrolactone II (2), aspernolide A (3) and versicolactone B (4).Compound 1 is a new polyketide and named aspercitrinol A.
C. A. Meyer; endophytic fungi;RSB2007; secondary metabolites; polyketides; aspercitrinol A
R284.1
A
0253 - 2670(2022)17 - 5265 - 06
10.7501/j.issn.0253-2670.2022.17.001
2022-05-12
浙江省自然科学基金项目(LQ22H280005)
张 红(1988—),女,助理研究员,主要从事中药及中药内生菌活性成分的研究。Tel: 15305187672 E-mail: zhanghong_16@126.com
寿旗扬,研究员,博士生导师。Tel: (0571)86613569 E-mail: sqy133@126.com
傅惠英,研究员。Tel: 0571(86633010) E-mail: fhy131@126.com
[责任编辑 王文倩]

