连续流动条件下硝酮的光化学合成在本科实验教学中的应用探索
宣俊,金伟伟,李磊,廉笑,张琼,刘晨江,*
1安徽大学化学化工学院,合肥 230601
2新疆大学化学学院,乌鲁木齐 830046
利用可见光作为绿色能源引发的有机化学转化已成为合成化学中的前沿研究领域之一[1]。由于该类反应具有反应条件温和、化学选择性优异等优点,使其在现代合成有机化学及化学生物学等研究中具有良好的应用前景。但随着反应规模的扩大,光无法有效地穿透溶液至反应中心而导致反应效率下降明显。提高光照强度又可能会导致反应物过度照射而引发副产物的产生。近年来,流动化学的出现为解决光反应中的这些问题提供了一条有效的途径[2]。流动化学,也称作连续流化学,它的主要特征是在连续流动的流相中完成化学反应的发生。与在烧瓶等容器中进行的传统反应相比,流动化学通过对混合、加热和停留时间等关键反应参数的调控,可以更好地控制反应,从而提高反应效率。另外对于放热量大的反应,使用流动化学反应装置可以增强实验的安全性。
另一方面,硝酮是有机合成中最重要的合成子之一,常被用作1,3-偶极子参与环加成反应来构建具有重要生理、药理活性的杂环化合物[3]。近年来化学家们相继开发出了多种合成硝酮的方法,其中N-单取代羟胺与醛或酮的缩合反应是制备硝酮最有效的方法之一,但这些反应往往需要使用脱水试剂或在高温条件下才能进行[4]。仲胺、亚胺以及N,N-二取代羟胺的氧化是合成硝酮的另一有效方法,但通常需要消耗化学计量的氧化剂,产生的废弃物较多,不符合绿色化学理念[5]。
随着有机化学新反应、新方法和新合成技术的不断涌现,针对本科生的有机化学实验教学不能只满足于传统的知识传授和常规有机实验技能的培养,如蒸馏、分馏、重结晶等[6]。通过设计操作简便的有机合成新实验,将学科前沿研究热点有效融合于本科生实验教学中,不仅可以让学生接触到有机合成新方法,还可以拓宽他们的学术视野和知识面,激发本科生学习有机化学的兴趣。
1 实验目的
本实验将流动化学与有机光化学结合,实现硝酮化合物的绿色合成。与已知文献报道的硝酮合成方法相比,该反应具有反应条件绿色温和、无需催化剂及添加剂以及副产物少等优势。同时我们希望用本实验设计实现:(1) 让本科生熟悉硝酮类化合物的合成方法,拓展现阶段本科有机化学教学实验开设的范围;(2) 掌握微量有机反应中薄层分析法、柱层析及相关仪器的操作,并将所学的核磁共振氢谱/碳谱的理论知识运用到实际分析中;(3) 通过让学生搭建简易流动光化学反应装置,从本质上理解流动化学的特点和优势,锻炼动手能力;(4) 让学生了解学科前沿研究热点,对有机光化学和连续流动化学有初步认识,了解绿色化学的原理及核心概念,提高环保意识[7]。
2 实验原理
如图1所示,苯基重氮酸酯1在蓝色LED灯照射下可以产生卡宾中间体[8],随后亚硝基苯中亲核性氮原子对卡宾加成得到两性离子中间体4,进而异构为结构更加稳定的硝酮产物3。用TLC监测反应过程,反应结束后柱层析提纯目标化合物。

图1 硝酮3的光化学合成路线
3 仪器与试剂
3.1 实验仪器
磁力搅拌器(IKA)、旋转蒸发仪(IKA)、电子天平(梅特勒)、核磁共振波谱仪(德国Bruck公司)、ZF-1型三用紫外灯、蓝色LED灯(武汉格奥化学技术有限公司)、自组装的简易流动光化学反应器(配件:蓝色LED灯带、风扇、循环泵和流动软管均为网上购买)。
3.2 主要试剂
苯乙酸甲酯(萨恩化学技术有限公司)、对甲苯磺酰叠氮(萨恩化学技术有限公司)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)(毕得医药)、亚硝基苯(毕佳索)、乙腈(上海麦克林生化科技有限公司)、四氢呋喃(天津市大茂化学试剂厂)、无水硫酸钠(天津市大茂化学试剂厂)、氯化铵溶液(10%) (国药基团化学试剂有限公司)、饱和氯化钠溶液(天津市大茂化学试剂厂)、石油醚(成都市科隆化学品有限公司)、乙酸乙酯(成都市科隆化学品有限公司),均为国产分析纯试剂。
4 实验步骤
4.1 反应底物苯基重氮酸酯1的制备
苯基重氮酸酯1可由实验教师预先制备,其合成路线如图2所示。该反应为文献已知过程,产物为供体-受体型重氮化合物,性质稳定,使用安全,低温下可较长时间存放。向50 mL圆底烧瓶中依次加入苯乙酸甲酯(10 mmol,1.5 g),TsN3(12 mmol,2.4 g)和20 mL CH3CN。待溶解均匀后向溶液中逐滴滴加DBU (14 mmol,2.3 g),将所得溶液于室温下搅拌,通过TLC点板监测反应。反应结束后(约3 h),加入水淬灭反应,并用乙酸乙酯进行萃取(10 mL × 3次)。合并的有机相分别用配制好的10% NH4Cl溶液和饱和氯化钠溶液洗涤,最后用无水硫酸钠进行干燥。用旋转蒸发仪除去溶剂,通过快速柱层析获得目标产物1 (洗脱剂:石油醚:乙酸乙酯 = 60 : 1-30 : 1 (体积比);红色油状物,1.6 g,产率:91%)。
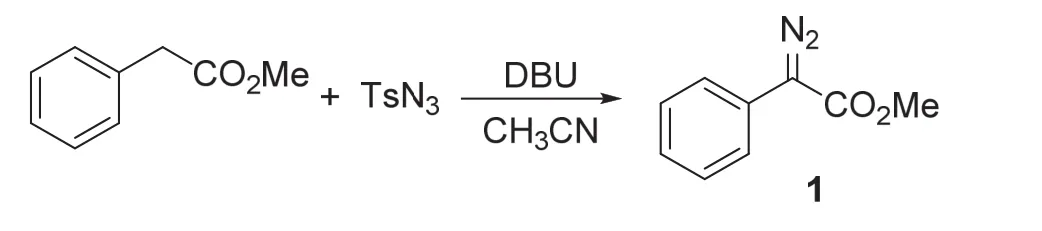
图2 苯基重氮酸酯1的合成路线
4.2 硝酮3的光化学合成:微量反应
如图3所示,在室温下向两个10 mL Schlenk反应管中分别加入苯基重氮酸酯1 (0.2 mmol,35.2 mg)、亚硝基苯2 (0.1 mmol,10.7 mg)、1.0 mL无水四氢呋喃以及搅拌子。将其中一个Schlenk反应管放置在24 W蓝色LED灯照射下搅拌1 h,另一个Schlenk反应管用锡箔纸包裹完全后置于黑暗条件下搅拌1 h。反应结束后,通过旋转蒸发仪除去溶剂,粗产品通过柱层析分离纯化(洗脱剂:石油醚:乙酸乙酯 = 20 : 1-5 : 1)。

图3 硝酮3的微量光化学合成路线
4.3 硝酮3的光化学合成:放大量反应
4.3.1 常规玻璃瓶中硝酮的放大量合成
如图4所示,室温下向50 mL圆底烧瓶中分别加入苯基重氮酸酯1 (2.0 mmol, 352 mg)、亚硝基苯2 (1.0 mmol,107 mg)、10 mL无水四氢呋喃以及搅拌子。随后将圆底烧瓶放置在蓝色LED下照射下搅拌4 h。反应停止后,通过旋转蒸发仪除去溶剂,将所得的粗产品进行柱层析分离纯化(洗脱剂:石油醚:乙酸乙酯 = 20 : 1-5 : 1)。
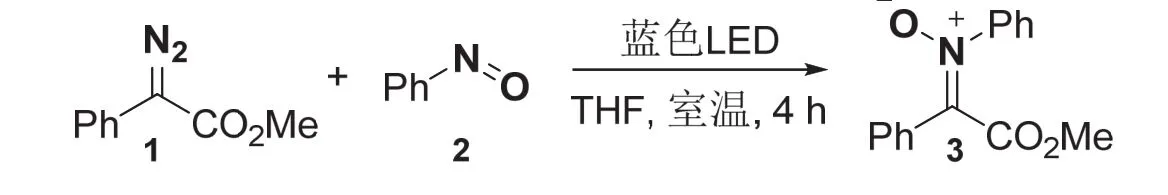
图4 圆底烧瓶中硝酮3的放大量光化学合成路线
4.3.2 连续流动条件下硝酮的放大量合成
搭建流动光化学反应器所需的零部件主要有:蓝色LED灯带、风扇、循环泵和流动软管,如图5所示。这些主要零部件均可以通过网上购买,价格也合适于本科实验开展(注:搭建一套简易流动光化学反应器大约需人民币300元,具体购买信息及价格见本论文的补充材料部分)。

图5 简易流动光化学反应器主要部件
室温下向50 mL圆底烧瓶中分别加入苯基重氮酸酯1 (2.0 mmol,352 mg)、亚硝基苯2 (1.0 mmol,107 mg)、10 mL无水四氢呋喃以及搅拌子。随后将反应体系放置于流动光化学反应器中反应4 h (流速约2.5 mL·min−1)。反应停止后,通过旋转蒸发仪除去溶剂,将所得的粗产品进行柱层析分离纯化(洗脱剂:石油醚:乙酸乙酯 = 20 : 1-5 : 1)。
5 结果与讨论
5.1 对微量反应
如表1所示,对硝酮的微量光化学合成反应,蓝光照射下反应1 h后的体系颜色呈亮黄色,TLC点板显示有明显新产物生成,经柱层析分离纯化得硝酮产物3 (黄色固体,收率:79%)。黑暗条件下搅拌1 h后的反应体系颜色为浅绿色,TLC点板显示无新产物生成,黑暗条件下反应并未发生。由此可以得出实验设计的硝酮光化学合成方案可行,且蓝色LED灯照射是本实验必不可少的条件。

表1 微量反应结果
5.2 对放大量反应
如表2所示,对于放大量反应而言,在普通圆底烧瓶中光照下搅拌4 h后的反应体系颜色为浅绿色,TLC点板显示有新产物生成,但新产物点较浅,经柱层析分离纯化得硝酮产物3 (黄色固体,收率:23%)。而在流动光化学反应器中反应4 h后的体系颜色呈亮黄色,TLC点板显示有明显新产物生成,经柱层析分离纯化得硝酮产物3 (黄色固体,收率:70%)。两组数据对比可知,对于放大量的光化学合成反应,由于使用的溶剂量增多,直接在圆底烧瓶中光照反应时,光吸收效果差导致反应产率下降明显。而在流动光化学反应器中的放大量反应,基本维持了和微量反应差不多的反应效果,仅有略微的产率下降。反应效果明显优于普通圆底烧瓶中光照下搅拌。

表2 放大量反应结果
5.3 产物分析与表征
如图6所示,产物硝酮3的结构通过核磁共振氢谱(1H NMR)以及核磁共振碳谱(13C NMR)表征确定。核磁谱图的出峰位置、相对峰积分面积和峰裂分均与文献报道一致。并且谱图上基本没有杂质峰,表明通过柱层析方法分离得到的硝酮产物具有很高的纯度。
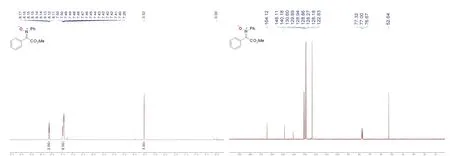
图6 硝酮3的核磁谱图
1H NMR (400 MHz, CDCl3, 300 K):δ= 8.17-8.11 (m, 2H), 7.49 (m, 2H), 7.46-7.39 (m, 6H), 3.52 (s,3H);13C NMR (100 MHz, CDCl3, 300 K):δ= 164.1, 148.1, 140.2, 130.6, 129.9, 128.9, 128.8, 128.3,128.2, 122.8, 52.6。
6 实验组织
本实验总时长大约6-8 h,无需使用无水无氧等特殊实验操作,适合本科生在基础实验室中操作完成。建议以综合设计实验形式,面向大学三年级下学期或四年级上学期学生开设。目前,本设计实验已组织我校本科生在实验室进行了多轮重复,数据重复性好,具有在本科生基础有机实验室中开展的潜力。
7 结语
本实验将流动化学与有机光化学结合,实现硝酮化合物的绿色合成。通过将连续流动化学和光化学合成融合运用于本科实验教学,拓展现阶段本科有机化学教学实验的开设范围。通过本实验可以让学生掌握微量有机反应中薄层分析法、柱层析及相关仪器的操作,并将所学的核磁共振氢谱/碳谱的理论知识运用到实际分析中。另外,还可以让学生了解学科前沿研究热点,对有机光化学和连续流动化学有初步认识,了解绿色化学的原理及核心概念,提高环保意识。自实验开设以来,教研相长,教师和学生均对有机光合成和流动化学产生了浓厚的学习兴趣。

