T ACE 治疗肝癌后总生存期的替代终点研究进展
史逸恺, 倪才方
所有临床研究的疗效及安全性评估均基于观察终点,但设立的观察终点不同往往会给试验带来不同的结果, 甚至决定了试验的成功或失败。延长患者生存期的同时改善生存质量是肿瘤治疗的理想目标, 但患者的生存质量尚缺乏统一标准和可靠的评估方式, 被建议作为辅助评估指标。目前总生存期(overall survival,OS)作为评估肝细胞癌(hepatocellular carcinoma,HCC)相 关 临 床 结 果的金标准,也被推荐为经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE) 相关临床试验和临床观察研究的终点[1]。 然而,OS 的观察时间长,且受后续治疗的影响,为满足现代临床试验的需求, 近年来涌现了一些OS 替代终点的相关研究。 在肿瘤药物临床试验中,OS 常见的替代终点包括进展时间(time to progression,TTP)、无进展生存时间(progression-free survival,PFS)、无病生存时间(disease- free survival,DFS)、客 观 缓 解 率(objective response rate,ORR)等。
由于肝癌TACE 试验与药物试验在适用人群、治疗周期及疗效等诸多方面存在差异,TACE 研究中的替代终点应慎重选择。 本研究归纳了肝癌TACE 临床研究中各替代终点的作用与特点, 并分析了各替代终点的可靠性。
1 TTP 和PFS
TTP 定义为从随机化开始至患者出现肿瘤进展的时间,不包含任何原因导致的患者死亡。 在肿瘤学中,进展一般被认为治疗失败。2008 年,美国肝病研究协会提出将TTP 作为最佳的次级终点[1]。 Celsa等[2]对TACE、TACE 联合系统治疗或单纯系统治疗不可切除HCC 的研究进行Meta 分析,发现TTP 的危险比(harzard rate,HR)和OS 的HR 相关性良好,而中位TTP 和中位OS 的相关性较差。 Wang 等[3]研究发现,经TACE 治疗HCC 患者的TTP 与OS 的相关系数为0.559(P<0.01),进一步回归分析后发现TTP 并非OS 的预后影响因素。
PFS 定义为由随机至第1 次发生疾病进展或任何原因死亡的时间,是评估疾病是否进展和患者是否存活的复合终点。 PFS 克服了TTP 不能捕捉死亡信息的缺点,并且能反映疾病进展[4]。 Finn[5]指出,若PFS 满 足 某 些 最 小 阈 值(即PFS 的HR <0.6 或PFS≥6 个月)时,推荐将其作为HCC 一线临床试验的主要终点。相比于TTP,PFS 的评估依赖于病情进展或死亡,从而提供了更多的可测量事件,可减少统计要求所需的患者数量。 当存在相互竞争的死亡原因(如存在潜在或相关疾病)时,TTP 比PFS 和OS在疗效评估方面更有优势。 部分肝癌患者在肿瘤进展前都有可能因潜在的或相关的肝脏疾病而死亡,在这些情况下使用TTP 可以更好地区分某种抗肿瘤疗效和与肿瘤进展无关的病死率[1]。
虽然TTP 或PFS 作为TACE 研究中OS 的替代终点具有终点事件易达到、 评估较为简便的优势,但仍存在一些共同问题。在临床上,大部分经TACE治疗的中晚期HCC 患者虽不能达到完全缓解,但可有效减轻肿瘤负荷、降低肿瘤分期,若因为个别肝癌结节栓塞效果不佳,或在未治疗区域出现新发病灶而认为TACE 治疗失败,显然是不合理的[6]。即使在1、2 次TACE 后局部肿瘤进展,仍可以从再次TACE 或者改变TACE 方法后获益。 考虑到TACE 治疗目标的异质性[7],对于以完全缓解为目标的TACE治疗,TTP 或PFS 作为疗效观察终点较有临床意义;而对于以病灶大部分坏死或控制疾病为目标的TACE 治疗,TTP 或PFS 作为终点不能科学地评估TACE 疗效。
2 无分期进展生存期(stage progression- free survail,SPFS)和肝外转移或血管侵犯时间(time to extrahepatic spread or vascular invasion,TTES/VI)
SPFS 定义为从治疗开始到出现肝外转移或大血管侵犯的生存时间。 Kim 等[8]根据随访期中行TACE治疗HCC 患者的疾病进展与分期进展发生情况进行分组,发现早期出现分期进展对OS 的影响更大,提示SPFS 可以作为预测TACE 抵抗的终点。TTES/VI定义为从首次TACE 至出现肝外转移或血管侵犯的时间。为探究Brivanib 作为辅助治疗在TACE 中的作用,Kudo 等[9]在Brivanib 三期试验中将TTES/VI 作为次要终点, 结果发现Brivanib 组相比于安慰剂组延长了TTES/VI,但两组OS 无明显差异。 在SPACE试验中也将TTES/VI 作为次要终点,发现索拉非尼联合DEB-TACE 组与安慰剂联合DEB-TACE 组患者之间的TTES/VI 无明显差异[10]。
出现门静脉癌栓或肝外转移的患者病情发展迅速,患者的中位生存时间明显缩短,且不同类型的门静脉癌栓或肝外转移患者的预后存在差异[11-12],因此SPFS 或TTES/VI 与OS 之间存在一定相关性。TACE 治疗后出现靶病灶或非靶病灶的进展后仍可继续接受TACE 治疗,而若出现肝外转移或血管侵犯相关的进展,则应转为其他治疗[13-14]。 因此,SPFS或TTES/VI 对后续治疗的指导意义可能超过TTP或PFS。 对于出现肝外转移或血管侵犯后是否应停止TACE 治疗, 仍存在争议。 在JSH 和BCLC 标准中,TACE 不适用于出现肝外扩散或血管侵犯的HCC 患者,但越来越多的证据表明,TACE 在这类患者中的作用不可替代[15-17]。 国内一项TACE 调查认为,对于发生门静脉癌栓或肝外转移的肝功能保留的HCC 患者,应进行反复TACE 以控制肝内病变[18]。 虽然SPFS 或TTES/VI 与OS 有一定相关性,但其对后续治疗的指导意义有待商榷,其作为替代终点的意义受到一定影响。 另外,受检查范围的限制会出现肝外转移病灶漏诊的情况,因此分期进展的评估往往存在滞后性, 从而影响SPFS 或TTES/VI 评估的准确性。
3 ORR 和疾病控制率(disease control rate,DCR)
ORR 定义为肿瘤缩小达到一定量并且维持一定时间的患者比例,包括完全缓解和部分缓解。 继2010 年mRECIST 标准提出后, 部分研究表明在接受系统性靶向治疗的晚期HCC 病例中, 基于mRECIST 的ORR 对预后有预测价值[19-21],而基于mRECIST 的ORR 与接受TACE 治疗的患者的生存期之间存在相关性[22]。
然而,由于在评估肿瘤应答的时间点选择方面存在争议, 增加了ORR 作为替代终点应用时的复杂性。Kim 等[23]研究发现,首次TACE 后的肿瘤应答和多次TACE 治疗期间肿瘤的最佳应答都可以独立有效地预测OS,早期获得治疗应答是良好预后的可靠预测指标。 在初始TACE 后疗效不佳或治疗间期肿瘤进展的情况下, 患者仍有可能从后续TACE治疗中获益。 多项研究结果表明,2 次或3 次TACE治疗后再评估疗效以决定是否放弃TACE 治疗更为科学[24-26]。
DCR 定义为治疗干预后达到完全缓解、部分缓解和疾病稳定的患者比例。DCR 在一些TACE 相关临床研究中也被用作次要终点[10,27]。 然而,DCR 中的疾病控制概念也仅是在某个时间点上的控制,没有考虑持续效果[28]。 相较于ORR,DCR 概念中包含了疾病稳定的患者,对TACE 疗效较好的情况区分能力较弱,可能导致其预测OS 的能力下降。
4 TACE 无效或抵抗相关替代终点
由于HCC 患者在肿瘤负荷和肝功能方面异质性较大,并非所有患者都能从TACE 获益。 为了在发挥TACE 治疗优势的同时,尽可能减少因反复或无效治疗造成的肝功能损伤,提高疗效并改善长期预后,相继出现了治疗失败时间(time to treatment failure,TTTF)、 TACE 治 疗 无 效 进 展 时 间(time to untreatable/unTACEable progression,TTUP)和TACE治疗后进展时间(time to TACE progression,TTTP)等一些新的临床研究终点。
TTTF 是一个反映疗效和治疗毒性的复合终点,其被定义为从第1 次TACE 至因任何原因停止TACE 的时间,其原因包括疾病进展、治疗毒性、患者治疗选择和死亡。 早在2007 年经导管治疗肝癌的终点和报告规范标准中,TTTF 便被推荐作为可接受的生存期替代终点[29]。Guiu 等[30]在验证血清谷氨酰转肽酶预测TACE 预后的能力的试验中,使用TTTF 作为次要终点, 发现血清谷氨酰转肽酶水平与HCC 患者TACE 术后的TTTF 和OS 独立相关。TTTF 在ORIENTAL 试验中也被作为次要终点进行疗效评估[31]。
2010 年JSH 共识中正式提出了TACE 抵抗/失败的定义[32]。巴塞罗那临床肝癌研究组也于2011 年提出TACE 治疗无效进展(unTACEable progression,UTP)的概念[13],其中治疗无效进展定义为较大进展(肿瘤肝内占比过大、肝外转移或血管侵犯)及伴有肝功能损伤或身体状态影响的肝内进展,并将开始随访至发生治疗无效进展的时间定义为TTUP。2014 年JSH 改进的TACE 抵抗的概念获得较广泛认可,并沿用至今[33]。 TTUP 被定义为从第1 次TACE治疗至确认TACE 抵抗或肝功能发展至Child-Pugh C 级的时间。
Labeur 等[34]的研究证明TTUP 与OS 之间存在高度相关性,相关系数达到了0.816。Wang 等[3]的研究结果与之相似,TTUP 与OS 的相关系数和偏相关系数分别为0.789 和0.697,认为TTUP 有望作为未来TACE 相关临床试验的替代终点, 且TTUP 比TTP 更适合作为OS 的替代终点。 从上述两个临床试验中可得知TTUP 与OS 关系密切, 另一些有关TTUP 的研究则体现了其临床意义。 Kinki 标准是对BCLC-B 期的补充和细化, 其中B1 定义为Child-Pugh 评分不超过7 分且在up-to-7 标准之内,B2 定义为Child-Pugh 评分不超过7 分且超出up-to-7 标准,各亚分期的治疗及预后存在差异。 Arizumi 等[35]对B1 期和B2 期HCC 患者的TTUP 进行比较,发现B2 期患者的中位TTUP 明显更短, 说明较短的TTUP 可能预示着患者较差的生存期。 Kudo[36]分析TACTICS 试验取得相对成功的主要原因是在TACTICS 试验中肝内新发病灶不被认为是肿瘤进展,以及将TTUP 作为试验终点。 虽然在SPACE 试验中TTUP 也被作为次要终点[10],但由于对TTUP 的定义过于严格,很多患者尚未经历两次TACE 就达到了TTUP 的评估标准, 导致索拉非尼联合DEBTACE 组的治疗早早停止,是SPACE 试验失败的重大原因。
然而,不同的中心和国家对TACE 抵抗概念的内容尚存在一些争议, 相应的TTTF 和TTUP 概念也存在偏差。 TACE 抵抗的定义主要取决于TACE治疗的目标[6]。如果认为TACE 是一种姑息性治疗,则可以认为疾病稳定是一个良好的预期结果。 相反,如果为求肿瘤根治而选择TACE 治疗,那么疾病稳定将被认为是一个不良的预期结果,这种情况便被认为是TACE 抵抗。另外,对于日本TACE 抵抗的概念,张申等[37]指出了其中存在的局限性、模糊及矛盾之处。 因此TTTF 或TTUP 能否成为TACE临床试验中OS 可靠的替代终点仍有待商榷。
Arizumi 等[38]在2017 年继TTUP 之后又提出了TTTP,即从TACE 治疗后至评估时与基线图像相比发生肿瘤进展的时间间隔,这里的肿瘤进展被定义为5 个直径最大的肿瘤直径总和增大≥20%,或出现大血管侵犯、肝外转移;其研究结果显示,在BCLC B期HCC 患者中OS 和TTTP 的相关性良好, 相关系数为0.6590。 其后,Izumoto 等[39]对192 例BCLC B期HCC 患者进行TTTP 作为替代终点可靠性的验证,结果显示TTTP 和OS 的相关性良好,根据TTTP的时间长短将患者分组后, 发现组间的OS 均存在明显差异。 Kudo[36]认为TTTP 是OS 良好的替代指标,可用于临床试验的主要终点。 然而,TTTP 作为合适的替代终点仍存在一些问题, 如其最主要的观察对象是5 个直径最大的肿瘤, 但在实际情况下肝内存在5 个及以上肿瘤并非常见,5 个最大肿瘤在随访中直径总和增大≥20%更难观察到,这种现象出现非常晚,与死亡时间间隔较短。 虽然理论上TTTP 与OS 相关性良好,但出现TTTP 的观察终点时为时已晚。TACE 临床研究中OS 各替代终点的特点见表1。
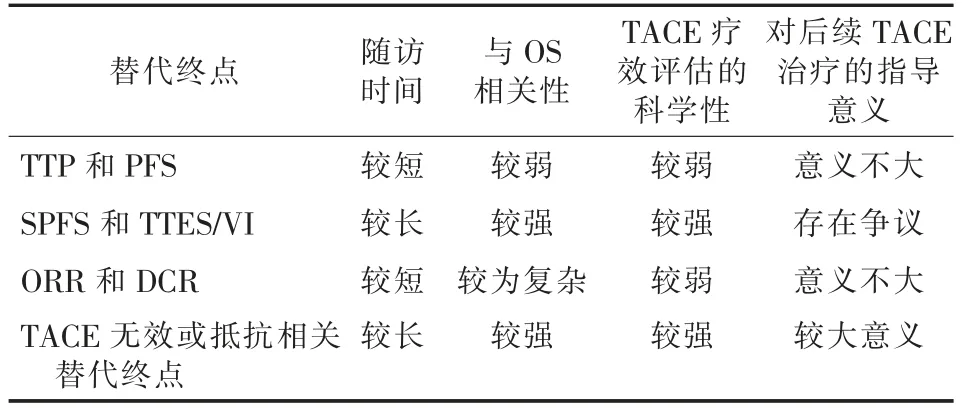
表1 TACE 临床研究中OS 各替代终点的特点
5 结语
OS 仍是目前评估TACE 疗效的金标准。 众多OS 的替代终点普遍与OS 的相关性良好, 各有特点。 对于以病灶大部分坏死或控制疾病为目标的TACE 治疗, 与TACE 无效或抵抗相关的替代终点可能更为可靠。 然而,在肝癌TACE 临床研究中需根据具体情况谨慎地选择合适的替代终点。

