基于UPLC-MS/MS技术的代谢组学方法研究铝胁迫下花生的根系代谢
沈雪峰,卢文涛,陈勇
(1.广东海洋大学滨海农业学院,广东 湛江,524088;2.华南农业大学农学院,广东 广州,510642)
全世界约25亿公顷耕地和潜在可耕地属于酸性土壤,约占耕地和潜在可耕地总面积的50%[1],主要分布在热带、亚热带及温带地区。中国酸性土壤分布遍及南方15 个省,总面积达21.8 万公顷,约占全国耕地面积的22.7%[2]。当土壤pH 低至5.5 以下时,土壤中的铝便以离子形式(Al3+)释放入土中,交换性铝占阳离子交换量的20%~80%,过量的铝离子抑制植物的根系生长,影响水分和养分吸收,限制了作物的生长与产量[3,4]。可见,铝毒害已成为制约酸性土壤中作物生长发育和产量形成的最有害因素之一[5,6]。
铝毒害最明显的症状是作物根系伸长生长受到抑制。根尖是最先感受铝胁迫的部位,也是铝诱导有机酸分泌的主要部位[7~9]。有机酸是缓解作物铝毒害的一类重要物质[10]。张菁[11]研究发现,铝胁迫诱导紫花苜蓿根系苯丙氨酸代谢途径增强,促进酚酸类物质的形成,主要有香豆酸、阿魏酸、芥子酸和松柏醇。最近研究[12]报道,环境胁迫可诱导植物产生大量的黄酮和异黄酮类物质。可见,植物体内有机酸的代谢对于其抵御铝胁迫具有重要作用。
花生(Arachis hypogaeaL.)是重要的油料和经济作物。我国南方花生种植面积占全国花生面积的30%左右,但其单产却一直低于全国平均水平,其中一个重要原因就是酸性土壤铝毒害[13]。以往研究主要集中在铝胁迫对花生生长发育的影响[14]、栽培措施对花生耐铝性的影响[15]以及外源物质增强花生耐铝性[16]等方面,而关于铝胁迫对花生根系代谢学及其代谢通路的相关研究报道较少。因此,本研究基于超高效液相色谱-串联质谱(UPLC-MS/MS)技术对铝胁迫下两个花生品种根系进行代谢组学分析,以确定铝胁迫对花生根系生长发育过程中次级代谢产物的影响,揭示铝胁迫对花生根系的代谢通路,为生产中有效降低铝毒害提供科学依据。
1 材料与方法
1.1 材料
花生品种为花育23 号(H),购于山东省农业科学院花生研究所;粤油7号(Y),购于广东省农业科学院作物研究所。其中,花育23 号为铝敏感型花生品种,粤油7号为耐铝型花生品种[17]。
1.2 试验设计
花生种子经10%的H2O2溶液中消毒后,置于铺有滤纸的培养皿中进行催芽,2 d后,选取发芽一致的种子,移入盛有营养土的穴盘中进行培养。待花生抽出第二片真叶后,将幼苗移入Hoagland营养液中,试验设为对照(清水,CK)和铝处理(0.3 mmol·L-1AlCl3·6H2O,分析纯,根据铝浓度筛选试验结果而定),即花育23 号的对照(HC)和处理(HA),粤油7 号的对照(YC)和处理(YA),每个处理重复3 次。培养液每2 d 一换,随后置于人工气候室,温度28℃/25℃(昼/夜),光照600 µmol·m-2·s-1,相对湿度75%左右。铝胁迫7 d后,取各个处理的花生幼苗新鲜根系,用于代谢物的测定。
1.3 样品提取
1.3.1 供试品制备 将根系样品置于冻干机(Scientz-100F)中真空冷冻干燥,利用冷冻研磨仪(MM 400, 德国Retsch)研磨(30 Hz, 1.5 min)至粉末。称取100 mg 粉末溶解于含有0.6 mL 70%甲醇的提取液中,置于4℃冰箱,期间涡旋6 次,提高提取率,10 000 ×g离心10 min,吸上清,过0.22µm微孔滤膜,保存于进样瓶中,用于UPLC-MS/MS分析。
1.3.2 液相条件 色谱柱:Waters ACQUITY UPLC HSS T3 C18 1.8µm,2.1 mm×100 mm;流动相:水相为超纯水(加入0.04%的乙酸),有机相为乙腈(加入0.04%的乙酸);洗脱梯度:0 min 有机相比例为5%,10 min 内有机相比例线性增加到95% 1 min,11.00~11.10 min,并 维 持 在95%1 min,有机相比例降为5%,并以5% 平衡至14 min;流速0.35 mL/min;柱温40℃;进样量4µL。
1.3.3 质谱条件 电喷雾离子源(electrospray ionization, ESI)温度550℃,质谱电压5500 V,帘气(curtain gas,CUR)30 psi,碰撞诱导电离(collisionactivated dissociation,CAD)参数设置为高。在三重串联四级杆质谱(QQQ, Thermo Fisher)中,每个离子对是根据优化的去簇电压(declustering potential, DP)和碰撞能(collision energy, CE)进行扫描检测[18]。
1.3.4 代谢物定性与定量 基于迈维代谢生物科技有限公司自建数据库MWDB(metware database)及代谢物信息公共数据库,利用QQQ 的多反应监测模式(multiple reaction monitoring, MRM)对代谢物定性分析。获得不同样品的代谢物质谱数据后,对所有物质的质谱峰进行峰面积积分,并对不同样品的相同代谢物质谱进行积分校正[19]。
1.4 数据处理与分析
采用多元统计分析,运用MetaboAnalyst R 包中的OPLSR. Anal 函数进行有监督的正交偏最小二乘法判别分析(OPLS-DA),用于区分组间的差异代谢物。根据OPLS-DA模型的变量重要性投影(variable importance in projection, VIP)和差异倍数值(fold change)以及单变量T 检验p 值筛选出差异代谢物。即fold change≥2 或fold change≤0.5,P 值≤0.05 以及VIP≥1 的代谢物被认为是差异代谢物。将获得的差异代谢物信息映射到KEGG(kyoto encyclopedia of genes and genomes)数据库进行注释,以获得其富集到的KEGG代谢通路信息。
2 结果与分析
2.1 铝胁迫后花生根系中代谢物分析
使用质控样品(quality control,QC,由样品提取物混合制备而成)分析花生根系样品在相同的处理方法下系统检测的重复性。通过QC 样品的总离子流色谱图(total ions current,TIC)进行重叠(图1),并绘制了MRM 代谢物检测多峰图(多物质提取的离子流图谱,XIC),可以得知,在所有样品中总共鉴定出416 种代谢物,分为10 种类型,主要以酚酸类(phenolic acids,22.60%)、脂质(lipids,14.66%)、氨基酸及其衍生物(amino acids and derivatives,13.94%)、黄酮(flavonoids,11.78%)、核苷酸及其衍生物(nucleotides and derivatives,10.10%)、有机酸(organic acids,8.17%)、生物碱(alkaloids,6.01%)、木脂素和香豆素(lignans and coumarins,3.13%)、萜类(terpenoids,1.92%)和其它类(others,7.69%)为主(图2)。
图1 质控样品质谱检测总离子流重叠图Fig.1 Overlapped total ions current of quality control samples
图2 正离子模式(A)和负离子模式(B)混样质控样品的MRM代谢物检测多峰图Fig.2 Multiple reaction monitoring(MRM)analysis of mixed quality control(QC)sample under positive ion mode(A)and negative ion mode(B)
2.2 主成分分析
通过对样品(包括QC)的主成分分析,初步了解4 组样品之间的总体代谢差异和组内样品之间的变异度大小[20]。从图3 可以看出,UPLC-MS/MS分析得到的原始数据在PC1、PC2 两个主成分中很好地分离、呈现。其中HCvsHA(花育23 品种,HC为对照处理,HA 为铝胁迫处理)的第一主成分的贡献率为81.71%,第二主成分的贡献率为5.96%,两者的贡献率之和为87.67%;YCvsYA(粤油7 号品种,YC为对照处理,YA为铝胁迫处理)的第一主成分的贡献率为73.69%,第二主成分的贡献率为8.69%,两者的贡献率之和为82.38%;HC vs YC(HC为花育23对照处理,YC为粤油7号对照处理)的第一主成分的贡献率为75.52%,第二主成分的贡献率为9.00%,两者的贡献率之和为84.52%;HA vs YA(HA 为花育23 铝胁迫处理,YA 为粤油7号铝胁迫处理)的第一主成分的贡献率为79.30%,第二主成分的贡献率为7.15%,两者的贡献率之和为84.45%;主成分结果表明,花育23 和粤油7 号区分明显。从4 组样品的聚类热图分析(图4)可知,4组样品区别明显,组内平行样品成分接近,证明样品的可靠性。
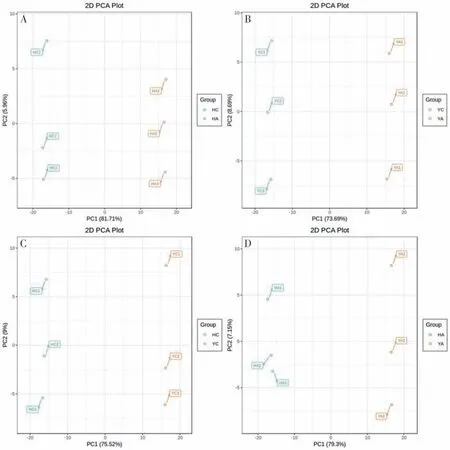
图3 PCA得分Fig.3 Score scatter plot for PCA
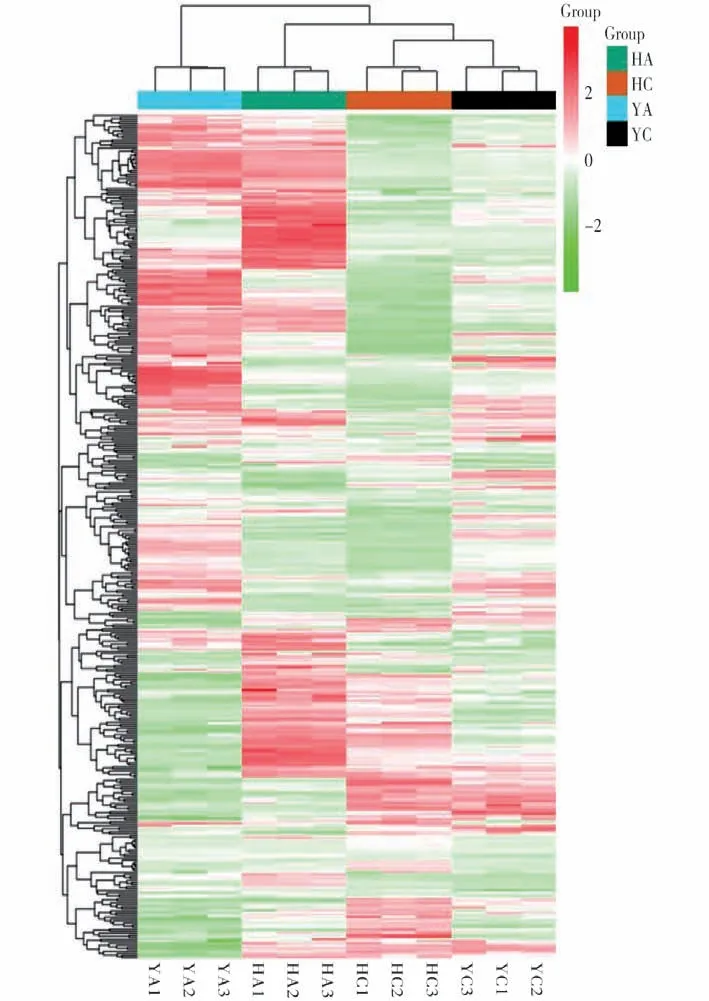
图4 样品总体聚类图Fig.4 Sample overall clustering map
2.3 正交偏最小二乘法判别分析
依据正交偏最小二乘判别分析(OPLS-DA)模型对代谢组数据进行分析,依据模型参数HCvsHA R2X= 0.876,R2Y= 1,Q2= 0.998;YCvsYA R2X=0.811,R2Y= 1,Q2= 0.989;HCvsYC R2X= 0.842,R2Y= 1,Q2= 0.991;HAvsYA R2X= 0.838,R2Y= 1,Q2= 0.997 来看,其中Q2大于0.9,说明OPLS-DA模型构建良好,预测性可靠。
2.4 差异代谢物筛选及分析
依据OPLS-DA 分析后,根据上调代谢物fold change≥2、下调代谢物fold change≤0.5 和VIP≥1 标准筛选出差异显著的代谢物。在检测的416 个代谢物中,HCvsHA 共筛选出155 个差异代谢物(图5A),其中上调代谢物为27 种,下调为128 种;YCvsYA 共筛选出109 个差异代谢物,其中上调代谢物为28种,下调为81种(图5B);HCvsYC 共筛选出117 个差异代谢物,其中上调代谢物为35 种,下调为82种(图5C);HAvsYA共筛选出145个差异代谢物,其中上调代谢物为76 种,下调为69 种(图5D)。铝胁迫条件下,粤油7号vs花育23的上调表达代谢物含量远多于下调代谢物,说耐铝性品种具有自身的耐铝基因。
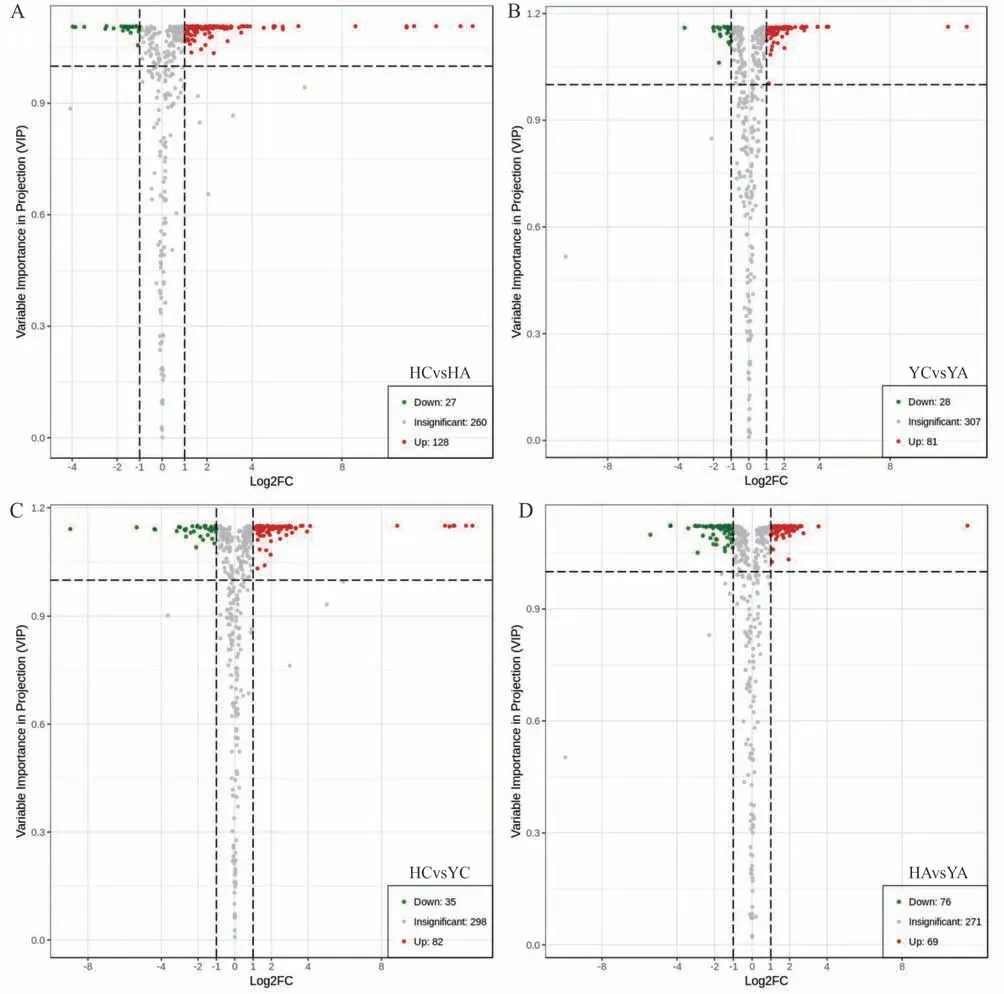
图5 两品种与对照之间的差异代谢物火山图Fig.5 Different metabolite volcano map between samples
对检测到的代谢物进行log2FC 处理后,变化最显著的20(上调和下调)个差异代谢物见图6。
与HC 相比,HA 样品中4 种酚酸类(阿魏酰芥子酰酒石酸异构体、芥子酰芥子酰酒石酸、芥子酰咖啡酰酒石酸异构体和芥子酰咖啡酰酒石酸),4种黄酮(槲皮素-7-O-葡萄糖苷、丙二酰黄豆苷、金圣草黄素7-O-己糖苷和丁香醛)和2 种其它类(驴食草酚和白藜芦醇)的相对含量显著增加;3 种有机酸(柠檬酸、奎尼酸和壬二酸),4 种酚酸类(3,4,5-三甲氧基苯基1-O-D-葡萄糖吡喃苷、trans-3-O-对香豆酰奎尼酸、3-O-(E)-对香豆蔻酰奎宁酸和3-O-对香豆酰奎尼酸),2 种木脂素和香豆素(东莨菪内酯和松脂醇-己糖)和1 种黄酮(矢车菊素3-O-葡萄糖苷)的相对含量降低(图6A)。
与YC相比,YA样品中7种酚酸类(芥子酰-P-香豆酰氨酸、对香豆酰芥子酰酒石酸、对香豆酰芥子酰酒石酸异构体、芥子酰芥子酰酒石酸、芥子酰酒石酸异构体2、芥子酰咖啡酰酒石酸和阿魏酰芥子酰酒石酸),3种黄酮(2-羟基-5-甲氧基-染料木素-4,7-O-二葡萄糖、丁香醛和花生四烯-1)的相对含量显著增加;3 种有机酸(柠檬酸、奎尼酸和壬二酸),2 种酚酸类(苯甲酸和3-O-(E)-对香豆蔻酰奎宁酸),2 种脂质(9,10-二羟基-12-十八酸和花生四烯酸),1 种木脂素和香豆素(东莨菪内酯),1 种氨基酸及其衍生物(L-谷氨酸)和1 种核苷酸及其衍生物(腺苷-3-5-环单磷酸水合物)的相对含量显著降低(图6B)。
与HC 相比,YC 样品中6 种黄酮(槲皮素-7-O-葡萄糖苷、丙二酰黄豆苷、金圣草黄素7-O-己糖苷、槲皮素3,7-二-O-β-D-葡萄糖苷、大豆苷和大豆苷-4-葡萄糖苷),3 种酚酸类(阿魏酰芥子酰酒石酸异构体、芥子酰芥子酰酒石酸和芥子酰咖啡酰酒石酸异构体)和1种其它类(驴食草酚)的相对含量显著增加;6 种黄酮(槲皮素3-O-鼠李糖基半乳糖苷、槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷、槲皮素-3-O-刺槐甙、芦丁、矢车菊素3-O-葡萄糖苷和2-羟基-5-甲氧基-染料木素-4,7-O-二葡萄糖),3种酚酸类(trans-3-O-对香豆酰奎尼酸、3-O-(E)-对香豆蔻酰奎宁酸和3-O-对香豆酰奎尼酸)和1 种木脂素和香豆素(松脂醇-己糖)的相对含量显著降低(图6C)。
与HA 相比,YA 样品中5 种黄酮(槲皮素3,7-二-O-β-D-葡萄糖苷、金圣草黄素O-丙二酰己糖苷、2-羟基-5-甲氧基-染料木素-4,7-O-二葡萄糖、4-羟基甘草查尔酮A 和芹菜素5-O-葡萄糖苷),2 种氨基酸及其衍生物(L-无水天冬酰胺和反-4-羟基-L-脯氨酸),2种酚酸类(芥子酰芥子酰酒石酸和对香豆酰芥子酰酒石酸异构体)和1种萜类(24,30-二羟基-12(13)烯羽扇豆醇)的相对含量显著增加;6 种酚酸类(白皮杉醇、毛蕊糖甙、对香豆酰肉桂酰酒石酸、二对香豆酰苹果酸、绿原酸和肉桂酸),2 种黄酮(2-羟基-5-甲氧基-染料木素-O-鼠李糖-葡萄糖和异鼠李素-3-O-芸香糖苷)和2 种核苷酸及其衍生物(鸟苷3,5-环单磷酸和腺苷-3-5-环单磷酸水合物)的相对含量显著降低(图6D)。
2.5 差异代谢物代谢通路富集分析
基于KEGG 数据库,对差异代谢物进行了KEGG 显著性富集分析[21]。在HCvsHA 鉴定的155个差异代谢物中,有27 个有对应的KEGG 注释,共涉及47 条代谢通路(图7);在YCvsYA 鉴定的109个差异代谢物中,有23 个有对应的KEGG 注释,共涉及47 条代谢通路;在HCvsYC 鉴定的117 个差异代谢物中,有24个有对应的KEGG 注释,共涉及43条代谢通路;在HAvsYA 鉴定的145 个差异代谢物,有42个有对应的KEGG注释,共涉及60条代谢通路。
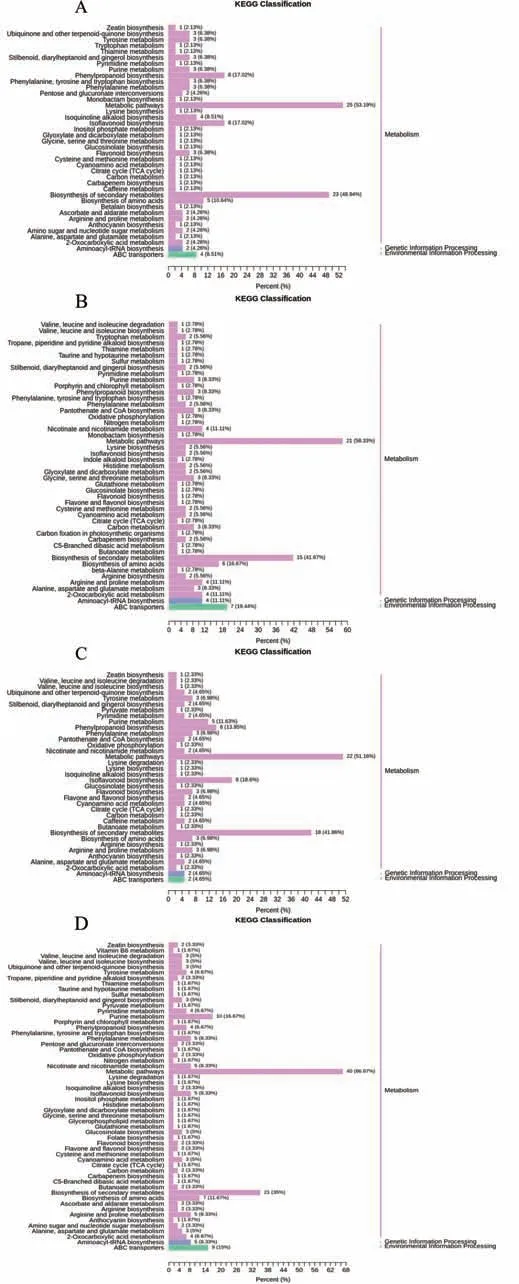
图7 样品差异代谢物KEGG分类图Fig.7 KEGG classification graph of different metabolites
进一步对每条通路途径中富集到的差异代谢物的含量进行分析,异黄酮生物合成、苯丙烷生物合成和异喹啉生物碱生物合成均在HCvsHA 中升高;碳青霉烯生物合成、烟酸和烟酰胺代谢、泛酸和辅酶A 生物合成均在YCvsYA 中升高;异黄酮生物合成、类黄酮生物合成和苯丙烷生物合成均在HCvsYC 中升高;嘌呤代谢、苯丙氨酸代谢和异黄酮生物合成均在HAvsYA中升高(图8)。异黄酮类化合物是苯丙烷类代谢途径的一个分支所合成的一类酚类次生代谢产物。综合分析来看,差异代谢物在异黄酮生物合成代谢通路中富集显著。

图8 样品差异代谢物KEGG富集图Fig.8 KEGG enrich graph of different metabolites
3 讨论与结论
3.1 铝胁迫对花生根系的影响
铝毒是酸性土壤中作物生长最重要的限制因素[9,22]。前人关于花生酸性土铝毒害的相关研究主要集在铝对花生形态、发育和产量的影响方面[2,23]。根系作为铝胁迫最敏感的部位,受到铝胁迫后,主根变粗变短、根尖膨大变褐、侧根和根毛减少甚至消失[5,7],从而抑制养分吸收和干物质积累,但其抑制程度因基因型而异。本研究选用两个基因差异比较大的花生品种为材料,在前期的试验中[17],发现铝胁迫下两个品种的根系存在明显差异。这也与詹洁[13]等人的研究结果相一致。
3.2 铝胁迫对花生根系有机酸的影响
作为植物耐铝性的机制之一,植物可以通过根系分泌有机酸来解除或减轻铝的毒害,分泌的有机酸主要包括柠檬酸、苹果酸及草酸[24]。韦冬萍[10]利用200µmol·L-1AlCl3处理油菜后,与对照相比,根系中的柠檬酸和苹果酸分别增加了111%和223%。本研究发现,铝胁迫下,与对照相比,在两个花生品种中均检测到了含量比较高的三种有机酸,分别为柠檬酸、奎尼酸和壬二酸。
3.3 铝胁迫对花生根系代谢的影响
Xiao 等[21]研究发现,经GO 和KEGG 通路分析,铝胁迫下花生根系幼苗根系中与有机酸转运、金属离子转运、转录调控和程序性细胞死亡(PCD)有关的基因。本研究采用广泛靶向代谢组学技术,以两种不同耐铝性花生品种为材料,研究铝胁迫对其产生的代谢物的影响。从花生幼苗根系中共检测出416 种代谢物,HCvsHA 共筛选出155 个差异代谢物,占共有代谢物的37.26%,YCvsYA 共筛选出109 个差异代谢物,占共有代谢物的26.20%,HCvsYC 共筛选出117 个差异代谢物,占共有代谢物的28.13%,HAvsYA 共筛选出145 个差异代谢物,占共有代谢物的34.86%。主要包含酚酸类、黄酮、有机酸、木脂素和香豆素、氨基酸及其衍生物、核苷酸及其衍生物和其他等次级代谢产物。代谢途径主要涉及糖酵解、三羧酸循环、氧化磷酸化、磷酸戊糖途径、尿素循环、脂肪酸氧化和糖异生作用,提供了花生幼苗根系发育所需要的营养物质和其它代谢所需要的能量(如ATP)。代谢组分析结果与其它研究结果也相似。本研究清楚地揭示,铝胁迫能够显著促进次生代谢产物的合成,这为花生幼苗增强耐铝性提供了重要信息。而本研究主要是针对花生育23 和粤油7 号两个花生栽培品种开展代谢组学研究,为获取尽可能详尽的物质信息,将进一步对花生属中其他种开展研究,为我国南方地区的花生种植奠定理论基础。

