两个大豆ERD15基因的克隆、生物信息学分析及功能初步鉴定
曹沙沙,吴楠,汪丽萍,刘晓宇,汪炜奇,张贵峰,王法微,李晓薇
(吉林农业大学生命科学学院,生物反应器与药物开发教育部工程研究中心,吉林 长春,130118)
大豆(Glycine max)是世界重要的粮油兼用作物,含有丰富的蛋白质和油脂,是人类优质蛋白及畜牧业饲料蛋白的主要来源之一[1~3]。此外,大豆富含异黄酮和酚类化合物[4]等植物化学物质,有助于降低心脏病或心血管疾病、骨质疏松症和癌症[5]等风险,与人的健康息息相关。自然界中干旱胁迫是影响全球大豆生长、发育和产量的主要因素,通常使大豆产量减少约40%,根据干旱程度和生长阶段的不同甚至减少高达80%[6~8]。要解决这个问题,需要培育出耐旱大豆新品种[9]。植物在受到干旱胁迫时,自身本能地会从生理、细胞和分子水平上做出反应,诱导多个胁迫相关基因的表达,促进一些参与抗旱防御代谢产物的合成,从而调节植物对干旱胁迫的耐受性[10,11]。
ERD(early responsive to dehydration)作为早期干旱响应基因,在植物逆境胁迫和生长发育中具有功能性作用[12]。在拟南芥中已鉴定出16 个ERD基因的cDNA,它们属于不同的基因家族,编码不同的蛋白质[13]。ERD1编码叶绿体ATP依赖蛋白酶,受干旱和高盐胁迫诱导表达[14,15];ERD13编码植物特异性硫代谷胱甘肽转移酶;ERD14编码脱水素蛋白,该蛋白的累积和环境的干旱胁迫密切相关[12];ERD16编码一种泛素化延伸蛋白[16];ERD15基因受各种生物因子和非生物因子的诱导表达,是ABA(脱落酸)反应和依赖SA(水杨酸)防御途径的重要调节器[17]。目前对ERD15的研究表明其主要与胁迫响应有关:在拟南芥干旱胁迫处理1 h 后检测到ERD15基因在叶片强烈表达,也被证明是ABA 信号的负调节因子[18];葡萄ERD15基因经一系列反应后增强其耐寒性[19];番茄在受到干旱胁迫、盐胁迫、低温胁迫时体内的ERD15基因表达量增加[20]。所以,不同植物中ERD15基因可能具有不同的功能。
大豆ERD15基因家族共有6 个成员,前期从抗逆基因表达文库中筛选获得GmERD15a、GmERD15b、GmERD15c三个基因。本文主要对GmERD15a和GmERD15b进 行 研 究,GmERD15c基因另文研究发表。本研究初步探究两个大豆ERD15基因的功能,以Williams 82 大豆为实验材料,克隆获得GmERD15a和GmERD15b基因全长后,进行生物信息学分析,并研究其组织表达特性和抗逆性,为深入研究该基因的功能和作用机理提供理论依据。
1 材料与方法
1.1 材料
Williams 82 大豆材料,pMD18-T 载体,pCAMBIA3301 植物表达载体,pYES2 酵母表达载体,大肠杆菌DH5α,酿酒酵母INVSc1。
1.2 方法
1.2.1 RNA 的提取和cDNA 的制备 使用RNAiso Plus(TaKaRa 公司)试剂提取大豆不同组织部位的RNA,并使用PrimeScriptTMRT reagent Kit with gDNA Eraser-Perfect Real Time 试剂盒将其反转录成cDNA。
1.2.2 两个大豆ERD15基因的克隆 通过NCBI查找GmERD15a和GmERD15b的基因序列,使用Primer 5 软件设计基因全长引物(表1)。以反转录的大豆根cDNA 为模板,进行PCR 扩增获得目的基因片段,获得的PCR 产物经凝胶电泳后使用DNA凝胶回收试剂盒进行胶回收,胶回收产物连接至表达载体并转入大肠杆菌DH5α 中,测序成功,保存于-80℃冰箱备用。

表1 实验所用引物Table 1 Primers of the test
1.2.3 两个大豆ERD15 蛋白的生物信息学分析通过DNAMAN 软件对多个植物的ERD15 家族成员进行多重序列比对;利用MEGA X 软件构建ERD15系统进化树,通过iTOL(https://itol.embl.de/)对该系统进化树进行美化;使用ProtParam(https://web. expasy. org/protparam/)对GmERD15a 和GmERD15b 进行蛋白理化性质分析;使用ProtScale(https://web.expasy. org/protscale/)对两个蛋白进行亲疏水性分析;通过SOPM(https://npsa-prabi. ibcp. fr/cgi-bin/npsa automat. pl?page=npsa_sopma. Html)对两个蛋白质的二级结构进行预测,并通过SWISS-MODEL(http://swissmodel. expasy. org/)构建两个蛋白质的三级结构模型;使用MEME(https://meme-suite. org/meme/)分析两个蛋白质的motif;通过在线网站plantCARE(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[21]和TBtools 对ERD15 的启动子元件进行分析;利用PSORT(https://www. genscript.com/psort. html)在线网站进行亚细胞定位预测分析。
1.2.4 实时荧光定量PCR 根据基因全长设计基因GmERD15a和GmERD15b的实时荧光定量PCR引物[22](表1),使用购于Monad 公司的MonAmp TM ChemoHS qPCR Mix试剂进行实时荧光定量PCR。
1.2.5 酵母体系中两个大豆ERD15基因的抗逆性鉴 定 构 建 pYES2-GmERD15a 和 pYES2-GmERD15b 表达载体,转入酿酒酵母INVSc1 细胞中。将转化后的酵母细胞使用YPD 液体培养基培养后,调节OD600为0.5,用0.9%的NaCl依次稀释浓度至10-1、10-2、10-3、10-4。配置YPD 固体培养基,分别加入1 mol/L 甘露醇、700 mmol/L NaCl、20 mmol/L NaHCO3进行胁迫处理,将不同浓度梯度的酵母细胞在YPD 空白培养基和胁迫培养基上培养3~7 d,以YPD 空白培养基为对照观察并记录不同胁迫条件下对照酵母细胞与重组酵母细胞的生长状态[23]。
2 结果与分析
2.1 GmERD15a和GmERD15b基因的克隆
以大豆根组织cDNA 为模板,进行PCR 扩增,获得GmERD15a、GmERD15b基因全长;电泳结果显示:GmERD15a基因全长378 bp,GmERD15b基因全长318 bp(图1)。GmERD15a和GmERD15b分别编码125和105个氨基酸。

图1 GmERD15基因片段扩增检测Fig.1 Amplification of GmERD15 gene fragment
2.2 大豆ERD15基因家族的生物信息学分析
2.2.1 ERD15 的多重序列比对以及进化树分析通过NCBI 筛选获得11 个物种的17 个ERD15 家族成员;ERD15 蛋白家族成员都在120~170 氨基酸之间,基因组学研究证实,它们都包含一个与PABP(poly(A)binding protein)相互作用的高度保守功能结构域PAM2。通过DNAMAN 将ERD15 的家族成员进行多重序列比对(图2),结果表明GmERD15 蛋白与其它物种的蛋白序列之间的序列相似度比较高,说明该蛋白在进化上比较保守。

图2 GmERD15与近缘植物ERD15蛋白序列的多重比对Fig.2 Alignment analysis between GmERD15 and ERD15 proteins sequences in kindred plant species
为进一步探究GmERD15 与不同物种的进化关系,利用MEGA7.0 软件通过邻接法得到11 个物种基因家族的系统进化树(图3)。该系统进化树结果显示,GmERD15a与GmERD15c相似性最高,其次是JrERD15;GmERD15b 与GmERD15f 相似性最高,其次是VaERD15。

图3 GmERD15与其他植物ERD15蛋白的系统进化分析Fig.3 Phylogenic analysis of GmERD15 and ERD15 proteins in kindred plant species
2.2.2 GmERD15a 和GmERD15b 蛋白的理化性质分析 通过ProtParam 在线网站分析(表2),GmERD15a 的分子式为C667H984N178O192S4,分子量为14 696.47 Da,理论等电点为5.0,21 个带负电荷残基总数(Asp+Glu)、16 个带正电荷残基总数(Arg +Lys),因此该蛋白带负电,预测该蛋白为酸性蛋白,不稳定系数为45.97,脂肪系数为60.8,亲疏水性平均系数为-0.728。

表2 GmERD15蛋白的理化性质Table 2 Physicochemical properties of GmERD15 proteins
GmERD15b 的分子式分别为C536H769N131O176S1,分子量为11 895.83 Da,理论等电点3.82,22 个带负电荷残基总数(Asp + Glu)、4 个带正电荷残基总数(Arg+Lys),因此该蛋白带负电,预测该蛋白为酸性蛋白,不稳定系数为52.91,脂肪系数为67.81,亲疏水性平均系数为-0.521。
通过ProtScale 在线网站分析,结果显示:GmERD15a 和GmERD15b 蛋白均为亲水性蛋白质(图4)。

图4 GmERD15a(A)和GmERD15b(B)蛋白的亲疏水性分析Fig.4 Analysis of hydrophilic and hydrophobic of GmERD15a(A)and GmERD15b(B)
2.2.3 GmERD15a 和GmERD15b 蛋白结构预测及启动子元件分析 根据NCBI 数据库获得两个大豆ERD15基因序列信息,预测蛋白质的二级和三级结构并对其启动子元件进行分析。预测蛋白质结构如图5A、5B 所示,GmERD15a 和GmERD15b 蛋白质的二级结构由α-螺旋、β-转角、无规则卷曲和片层结构组成;GmERD15a 蛋白中无规则卷曲所占组分最高,为40. 80%;其次为α-螺旋,占29.60%;β-转角所占组分为8.00%,片层结构占21.60%;GmERD15b 蛋白中无规则卷曲所占组分最高,为41. 90%;其次为α-螺旋,占33.33%;片层结构占15.24%;β-转角所占组分为9.52%。两个蛋白质的三级结构如图5C、5D所示。

图5 GmERD15a和GmERD15b蛋白的结构预测Fig.5 Structural prediction of GmERD15a and GmERD15b proteins
通过NCBI 数据库下载得到两个大豆ERD15基因起始密码子ATG 上游2000 bp 序列,利用Plant-CARE 网站分析启动子顺式作用元件。结果显示(图6),ERD15起始密码子上游存在激素响应应答元件(TATC-box、P-box、ABRE, TCA-element)以及逆境胁迫响应顺式元件(ARE, TC-rich repeats,LTR,MBS)。

图6 GmERD15a和GmERD15b的启动子元件分析Fig.6 Promoter element analysis of GmERD15a and GmERD15b
2.2.4 GmERD15a 和GmERD15b 蛋白的亚细胞定位预测分析 通过PSORT 进行亚细胞定位预测分析,结果表明(表3),GmERD15a 与GmERD15b 蛋白存在于细胞质中的可能性最大,其次是细胞核。前人研究结果表明,GmERD15a 蛋白定位于细胞核[24]。

表3 GmERD15的亚细胞定位预测Table 3 Subcellular localization prediction of GmERD15
2.3 GmERD15a 和GmERD15b 基因的组织特异性表达分析
为了研究GmERD15基因的组织表达模式,对大豆的根、茎、叶、花、20 d 的胚(指开花后20 d 的胚)、30 d、40 d、50 d及68 d的胚、种子进行了实时荧光定量PCR。 结果显示,GmERD15a与GmERD15b在不同组织中均有表达(图7)。GmERD15a在20 d的胚中表达量最高,其次依次是根、种子、花、叶、茎;GmERD15b在根中的表达量最高,其次依次是花、20 d的胚、叶、茎、种子。
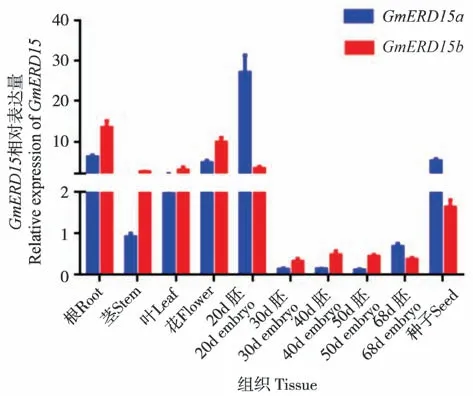
图7 GmERD15a和GmERD15b组织表达情况Fig.7 Tissue expression analysis of GmERD15a and GmERD15b
2.4 GmERD15a 和GmERD15b 基因在酵母体系中的抗逆性鉴定
将构建完成的酵母表达载体转入酿酒酵母细胞中,在酵母体系中进行验证。分别在干旱胁迫、盐胁迫和碱胁迫培养基上培养不同浓度梯度的酵母细胞,实验结果显示(图8),正常条件下,重组酵母与对照酵母的生长无明显差异;由10-2、10-3浓度下可以明显看出,在YPD 培养基上培养的酵母细胞与在胁迫培养基上培养的酵母细胞相比长势较好,说明胁迫条件影响了对照酵母和重组酵母的生长;同样在10-2、10-3浓度下可以明显看出,在干旱胁迫和盐胁迫条件下,对照酵母与重组酵母相比长势较好,说明重组酵母对干旱胁迫和盐胁迫更加敏感,在碱胁迫条件下对照酵母和重组酵母的生长无明显差异。由此可见,GmERD15a、GmERD15b基因可能为干旱胁迫和盐胁迫的负调节因子。
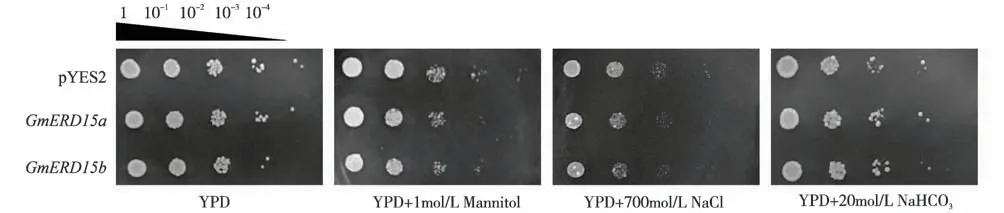
图8 GmERD15a和GmERD15b在酵母体系中的抗逆性鉴定Fig.8 Identification of stress resistance of GmERD15a and GmERD15b in yeast system
3 讨论与结论
早期干旱响应基因ERD15最早在拟南芥中被发现,编码一个小的酸性蛋白质[25]。本研究以大豆根cDNA 为模板克隆出GmERD15a和GmERD15b基因的全长,GmERD15a基因全长378 bp,编码125 个氨基酸,GmERD15b基因全长318 bp,编码105 个氨基酸,通过生物信息学分析,结果显示,GmERD15a和GmERD15b 均为酸性、亲水性蛋白。Ziaf[20]对番茄ERD15基因进行组织表达分析,结果表明SpERD15在不同组织中均有表达。本实验结果显示GmERD15a和GmERD15b基因在大豆不同组织中也均有表达。
拟南芥ERD15参与多种生物胁迫和非生物胁迫反应[26]。前人在拟南芥中研究发现,AtERD15在干旱诱导后表达,在干旱胁迫条件下拟南芥AtERD15敲除株系比野生型和超表达株系长势好,因此AtERD15为干旱负调控因子[17,18];本研究通过酵母表达体系验证GmERD15a基因和GmERD15b基因的抗逆性,实验结果表明,GmERD15a基因和GmERD15b基因为干旱胁迫和盐胁迫的负调控因子。先前学者通过与NRP-B 启动子的酵母杂交筛选鉴定出GmERD15a在内质网和渗透胁迫诱导下激活NRP 基因的表达;GmERD15a在体内外结合并激活NRP-B 启动子,表现出转录活性[27];不仅在大豆中验证ERD15具有转录激活活性,桑树ERD15也被Saeed[28]证明具有转录激活活性。
本研究初步探究GmERD15a和GmERD15b基因的功能,为深入研究该基因的作用机理提供理论依据,有助于筛选或培育耐旱、耐盐大豆新品种。

