含铜含镍污泥浸出液铜镍提取的影响因素研究
姜中孝
(上海市政工程设计研究总院(集团)有限公司,上海 200092)
铜、镍均为我国工业发展不可或缺的金属元素,随着国家社会经济的发展,各行业对铜、镍金属的需求不断增大。目前,铜金属被广泛地应用于电力、电子、能源、石化、机械、冶金、交通、轻工和新兴产业等领域。镍更被视为国民经济建设的战略物资,其资源的有效开发与利用一直为各国所重视。含铜含镍污泥不仅是一类危险废物,其自身含有一定量的铜镍化合物,合理有效的资源化利用不仅可解决环境污染问题,而且能回收一定价值的金属,有利于我国建立资源循环型经济体系[1]。
含铜含镍污泥根据所含元素种类的不同可分为分质污泥和混合污泥[2]。分质污泥所含主要金属为单一元素,主要来源于产业较为单一的生产企业。混合污泥所含金属元素较为多样,来源于不同种类的金属处理。由于金属加工行业的多样性,实际产生的工业污泥多为混合污泥。混合污泥所含元素种类多,成分复杂,资源化利用困难,其合理处置已成为目前危险废物处理利用行业的难题。我国国内已有少量重金属污泥处理利用工业实践案例,但处理污泥所含金属元素较为单一,目前应对大多数成分复杂的重金属混合污泥资源化工程案例较少。湿法回收工艺是含铜含镍污泥资源化利用的常见工艺。其工艺流程主要分为污泥浸取、浸出液除杂、铜元素回收、镍元素回收、产品包装等。化学沉淀法是湿法回收工艺的一种,其工艺流程简单,废水产生量较少。
前人对采用化学沉淀法提取含铜废液中铜元素做了部分研究,但含铜含镍污泥浸出液中利用Na2CO3溶液提取铜镍元素的相关研究较少。唐永革等[3]研究了分布沉淀法在新疆阜康冶炼厂尾渣金属富集中的应用。研究表明,采用黄钠铁矾法去除浸出液中的Fe3+,最佳温度控制在70 ℃,最佳pH控制在2.0~2.2。沉镍反应最佳终点pH应大于8.2。温炎燊等[4]对含铜蚀刻废液除杂、回收铜做了试验研究。结果表明,向含铜蚀刻废液中添加0.02~0.03 mol/L Na2CO3溶液,将反应液pH控制在3.5~4.0,可去除蚀刻废液中大部分杂质。Na2CO3溶液与含铜废液反应温度控制在70~80 ℃,pH为8~9,碱式碳酸铜产品中,铜的质量分数可达56%。
碱式碳酸铜、碱式碳酸镍均为重要的化工原料,碱式碳酸铜广泛应用于生产木材防腐剂、饲料添加剂、有机催化剂和杀虫剂等[5]。碱式碳酸镍可用作催化剂、镍盐原料、陶瓷工业着色剂和pH调整剂等[6]。本文探究了一种含铜含镍污泥资源化工艺,实现污泥中铜镍元素的回收利用,产品为碱式碳酸铜、碱式碳酸镍。其间通过实验室试验进一步分析了Na2CO3溶液回收含铜含镍污泥硫酸浸出液中铜镍的工艺参数,考察了pH、反应时间、反应温度对NaOH除杂、Na2CO3沉铜沉镍反应过程的影响,为进一步工程应用提供参考。
1 工艺流程简介
如图1所示,主要生产工艺流程为:含铜含镍污泥硫酸浸取→浸出液Na2S2O5还原→NaOH溶液除杂→Na2CO3溶液回收铜镍。含铜含镍污泥首先经硫酸溶液浸取,浸取混合物经压滤分离后得到浸出液。含铜含镍污泥呈氧化性,浸出液含有少量Cr6+。利用Na2S2O5溶液还原浸出液中的Cr6+,主要反应为
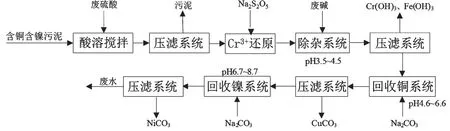
图1 利用Na2CO3回收铜镍的工艺流程
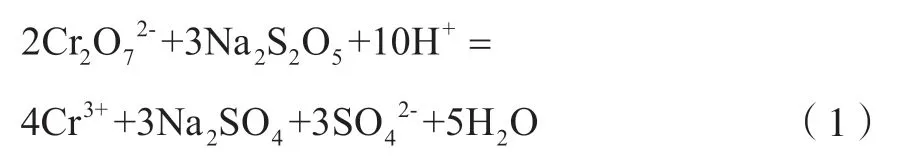
还原反应完成后,利用浓度10%的NaOH溶液调节浸出液pH,除去其中的主要金属杂质Cr3+、Fe3+,主要反应为
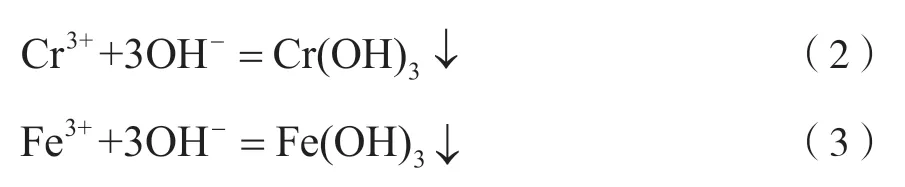
除杂后浸出液进行压滤,然后进一步与浓度10%的Na2CO3溶液发生中和反应,通过调节pH控制反应产物,回收碱式碳酸铜和碱式碳酸镍产品,主要反应为
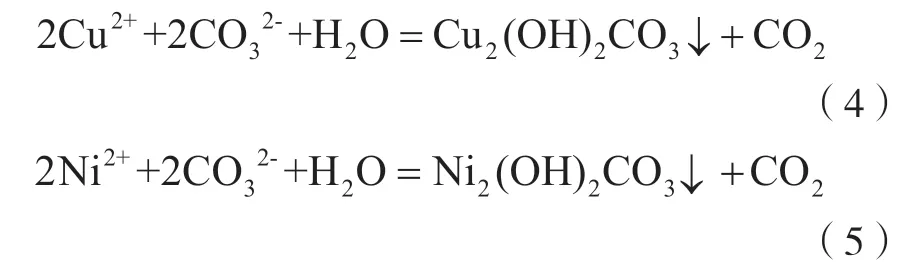
2 试验样品、器材及方法
2.1 试验样品
选用厦门某电镀企业产生的含铜含镍污泥样品,其成分分析如表1所示。含铜含镍污泥样品经简单破碎后筛分至粒径小于1 mm。污泥浸出采用浓度10%的硫酸溶液。浸出液除杂采用浓度10%的NaOH溶液,沉铜沉镍反应采用浓度10%的Na2CO3溶液。

表1 污泥样品成分分析
2.2 试验器材
试验器材主要有德国斯派克等离子体发射光谱仪、Vacuumer直接型旋转真空抽滤装置(VOP-100)、数显恒温水浴锅、pH分析仪(精度0.1)、氧化还原电位(ORP)测定仪、电子天平(精度0.001 g)、实验室用搅拌机、烧杯、量筒、滴定管和橡胶手套等。试验经多次重复,再现性良好。
2.3 试验方法
首先制取含铜含镍污泥硫酸浸出液样品,将30 g污泥样品置于烧杯中,投加120 mL去离子水,并采用实验室用搅拌装置搅拌20 min,采用滴定管向烧杯中添加配制好的H2SO4溶液(浓度10%),利用pH计实时测定烧杯中pH,维持溶液pH为1。反应过程中,将盛有混合液的烧杯置于温度20 ℃的水浴中,并不断搅拌。酸溶浸取反应进行120 min后,将酸浸后的混合液抽滤,得到后续试验浸出液样品。
采用滴定管依次向一定量的浸出液中添加Na2S2O5溶液,反应30 min后用滴定管向还原后的浸出液中添加浓度10%的NaOH溶液,利用pH计测定各烧杯中溶液pH,直至烧杯中浸取液达到目标pH,并保持pH恒定。反应过程中,将反应溶液烧杯置于一定温度的水浴锅中,并搅拌一段时间。反应进行一定时间后,分别将反应后的两相混合液抽滤。滤渣采用相同pH稀硫酸溶液搅拌洗涤后再次抽滤。采用等离子体发射光谱仪对反应后的浸出液进行Cu2+、Ni2+、Cr3+、Fe3+测定。加碱沉淀后,不同金属离子的去除率计算公式为

式中:η杂为加碱沉淀后金属离子去除率,%;C1为加碱反应前浸出液中金属离子浓度,mol/L;C2为反应抽滤后溶液中某种金属离子的浓度,mol/L;V1为加碱反应前浸出液体积,L;V2为加碱反应后混合液抽滤后溶液体积,L。
采用滴定管依次向除杂后的浸出液中添加浓度10%的Na2CO3溶液。利用pH计测定各烧杯中溶液pH,直至浸出液pH达到目标值,并保持pH恒定。将反应溶液烧杯置于一定温度的水浴锅中,并搅拌一段时间。沉淀反应进行一定时间后,分别将反应后的溶液抽滤。滤渣采用去离子水洗涤后再次抽滤。采用等离子体发射光谱仪对烧杯中的浸出液进行Cu、Ni测定。沉淀反应后,铜、镍离子回收率的计算公式为
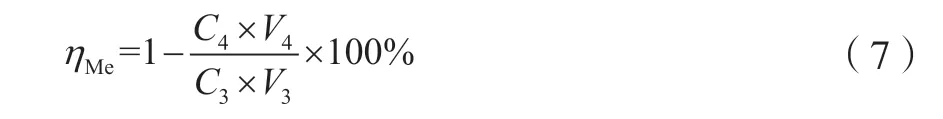
式中:ηMe为沉淀反应后铜、镍离子回收率,%;C3为沉淀反应前溶液中铜、镍离子浓度,mol/L;C4为沉淀反应后溶液中铜、镍离子浓度,mol/L;V3为沉淀反应前溶液体积,L;V4为沉淀反应后混合液抽滤后溶液体积,L。
3 试验结果及讨论
3.1 pH对Cr3+、Fe3+、Cu2+、Ni2+沉淀的影响
除杂试验的原理是溶液中不同金属离子氢氧化物对应不同的溶度积,其在不同环境下(pH、温度等)具有不同的溶解能力,从而实现不同金属离子的分离。如果离子积大于溶度积,就会发生沉淀,如果离子积小于溶度积,就会发生溶解。浸出液中不同金属离子以氢氧化物的形式沉淀析出的pH计算公式为
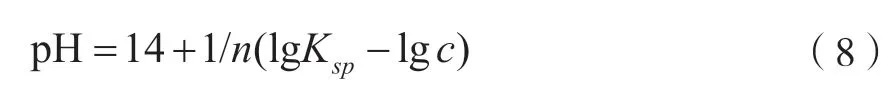
式中:Ksp为金属氢氧化物(Me(OH)n)的溶度积[7];c为目标金属离子被认为完全沉淀时溶液中尚存的金属离子(Men+)浓度,定义溶液目标金属离子完全沉淀时的浓度为10-5mol/L。
4种金属离子氢氧化物完全沉淀的pH理论计算结果详情如表2所示。其中,沉淀终点OH-离子浓度为c1,沉淀终点H+离子浓度为c2。
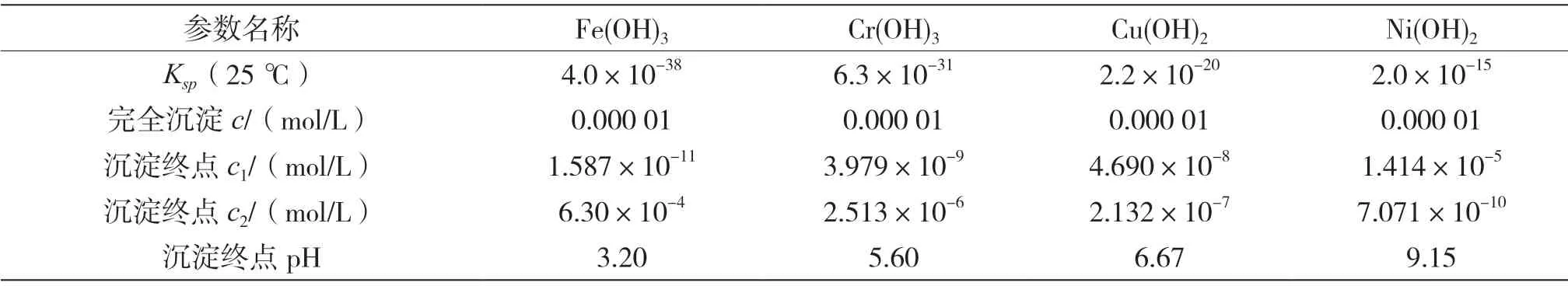
表2 离子完全沉淀理论pH
当反应温度为20 ℃,含铜含镍污泥浸出液加碱沉淀反应120 min时,4种金属离子沉淀率随pH的变化曲线如图2所示。从试验结果可以看出,随着溶液pH增大,4种金属离子沉淀率逐渐增加,溶液中Cr3+、Fe3+、Cu2+、Ni2+含量均逐渐减小。与理论计算相比,4种金属离子完全沉淀pH更高。由试验结果可知,溶液pH为2时,Fe3+已开始产生沉淀,Fe3+沉淀率为45.3%。因此,Fe3+实际发生沉淀的起始pH应小于2,此时Cr3+、Cu2+、Ni2+产生的沉淀量很少,可忽略不计。pH为3时,Cr3+已出现少量沉淀,Cr3+发生沉淀的起始pH为2~3。pH为5时,Cu2+出现沉淀,说明Cu2+发生沉淀的起始pH为4~5。在此pH下,Fe3+已基本沉淀完全,Cr3+绝大部分已发生沉淀,Cr3+沉淀率为92.8%。Ni2+发生沉淀的起始pH为6~7。除杂反应重点是去除Cr3+、Fe3+,由试验结果可知,浸出液最佳除杂pH为4~5。
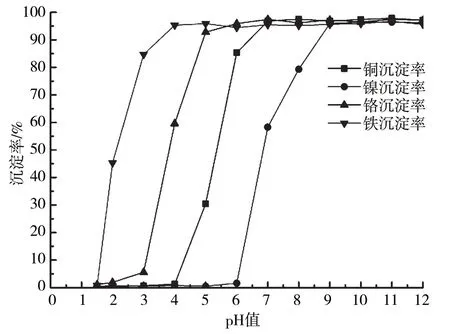
图2 金属离子加碱沉淀特性随pH的变化曲线
3.2 反应温度对Cr3+、Fe3+、Cu2+、Ni2+加碱沉淀的影响
当pH为4.5,含铜含镍污泥浸出液加碱反应15 min和120 min时,浸出液中4种金属离子沉淀率随温度的变化曲线如图3所示。从图3可以看出,在该反应条件下反应15 min后,随着反应温度的升高,浸出液中Cr3+、Fe3+沉淀率均逐渐增大,反应温度的升高对沉淀反应具有促进作用。反应温度为70 ℃时,Cr3+、Fe3+沉淀率分别达到44.5%与65.3%。
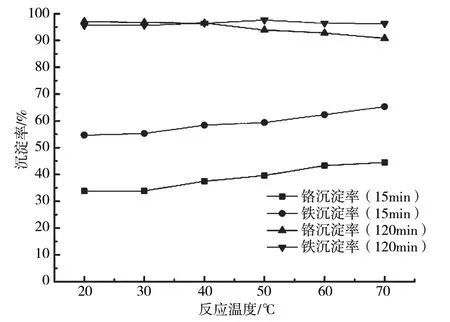
图3 金属离子沉淀特性随反应温度的变化曲线
反应120 min后,Fe3+最终沉淀率达到较高值,随着反应温度升高,其略微增大。但是,Cr3+沉淀率随温度升高先增大后减小。反应温度为70 ℃时,Cr3+最终沉淀率为90.8%。这可能是因为金属离子加碱沉淀反应是吸热反应,温度升高对沉淀反应有促进作用,加快了反应,增强了Fe3+的最终除杂效果。但温度升高同时使Cr(OH)3溶度积增大,在较高温度下,Cr3+完全沉淀pH增大。
3.3 反应时间对Cr3+、Fe3+、Cu2+、Ni2+加碱沉淀的影响
当pH为4.5,反应温度为20 ℃时,含铜含镍污泥浸出液中4种金属离子沉淀率随反应时间的变化曲线如图4所示。从图4可以看出,该反应条件下,随着反应时间的延长,污泥中Cr3+、Fe3+沉淀率均逐渐增大。沉淀反应60 min后,两种金属离子沉淀率均可达到较高值,Cr3+沉淀率大于90%,Fe3+沉淀率大于95%。本试验对工程应用中除杂工序的反应时间选择具有一定的参考意义。
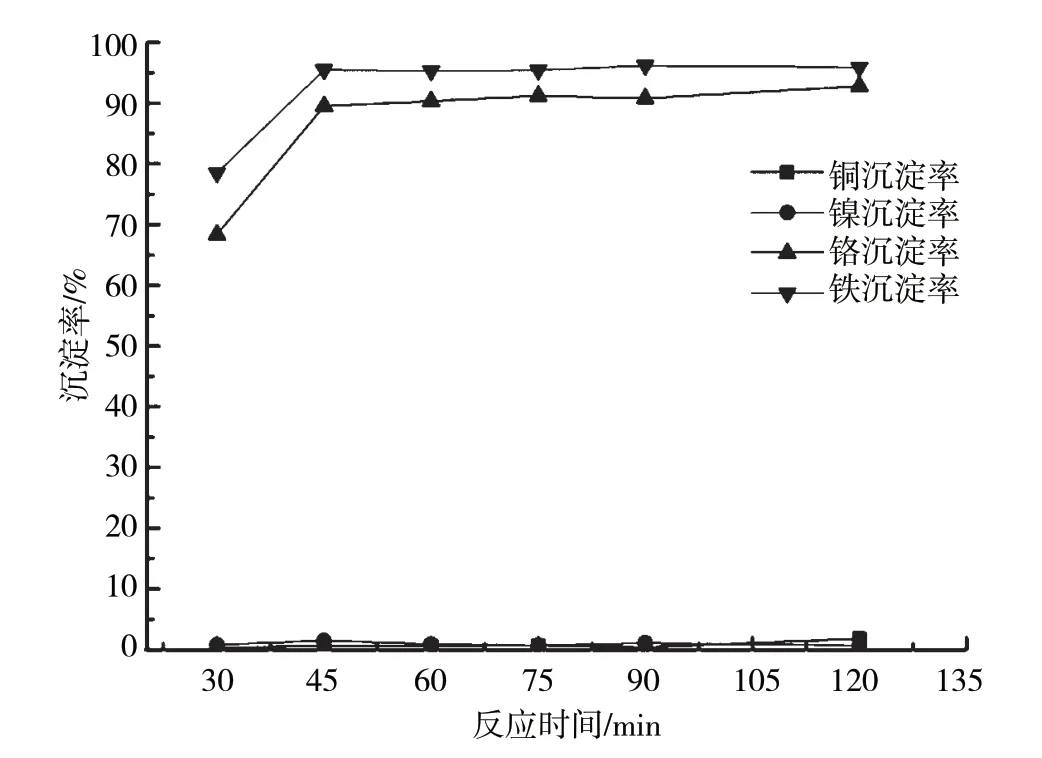
图4 金属离子加碱沉淀特性随反应时间的变化曲线
3.4 pH对Na2CO3溶液沉淀Cu2+、Ni2+的影响
当反应温度为60 ℃时,含铜含镍污泥浸出液除杂后添加浓度10%的Na2CO3溶液反应120 min,浸出液中Cu2+、Ni2+沉淀率随pH的变化曲线如图5所示。从试验结果可以看出,随着溶液pH增大,Cu2+率先发生沉淀,起始沉淀pH为4~5,pH为6时,Cu2+已完全沉淀,溶液中Ni2+含量几乎无变化,说明碳酸钠沉淀法对Cu2+、Ni2+分步沉淀来说是可行的,沉铜工艺最佳反应pH为6。Ni2+起始沉淀pH为6~7,pH为6时,Cu2+已基本完全沉淀,沉淀率达96.4%。Ni2+完全沉淀pH为8~9。
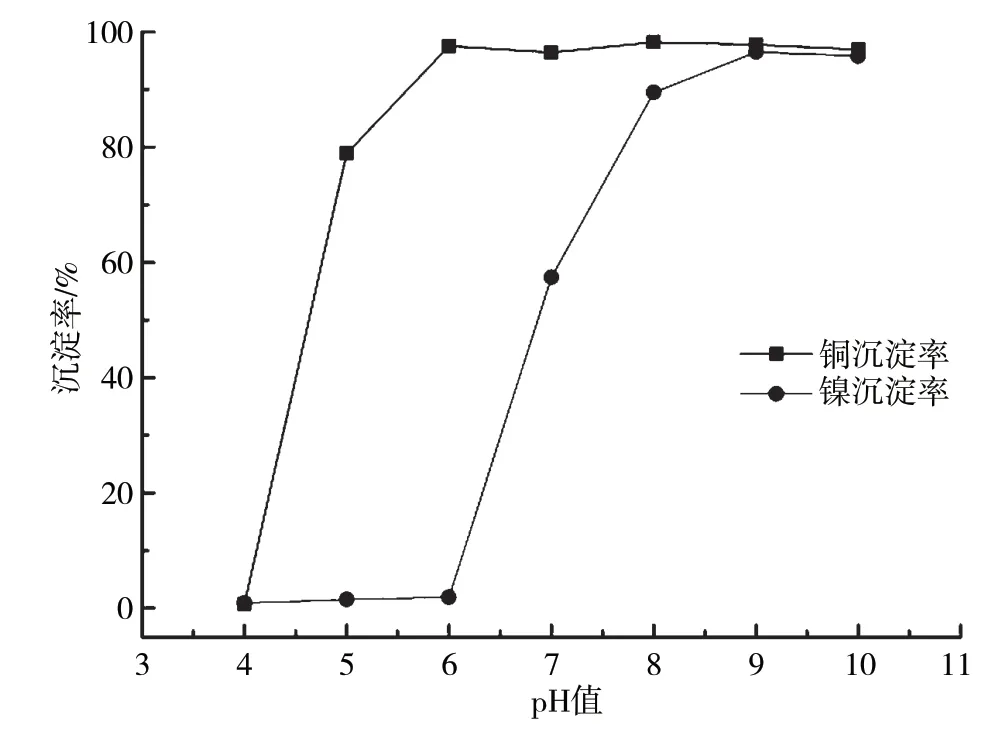
图5 碱式碳酸铜、碱式碳酸镍沉淀特性随pH的变化曲线
3.5 反应温度对Na2CO3溶液沉淀Cu2+、Ni2+的影响
含铜含镍污泥浸出液除杂后,添加浓度10%的Na2CO3溶液,维持反应pH为6和9,反应15 min和120 min后,溶液中Cu2+、Ni2+沉淀率随反应温度的变化曲线如图6所示。
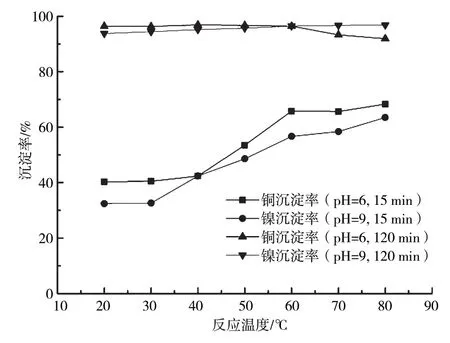
图6 反应温度对沉铜沉镍反应影响的变化曲线
从图6可以看出,反应时间为15 min时,Cu2+(pH=6)、Ni2+(pH=9)沉淀率均随反应温度升高而增大,提高反应温度对反应速率有明显的促进作用。pH为6,反应时间为120 min时,随着反应温度的升高,溶液中Cu2+最终沉淀率略有下降,反应后的絮状沉淀物逐渐由蓝色向绿色转变。反应温度为40 ℃时,Cu2+沉淀率最高,可达96.9%。反应温度为80 ℃时,Cu2+沉淀率下降至91.4%。pH为9,反应时间为120 min时,Ni2+沉淀率随着反应温度的升高而增大。反应温度为80 ℃时,Ni2+沉淀率可达96.8%。
4 结论
Cr3+、Fe3+、Cu2+、Ni2+四种金属离子的完全沉淀pH比理论计算值更大。为保证除杂反应尽量少除去目标金属,采用加碱沉淀法的最佳反应pH应控制在4~5。Cr3+、Fe3+沉淀率随反应时间的延长而增大,溶液pH为4.5时,浸出反应60 min后,Cr3+、Fe3+沉淀可达平衡状态。提高反应温度对浸出液中Cr3+、Fe3+除杂反应具有促进作用,加快了反应,但同时也使Cr(OH)3溶度积增大,导致Cr3+最终去除率降低。Na2CO3溶液沉淀Cu2+的起始pH为4~5,pH为6时,其已完全沉淀。Ni2+起始沉淀pH为6~7,完全沉淀pH为8~9。提高沉铜沉镍反应温度可加快反应速率,但反应温度达到40 ℃后,继续提高反应温度,Cu2+最终沉淀率略有下降。

