鼠尾藻多糖的超声-微波联用提取工艺优化及其抗氧化活性研究
刘亚倩,许海燕,王 珊,任晓东
(1.陕西国际商贸学院医药学院,陕西 西安 712046;2.西安交通大学第一附属医院,陕西 西安 710061)
鼠尾藻(Sargassumthunbergii)为褐藻门马尾藻科的一种植物,主要分布在我国辽宁、山东、江浙一带[1-2]。鼠尾藻营养丰富,药用与保健价值较高,是优质的天然饵料,在医药、化工、废水处理等领域都有广泛应用[3-6]。鼠尾藻多糖具有降血糖、抗肿瘤、抗炎、抗氧化等作用[7-8]。鼠尾藻多糖的提取多采用超声提取法或微波提取法[9-10],而超声-微波联用技术具有溶剂用量少、提取时间短、提取率高等特点,应用于中药有效成分提取具有更大的优势[11-12]。鉴于此,作者采用超声-微波联用技术提取鼠尾藻多糖,通过单因素实验及响应面实验优化提取工艺,并通过测定鼠尾藻多糖对DPPH自由基、ABTS自由基的清除能力,评价其抗氧化活性,拟为鼠尾藻的开发应用提供依据。
1 实验
1.1 材料、试剂与仪器
鼠尾藻(100目),山东省长岛鸿利饵料有限公司。
D-葡萄糖标准品、维生素C(VC)标准品、ABTS、DPPH,上海源叶生物科技有限公司。
TU-1950型双光束紫外分析仪,北京普析通用仪器有限公司;XH-300A型电脑微波超声波组合合成萃取仪,北京祥鹄科技发展有限公司;LGJ-12D型冷冻干燥机,北京四环起航科技有限公司。
1.2 鼠尾藻多糖的提取[13]
称取适量100目鼠尾藻粉末,按液料比8∶1(mL∶g,下同)加入95%乙醇,于70 ℃下连续回流提取4 h;过滤,将滤渣低温干燥,去除脂类及色素等杂质后用万能粉碎机粉碎,置于具塞锥形瓶中,加入适量纯化水,置于电脑微波超声波组合合成萃取仪内,设置时间、温度、超声功率、微波功率等参数进行提取;提取液经抽滤后,采用Sevage法去除蛋白[14];按体积比2∶1向提取液中加入氯仿-正丁醇(5∶1,体积比)混合液,混合后振摇30 min,4 000 r·min-1离心5 min,上清液即为鼠尾藻多糖提取液。
1.3 鼠尾藻多糖提取率的测定
1.3.1 D-葡萄糖标准曲线的绘制
精密称取D-葡萄糖标准品0.010 8 g,加纯化水溶解后移至100 mL容量瓶中,定容至刻度,得浓度为0.108 mg·mL—1的D-葡萄糖标准溶液。参照文献[15]分别精密移取D-葡萄糖标准溶液0.1 mL、0.3 mL、0.5 mL、0.8 mL、1.0 mL、1.2 mL、1.5 mL置于25 mL容量瓶中,加入纯化水至2 mL,混匀;加入5%苯酚溶液1 mL,摇匀;快速滴加浓硫酸5 mL,充分摇匀;静置10 min后,于40 ℃水浴保温20 min,冷却至室温,测定490 nm处吸光度。以2 mL纯化水加入相应的试剂作为空白。以D-葡萄糖浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,拟合得线性回归方程为:A=0.0545c+0.2303,R2=0.9996。表明D-葡萄糖浓度在1.35~20.25 μg·mL—1范围内与吸光度线性关系良好。
1.3.2 鼠尾藻多糖提取率的计算
称取鼠尾藻粉末1.000 0 g,按1.2方法制备鼠尾藻多糖提取液;精密量取2 mL提取液于100 mL容量瓶中,加纯化水定容至刻度,即得鼠尾藻多糖样品溶液。取样品溶液,按1.3.1方法测定吸光度,按式(1)计算鼠尾藻多糖提取率:
(1)
式中:c为经标准曲线方程计算得到的多糖浓度,μg·mL—1;V为提取液体积,mL;n为稀释倍数;m为鼠尾藻粉末质量,g。
1.4 超声-微波联用提取工艺优化
1.4.1 单因素实验[16-17]
分别考察提取时间(15 min、30 min、45 min、60 min、75 min)、微波功率(150 W、250 W、350 W、450 W、550 W)、超声功率(200 W、250 W、300 W、350 W、400 W)、液料比(15∶1、20∶1、25∶1、30∶1、35∶1)对鼠尾藻多糖提取率的影响。
1.4.2 响应面实验
在单因素实验的基础上,以鼠尾藻多糖提取率为响应值,采用Design-Expert软件,通过Box-Behnken设计4因素3水平响应面实验,进一步优化鼠尾藻多糖的超声-微波联用提取工艺。
1.5 抗氧化活性评价
1.5.1 DPPH自由基清除率的测定
参照文献[18]配制0.2 mmol·L—1的DPPH自由基溶液。取2 mL不同浓度的鼠尾藻多糖提取液,加入2 mL DPPH自由基溶液,混匀,置于暗室充分反应30 min,测定517 nm处吸光度,重复测定3次,取平均值;以VC为阳性对照。按式(2)计算DPPH自由基清除率,再通过SPSS软件计算半数清除率(IC50)。
(2)
式中:A0为2 mL DPPH自由基溶液+2 mL无水乙醇的吸光度;A1为2 mL鼠尾藻多糖提取液+2 mL无水乙醇的吸光度;A2为2 mL DPPH自由基溶液+2 mL鼠尾藻多糖提取液的吸光度。
1.5.2 ABTS自由基清除率的测定
参照文献[19]配制7 mmol·L—1的ABTS自由基溶液及140 mmol·L—1的过硫酸钾溶液。将5 mL 7 mmol·L—1ABTS自由基溶液与88 μL 140 mmol·L—1过硫酸钾溶液混匀,避光放置14 h,使用前加水稀释至734 nm处吸光度为0.7左右,即得ABTS自由基工作液。
参照文献[20],取3 mL ABTS自由基工作液与1 mL无水乙醇混匀,振荡10 s后静置30 min,作为对照组;将1 mL不同浓度的鼠尾藻多糖提取液与3 mL ABTS自由基工作液混匀,振荡10 s后静置6 min,测定734 nm处吸光度,重复测定3次,取平均值;以VC为阳性对照。按式(3)计算ABTS自由基清除率,再通过SPSS软件计算IC50。
(3)
式中:A0为3 mL ABTS自由基工作液+1 mL无水乙醇的吸光度;A1为3 mL ABTS自由基工作液+1 mL鼠尾藻多糖提取液的吸光度。
2 结果与讨论
2.1 单因素实验结果
2.1.1 提取时间对鼠尾藻多糖提取率的影响(图1)
由图1可知,随着提取时间的延长,鼠尾藻多糖提取率逐渐升高,当提取时间为30 min时,多糖提取率达到最高;继续延长提取时间,由于超声空化和机械力作用,多糖提取率反而降低。因此,选择30 min为响应面实验提取时间的中心点。
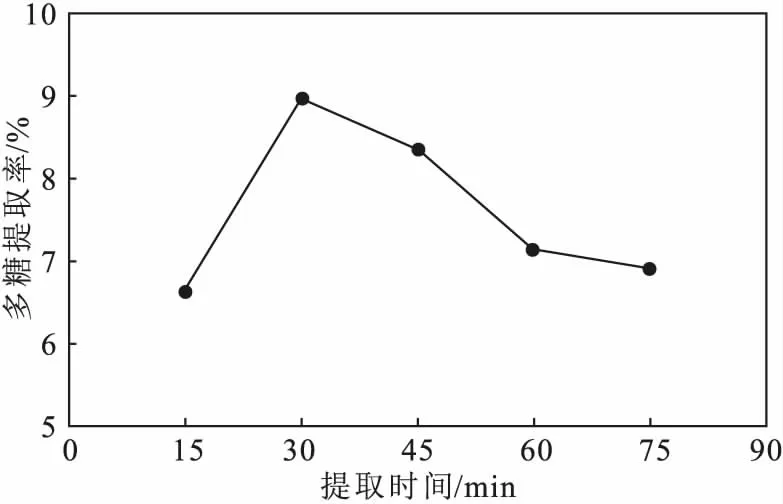
图1 提取时间对鼠尾藻多糖提取率的影响Fig.1 Effect of extraction time on extraction rate of polysaccharides from Sargassum thunbergii
2.1.2 微波功率对鼠尾藻多糖提取率的影响(图2)
由图2可知,随着微波功率的增大,鼠尾藻多糖提取率逐渐升高,当微波功率为350 W时,多糖提取率达到最高;继续增大微波功率,多糖提取率逐渐下降。这是由于,微波作用下鼠尾藻细胞破裂,多糖溶出,多糖提取率升高;当微波功率超过350 W后,由于高温和高压的作用,鼠尾藻内部出现凝固,抑制多糖溶出,多糖提取率反而降低。因此,选择350 W为响应面实验微波功率的中心点。
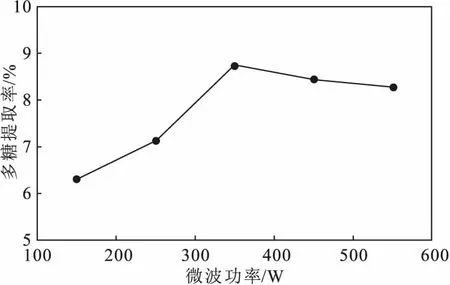
图2 微波功率对鼠尾藻多糖提取率的影响Fig.2 Effect of microwave power on extraction rate of polysaccharides from Sargassum thunbergii
2.1.3 超声功率对鼠尾藻多糖提取率的影响(图3)
由图3可知,随着超声功率的增大,鼠尾藻多糖提取率逐渐升高,当超声功率为300 W时,多糖提取率达到最高;继续增大超声功率,多糖提取率逐渐下降。这是由于,随着超声功率的增大,超声波机械作用力增强,细胞破壁加速,多糖溶出增多,多糖提取率相应升高;但超声功率超过300 W后,多糖发生降解,多糖提取率反而下降。因此,选择300 W为响应面实验超声功率的中心点。
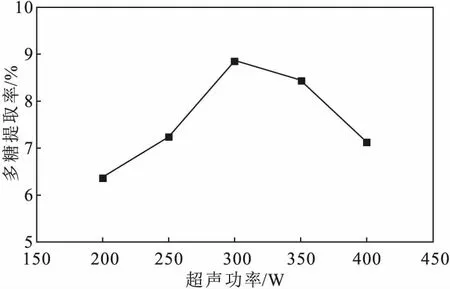
图3 超声功率对鼠尾藻多糖提取率的影响Fig.3 Effect of ultrasonic power on extraction rate of polysaccharides from Sargassum thunbergii
2.1.4 液料比对鼠尾藻多糖提取率的影响(图4)
由图4可知,随着液料比的增大,即提取溶剂用量的增加,鼠尾藻多糖提取率逐渐升高,当液料比为25∶1时,多糖提取率达到最高;继续增加提取溶剂用量,多糖提取率逐渐降低。可能是由于,提取溶剂用量过多时,超声波受到水的阻力及物质平衡原理抑制多糖溶出。因此,选择25∶1为响应面实验液料比的中心点。
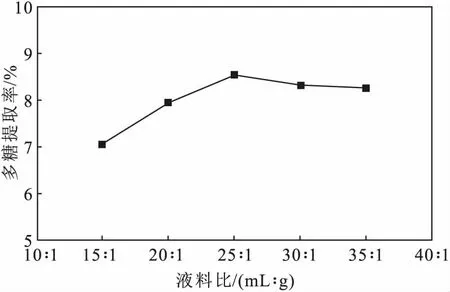
图4 液料比对鼠尾藻多糖提取率的影响Fig.4 Effect of liquid-solid ratio on extraction rate of polysaccharides from Sargassum thunbergii
2.2 响应面实验结果
2.2.1 响应面实验设计及结果(表1)

表1 响应面实验设计及结果
对表1数据进行拟合,得到回归模型方程为:Y=9.18+0.088A+0.053B+0.036C+0.080D-0.075AB+0.018AD+0.010BC-0.055BD-0.043CD-0.48A2-0.15B2-0.34C2-0.11D2。
回归模型的方差分析见表2。
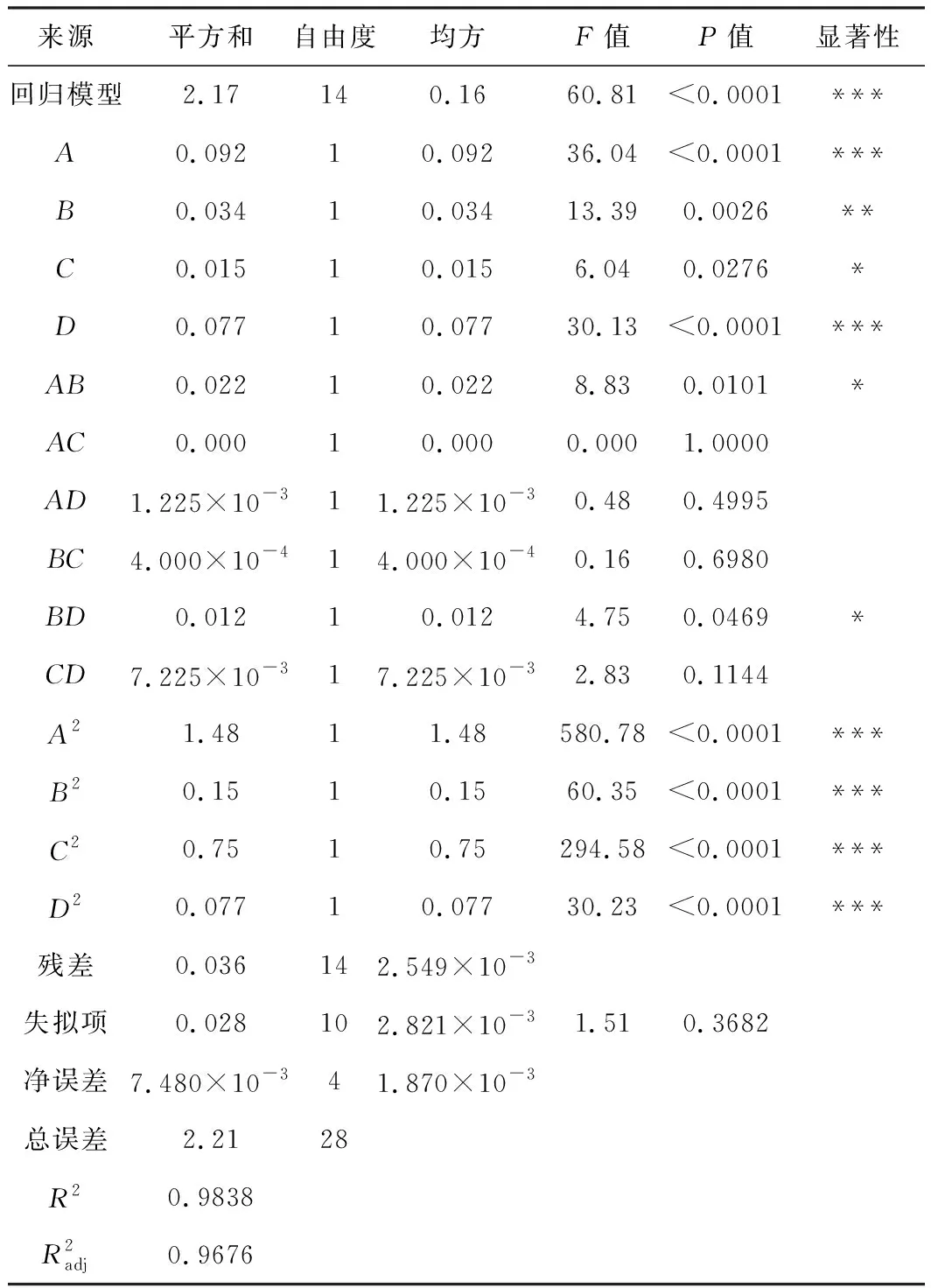
表2 方差分析
2.2.2 响应面分析
各因素交互作用对鼠尾藻多糖提取率影响的响应面图及等高线图如图5所示。
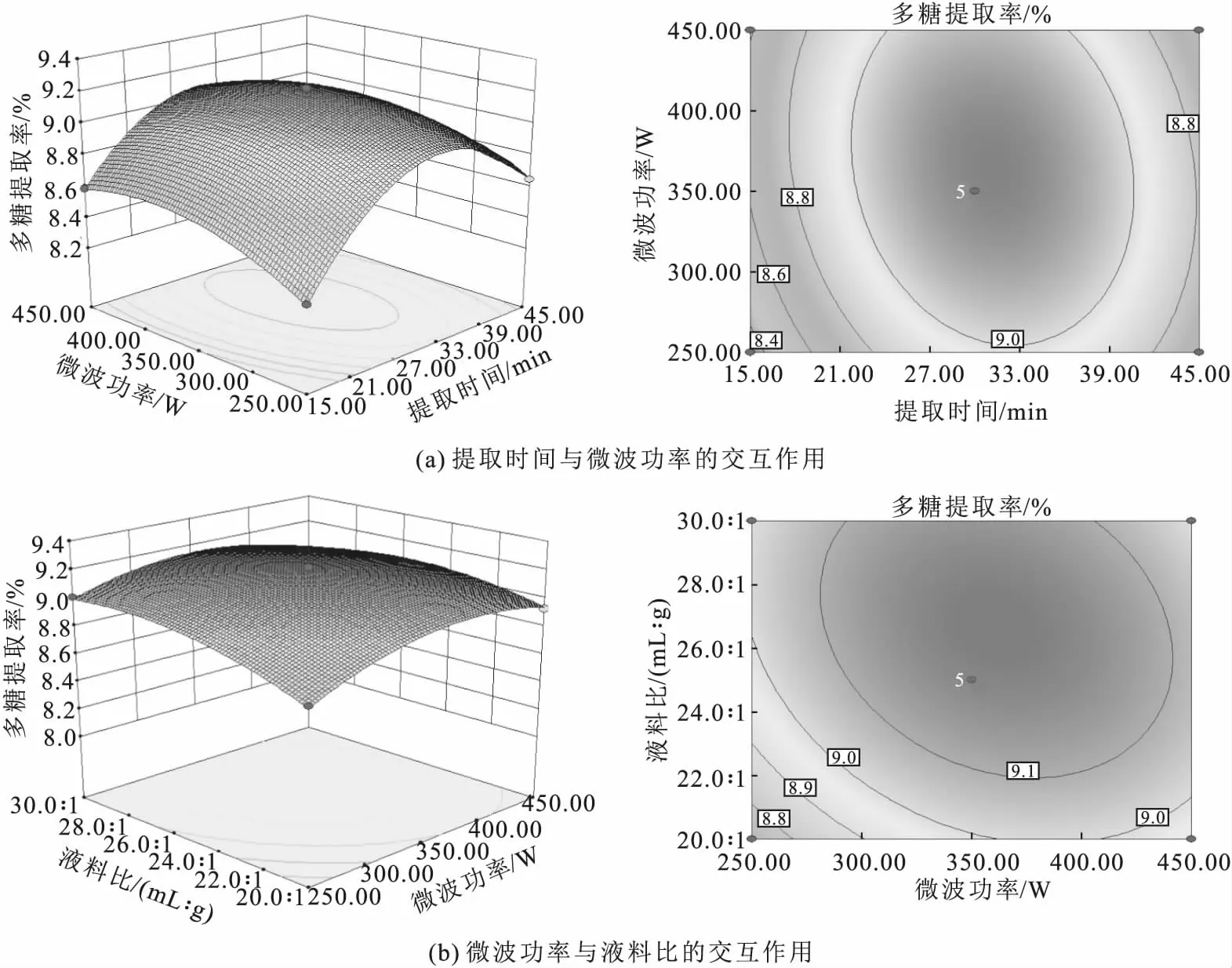
图5 各因素交互作用对鼠尾藻多糖提取率影响的响应面图及等高线图Fig.5 Response surface plots and contour plots for effect of interaction between various factors on extraction rate of polysaccharides from Sargassum thunbergii
由图5可知,提取时间与微波功率、微波功率与液料比的响应曲面陡峭,且等高线图呈椭圆,显示二者之间交互作用强,对鼠尾藻多糖提取率的影响显著,且提取时间的影响大于微波功率、液料比。
2.2.3 最佳工艺的确定及工艺验证
根据回归模型得到超声-微波联用提取鼠尾藻多糖的最佳工艺条件为:提取时间31.37 min、微波功率359.24 W、超声功率301.65 W、液料比26.73∶1。考虑实际操作的可行性,将最佳工艺调整为:提取时间31 min、微波功率359 W、超声功率302 W、液料比27∶1,在此条件下进行3次验证实验,得到鼠尾藻多糖平均提取率为9.19%,与预测值(9.20%)的相对误差为0.11%,说明优化的提取工艺切实可行。
2.3 不同提取方法的比较
分别采用微波、超声、超声-微波联用方法提取鼠尾藻多糖,结果见表3。
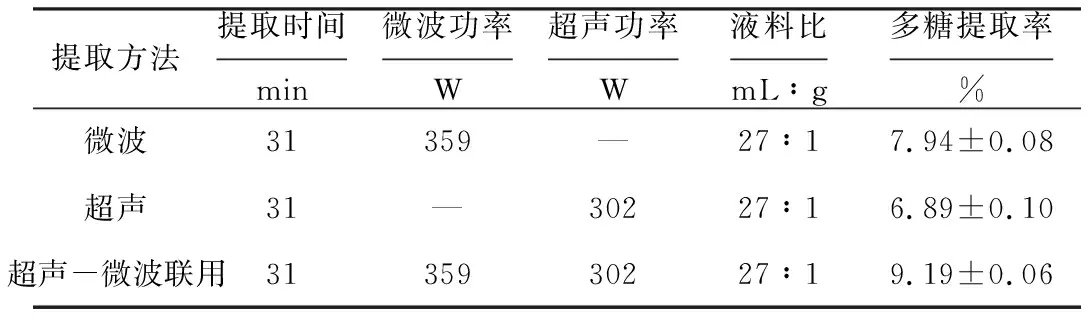
表3 不同提取方法的比较(n=3)
由表3可知,采用超声-微波联用方法提取鼠尾藻多糖,多糖提取率达到9.19%,明显高于单一微波提取和超声提取,分别较微波提取和超声提取提高了13.60%和25.03%。
2.4 抗氧化活性评价
2.4.1 DPPH自由基清除能力(图6)
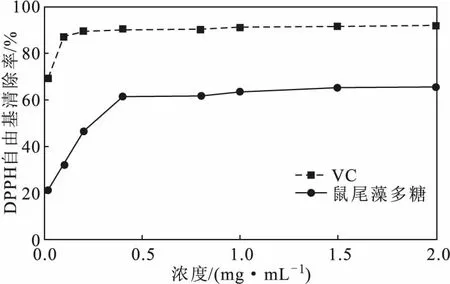
图6 鼠尾藻多糖对DPPH自由基的清除能力Fig.6 Scavenging ability of DPPH free radicals of polysaccharides from Sargassum thunbergii
由图6可知,鼠尾藻多糖对DPPH自由基有一定的清除能力,且清除率随鼠尾藻多糖浓度的增加逐渐升高,在浓度为0.4 mg·mL-1时,清除率达到60%以上;继续增加浓度,DPPH自由基清除率变化不大。VC对DPPH自由基的清除能力略高于鼠尾藻多糖,当浓度为0.4 mg·mL-1时,清除率达到90%以上。鼠尾藻多糖、VC对DPPH自由基的IC50值分别为0.311 mg·mL—1、0.001 mg·mL—1。
2.4.2 ABTS自由基清除能力(图7)

图7 鼠尾藻多糖对ABTS自由基的清除能力Fig.7 Scavenging ability of ABTS free radicals of polysaccharides from Sargassum thunbergii
由图7可知,鼠尾藻多糖对ABTS自由基的清除率随鼠尾藻多糖浓度的增加逐渐升高,当浓度为1.0 mg·mL-1时,清除率达到80%以上;继续增加浓度,ABTS自由基清除率升幅趋缓。VC对ABTS自由基的清除能力略高于鼠尾藻多糖,在浓度为0.2 mg·mL-1时,清除率达到90%以上。鼠尾藻多糖、VC对ABTS自由基的IC50值分别为0.288 mg·mL—1、0.035 mg·mL—1。由此可见,鼠尾藻多糖在一定浓度范围内对ABTS自由基有较强的清除能力,且优于对DPPH自由基的清除能力。
3 结论
以鼠尾藻多糖提取率为评价指标,在单因素实验的基础上,采用响应面法优化鼠尾藻多糖的超声-微波联用提取工艺,并通过测定鼠尾藻多糖对 DPPH自由基、ABTS自由基的清除能力,评价其抗氧化活性。确定鼠尾藻多糖的最佳提取工艺为:提取时间31 min、微波功率359 W、超声功率302 W、液料比27∶1(mL∶g),在此条件下,鼠尾藻多糖提取率可达9.19%。鼠尾藻多糖具有一定的抗氧化活性,对ABTS自由基的清除能力(IC50=0.288 mg·mL—1)优于对DPPH自由基的(IC50=0.311 mg·mL—1)。

