hsa-miR-103a-3p影响食管鳞状细胞癌细胞化疗耐药性的机制研究*
王 芳,宋 彬,肖帅帅,成晓龙△
(1山西医科大学转化医学研究中心,2山西白求恩医院肿瘤中心,3山西省肿瘤医院普外科二病区,山西太原 030000)
食管癌是我国第三大肿瘤,也是肿瘤致死的第四位原因[1],其组织学类型以鳞状细胞癌为主。由于早期症状隐匿,多数患者就诊时已是临床晚期,5年生存率在15%以下[2]。目前,食管癌的治疗方法主要为手术、化疗、放疗或多学科综合治疗[3]。尽管外科技术和综合治疗为食管癌患者带来生存获益,但其预后仍不尽人意。经典的联合化疗方案仍有约一半的患者会产生原发性耐药,即使对原方案敏感的患者,经过2~3 个周期化疗后又会出现继发性耐药[4-5]。化疗药物耐药是直接导致临床治疗失败和不良预后的重要原因。因此,阐明食管癌耐药机制、筛选疗效预测标志物,对改善多药耐药现象、实现个体化治疗及提高生存率具有重大意义。
微小RNA(microRNA,miRNA,miR)是一种长度为21~25 nt 的非编码RNA,通过与靶基因的3'端非翻译区(3'-untranslated region,3'UTR)结合来抑制其翻译或降解,从而参与细胞多种生理过程[6]。近年来,miRNA 与肿瘤的关系受到广泛关注,miRNA在癌细胞中可以作为肿瘤抑制因子或致癌因子发挥作用[7]。miR-103a-3p 位于染色体11q24.1 上,近期研究表明miR-103a-3p 的异常表达与多种肿瘤的进展有关。但是,miR-103a-3p 与肿瘤耐药的关系鲜少报道。本项工作探讨了食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中miR-103a-3p 对奥沙利铂(oxaliplatin,OXA)耐药的影响及可能的作用机制。
材料和方法
1 实验材料及主要试剂
ESCC 细胞系Eca109 和KYSE150 由山西医科大学转化医学中心样本库保存。细胞培养液和胰蛋白酶均购自HyClone;血清购自Gibco;MTT 购自Invitrogen;OXA 粉针购自江苏恒瑞医药股份有限公司;Trizol、RNA 反转录试剂盒和RT-PCR 试剂盒均购自TaKaRa;miRNA 提取和反转录试剂盒购自Qiagen;抗RASSF8(Ras association domain family member 8)抗体(Abcam);抗XPA(xeroderma pigmentosum complementation group A)和XPC(xeroderma pigmentosum complementation group C)抗体均购自Proteintech;TransIntro®EL 转染试剂和双萤光素酶报告实验试剂盒均购自北京全式金生物技术(TransGen Biotech)股份有限公司。
2 主要方法
2.1 细胞培养 Eca109 和KYSE150 细胞系均为贴壁细胞,其培养条件为:含有10%血清的完全培养液,37 ℃、5% CO2孵育。每2~3 d 换一次液,细胞密度达到70%~80%进行传代培养,保持细胞良好的状态。
2.2 耐药和敏感细胞系筛选 研究者所在实验室前期应用氟尿嘧啶、OXA、伊立替康、顺铂、多西他赛和紫杉醇等6 种化疗药物对KYSE150、Eca109、EC9706 和TE-1 等多种食管癌细胞系及正常食管黏膜上皮细胞系SHEE进行化疗敏感性的研究,筛选出针对不同化疗药物表现出不同敏感程度的耐药细胞系和敏感细胞系。经鉴定,Eca109 细胞对OXA 耐药,称为OXA 化疗耐药ESCC 细胞系;KYSE150 细胞对OXA敏感,称为OXA化疗敏感ESCC细胞系。
2.3 OXA 药物配制 OXA 分子量为397.29 g/mol。浓度范围:0~1 200 µmol/L。母液配制:用生理盐水溶解配成50 mg/10 mL(12.58 mmol/L),分装成每管300 µL,-20 ℃密封储存。稀释液的配制:7 236.86µL 完全培养液中加入763.14µL 的OXA 母液,配成1 200 µmol/L 稀释液8 mL,再分别配成15、30、60、120和240µmol/L的稀释液。
2.4 MTT 和药敏实验 细胞以每孔5 000 个的密度接种于96 孔板中,每组设置5 个复孔。次日细胞贴壁 后,分别加 入15、30、60、120 和240 µmol/L 的OXA。药物处理48 h 后,每孔加入20µL MTT 溶液,继续培养4 h后弃上清,每孔加入200µL DMSO 置于摇床上10 min,促进结晶充分溶解,观察颗粒结晶逐渐溶解后,用酶标仪检测490 nm 处的吸光度(absorbance,A),根据A值计算抑制率。抑制率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
2.5 miRNA 转染实验 本研究所用的hsa-miR-103a-3p mimics、hsa-miR-103a-3p inhibitor 及相应的阴性对照(negative control,NC)均购自广州锐博生物技术有限公司,序列见表1。细胞以每孔(1~2)×105个的密度接种于6 孔板中,每组设置2 个复孔。次日细胞贴壁后,分别取hsa-miR-103a-3p mimics(20 µmol/L)0.6 µL、mimics-NC 0.6 µL、inhibitor-NC 6 µL 和hsa-miR-103a-3p inhibitor(20 µmol/L)6µL,加入基础培养液400µL 和转染试剂12µL 轻轻吹打混匀,静置5~10 min 后加入对应的6 孔板中,培养36 h后,待验证转染效率后进行后续实验。

表1 miRNA序列Table 1.The miRNA sequences
2.6RASSF8敲减载体的构建 在Sigma 公司的网站上查找RASSF8基因的shRNA 序列,选择序列如下:编码序列1(coding sequence 1,CDS1)为5'-CCGGGCCTCAGATTGACAAATCAATCTCGAGATTGATTTGTCAATCTGAGGCTTTTTG-3';非翻译区(untranslated region,UTR)为5'-CCGGCCTGTTAGGTTACATCTGCTACTCGAGTAGCAGATGTAACCTAACAGGTTTTTTG-3'。将序列合成后退火,进行双酶切连接到pLKO.1 的载体上,筛选阳性克隆。RASSF8 过表达载体构建:将片段扩增出来后,通过双酶切连接到pENTER 载体上,筛选阳性克隆。RASSF8 双萤光素酶报告基因载体构建:预测与靶基因的结合区,设计引物,上游序列为5'-GGCGGCTCGAGCACATTTGACTGACTTTGGTT-3',下游序列为5'-AATGCGGCCGCACATGGCAATTTTCTGTTT-3'。将片段扩增出来后,通过双酶切连接到pMIR-RB-REPORT 载体上,筛选阳性克隆。
2.7 质粒转染 细胞接种到6 cm皿中培养,融合度达到60%~70%进行转染。将4 µg 质粒与500 µL Opti-MEM 培养液混合标记为A 液,10µL EL 转染试剂与500µL Opti-MEM 培养液混合标记为B 液,将A液和B 液混匀,静置15 min 后加入对应的细胞中,培养48~72 h,待验证转染效率后进行后续实验。
2.8 RT-qPCR 实验 利用Trizol 法提取总RNA,由反转录试剂盒将RNA 反转成cDNA,应用荧光定量PCR试剂盒进行RT-PCR检测。引物序列见表2。

表2 RT-qPCR引物序列Table 2.The sequences of the primers for RT-qPCR
2.9 Western blot 实验 提取总蛋白后,用BCA 法对蛋白进行定量,取30~50µg 蛋白进行SDS-PAGE,300 mA 恒流转膜,5%脱脂奶粉室温封闭1 h,Ⅰ抗4 ℃过夜孵育,Ⅱ抗室温1 h,化学发光显影,再进行统计分析。
2.10 双萤光素酶报告基因实验 细胞以每孔(5~8)×104个的密度接种于24 孔板中,每组设置3 个复孔。待细胞贴壁后,共同转染hsa-miR-103-3p mimics/inhibitor 和pMIR-RB-REPORT 质粒。48 h 后使用双萤光素酶报告基因试剂盒检测发光强度,然后对萤光素酶相对活性进行统计分析。
2.11 PCR-array 实验 PCR-array 是使用荧光定量PCR 的方法在一张96 孔或384 孔板上同时对某个信号通路或某疾病的84 个或371 个重要基因的表达量进行检测的技术。本研究选用的RT2Profiler PCR Arrays 购自QIAGEN,型号为PAHS-004ZC,涉及与人类癌症耐药相关的信号通路。首先收集RASSF8 过表达和对照组细胞,提取总RNA,逆转录为cDNA,以cDNA为模板检测PCR-array 96孔板中基因的差异表达,最后进行统计分析。
3 统计学处理
使用SPSS 19.0 软件进行统计分析。数据以均数±标准差(mean±SD)表示。两组间均数比较采用t检验;多组间均数比较采用单因素方差分析。以P<0.05为差异有统计学显著性。
结果
1 hsa-miR-103-3p 在OXA 敏感ESCC 细胞 系中高表达
华大公司基因测序结果显示,hsa-miR-103-3p在OXA 敏感ESCC 细胞系KYSE150 中的表达量为11 086,在OXA 耐药ESCC 细胞系Eca109 中的表达量为4 985,敏感细胞系的表达量是耐药细胞系表达量的2.22 倍(图1A)。RT-qPCR 结果显示,hsa-miR-103-3p 在KYSE150 细胞系中的表达量为3.89,在Eca109 细胞系中的表达量为1,敏感细胞系的表达量是耐药细胞系表达量的3.89 倍(图1B)。公司测序结果与实验室验证结果一致,表明hsa-miR-103-3p在OXA敏感ESCC细胞系中高表达。

Figure 1.The expression of hsa-miR-103a-3p in oxaliplatin(OXA)-resistant esophageal squamous cell carcinoma(ESCC)cell line Eca109 and OXA-sensitive ESCC cell line KYSE150 detected by Huada gene sequencing(A)and RT-qPCR(B).Mean±SD. n=3.**P<0.01 vs Eca109 group.图1 hsa-miR-103a-3p在OXA耐药ESCC细胞系Eca109和OXA敏感ESCC细胞系KYSE150中的表达
2 hsa-miR-103a-3p的表达影响ESCC细胞对OXA的敏感性
在OXA 敏 感ESCC 细胞系KYSE150 和OXA 耐药ESCC 细胞系Eca109 中分别转染miRNA-inhibitor和miRNA-mimics,结果显示,hsa-miR-103a-3p 过表达效率比对照组高862倍(图2A);而与对照组相比,敲减效率为89.2%(图2B)。应用MTT实验检测hsamiR-103a-3p 对OXA 化疗敏感性的影响,结果显示,在OXA 化疗耐药ESCC 细胞系Eca109 中,与mimics-NC组相比,OXA对hsa-miR-103a-3p过表达组细胞活力的抑制率显著升高(P<0.01),即细胞对OXA 的敏感性升高(图2C);反之,在OXA 化疗敏感ESCC 细胞系KYSE150 中,与inhibitor-NC 组相比,OXA 对hsamiR-103a-3p敲减组细胞活力的抑制率显著降低(P<0.01),即细胞对OXA 的敏感性降低(图2D)。上述结果表明,hsa-miR-103a-3p 可增强ESCC 细胞对OXA的敏感性。
3 RASSF8可能是hsa-miR-103a-3p的候选靶基因
结合软件预测和文献筛选,推测RASSF8可能是hsa-miR-103a-3p 的候选靶基因。根据图3A 所示构建与hsa-miR-103a-3p 相互结合的RASSF8-UTR 野生型及突变型萤光素酶报告基因载体。双萤光素酶报告基因实验结果显示,与3'UTR-WT+miRNA NC 组相比,3'UTR-WT+miRNA 组萤光素酶相对活性显著降 低(P<0.05);与3'UTR-WT+miRNA 组相比,3'UTR-MUT+miRNA 组萤光素酶相对活性显著升高(P<0.01),见图3B。同时进行RT-qPCR 实验验证,与转染miRNA-NC 组相比,转染hsa-miR-103a-3pmimics 后RASSF8 的mRNA 表达显著下调(图3C),转 染hsa-miR-103a-3p-inhibitor 后RASSF8 的mRNA表达显著上调(图3D)。
4 hsa-miR-103a-3p 可能通过RASSF8 影响ESCC细胞对OXA的敏感性

Figure 2.Effect of hsa-miR-103a-3p on oxaliplatin(OXA)sensitivity of Eca109 and KYSE150 cell lines.A:the overexpression efficiency of hsa-miR-103a-3p mimics in Eca109 cell line;B:the knockdown efficiency of hsa-miR-103a-3p inhibitor in KYSE150 cell line;C:the OXA sensitivity of Eca109 cell line after hsa-miR-103a-3p overexpression;D:the OXA sensitivity of KYSE150 cell line after hsa-miR-103a-3p knockdown.Mean±SD. n=3.**P<0.01 vs mimics-NC group;△△P<0.01 vs inhibitor-NC group.图2 hsa-miR-103a-3p对ESCC细胞奥沙利铂化疗敏感性的影响
Western blot 实验结果表明,在Eca109 细胞系中,与hsa-miR-103a-3p mimics 组相比,共转染hsamiR-103a-3p mimics 和pENTER-RASSF8 载体后,RASSF8 蛋白的表达显著升高(图4A);在KYSE150细胞系中,与hsa-miR-103a-3p inhibitor 组相比,共转染hsa-miR-103a-3p inhibitor和pLKO.1-RASSF8载体后,RASSF8 蛋白的表达显著降低(图4B)。MTT 实验结果显示,与hsa-miR-103a-3p mimics 组相比,过表达RASSF8可减弱由hsa-miR-103a-3p 高表达所增强的Eca109 细胞化疗敏感性,使耐药性增强(P<0.05),见图4C;反之,与hsa-miR-103a-3p inhibitor 组相比,敲减RASSF8可减弱由hsa-miR-103a-3p低表达所促进的KYSE150 细胞化疗耐药性,使敏感性增强(P<0.05),见图4D。
5 RASSF8 可能通过核苷酸切除修复机制参与ESCC细胞耐药
通过PCR-array 实验,共筛选出8 个差异表达基因,其中FOS、RARB、XPA和XPC基因表达上调,而ABCB1、ABCC3、ESR2和SULT1E1基因表达下调。经RT-qPCR 实验验证,提示只有XPA和XPC的表达与PCR-array 实验的结果一致(图5A)。Western blot 实验结果显示,与对照组相比,hsa-miR-103a-3p低表达能够引起XPA 和XPC 蛋白表达上调,而过表达hsamiR-103a-3p 能够引起XPA 和XPC 蛋白表达下调(图5B)。
6 hsa-miR-103-3p 在ESCC 患者中高表达,且患者预后差
配对t检验结果表明,hsa-miR-103-3p在ESCC肿瘤组织中高表达(图6A)。Kaplan-Meier 生存分析结果显示,hsa-miR-103-3p 高表达的ESCC 患者生存时间显著缩短(图6B)。

Figure 3. RASSF8 may be a target gene of hsa-miR-103a-3p in esophageal squamous cell carcinoma(ESCC)cell lines.A:the putative binding sites of hsa-miR-103a-3p on 3'-untranslated region(3'UTR)of RASSF8;B:dual-luciferase reporter assay showed that hsa-miR-103a-3p mimics decreased the luciferase activity of RASSF8 3'UTR-WT reporter rather than 3'UTRMUT reporter;C:the mRNA expression of RASSF8 after transfection of hsa-miR-103a-3p mimics;D;the mRNA expression of RASSF8 after transfection of hsa-miR-103a-3p inhibitor.Mean±SD. n=3.**P<0.01 vs 3'UTR-WT+miRNA group;△△P<0.01 vs inhibitor NC group.图3 RASSF8可能是hsa-miR-103a-3p的候选靶基因
讨 论
食管癌是一种全身性疾病,早期的食管癌患者症状十分隐匿,就诊时已延误最恰当的治疗时机,预后差,5 年生存率仅10%左右[2],手术结合化疗仍是其治疗的常用手段。然而,化疗耐药成为治疗过程中的主要挑战。已有研究证实,miRNA 广泛参与多种生理和病理过程,包括肿瘤发生、发展、侵袭、转移、耐药。miRNA 作为重要的作用靶标,有可能逆转或改善多基因、多信号通路、多因素共同导致的肿瘤耐药。
hsa-miR-103a-3p 作为肿瘤促进和抑制因子,调控多种肿瘤的进展。在胶质瘤细胞中,hsa-miR-103a-3p可作为肿瘤抑制因子抑制细胞增殖[8]。胃癌中,hsa-miR-103a-3p通过靶向调控ATF7促进细胞增殖[9]。结直肠癌中,hsa-miR-103a-3p 呈现高表达,且通过靶向调控DICER 和PTEN 促进结直肠癌的发生发展[10]。近期还有研究报道,hsa-miR-103a-3p 通过Hippo信号通路下调LATS1的表达,从而促进甲状腺肿瘤的侵袭、迁移和凋亡[11],但是在前列腺癌中,hsamiR-103a-3p 通过靶向调控D52 明显抑制细胞的增殖和迁移[12]。然而,hsa-miR-103a-3p 与肿瘤耐药的关系鲜有报道。本研究通过改变hsa-miR-103a-3p的表达,影响ESCC 细胞对OXA 的耐药,阐述了hsamiR-103a-3p 与ESCC 化疗耐药的关系,具有一定的应用价值和现实意义。
本研究证实RASSF8作为hsa-miR-103a-3p 下游的直接靶基因,参与ESCC 细胞对OXA 的耐药机制。RASSF8是Ras 结构域家族四个新成员之一,与RASSF1-6 不同,RASSF7-10 包含N 端RA 结构域,缺少SARAH 结构域[13-15]。RASSF蛋白参与多种生物学过程,包括细胞死亡、细胞周期控制、微管稳定、启动子甲基化、囊泡运输和缺氧反应等[15]。RASSF8 在主要器官和组织中普遍表达,包括大脑、心脏、肾脏、肝脏、肺和其他正常人体组织。内源性RASSF8在细胞核和细胞膜中均有表达,通过维持黏连连接的稳定性来促进细胞与细胞的黏附[16-17]。肺癌中,RASSF8低表达促进细胞迁移和增殖[18]。黑色素瘤中,RASSF8 通过激活P53-P21 通路诱导细胞凋亡,体内研究也表明抑制RASSF8 可增加人类黑色素瘤异种移植的致瘤性[19]。卵巢癌中RASSF8作为miR-320a的直接靶基因促进肿瘤的发生[20]。结直肠癌中,miR-505通过靶向调控RASSF8参与结直肠癌对甲氨蝶呤的化疗耐药[21]。本研究提示,在hsa-miR-103a-3p 低表达的ESCC 细胞系中敲减RASSF8的表达,可以逆转由hsa-miR-103a-3p低表达引起的化疗耐药表型;同时,在hsa-miR-103a-3p高表达的细胞系中过表达RASSF8,可以逆转由hsa-miR-103a-3p 高表达引起的化疗敏感表型。因此,我们推测hsa-miR-103a-3p通过靶向调控RASSF8参与ESCC 细胞对OXA 的化疗耐药。

Figure 4.hsa-miR-103a-3p influenced the oxaliplatin(OXA)sensitivity of esophageal squamous cell carcinoma(ESCC)cell lines by targeting RASSF8.A:overexpression of RASSF8 in Eca109 cell line;B:knockdown of RASSF8 in KYSE150 cell line;C:the OXA sensitivity of Eca109 cell line with RASSF8 overexpression;D:the OXA sensitivity of KYSE150 cell line with RASSF8 knockdown.Mean±SD. n=3.**P<0.01 vs Eca109 group;△△P<0.01 vs mimics group;##P<0.01 vs KYSE150 group;▲▲P<0.01 vs inhibitor group.图4 hsa-miR-103a-3p可能通过靶向调控RASSF8影响ESCC细胞对奥沙利铂化疗敏感性
OXA 是第三代水溶性铂类化合物,其抗癌机制主要是作用于DNA,引起DNA 复制障碍,从而抑制癌细胞的分裂。核苷酸切除修复机制是造成OXA耐药的机制之一。该途径是一个由多功能蛋白联合组成的网络,其中ERCC1是公认的关键因子,ERCC1基因的表达可以逆转铂类耐药;XPA 是另一个关键因子,抑制XPA基因的表达可以降低核苷酸切除修复的能力,提高细胞对铂类药物的敏感性。XPC 主要作用于基因组修复途径,与HR23B 和CETN2 结合形成XPC 复合物,发挥识别损伤位点的作用[22-24]。本研究表明,hsa-miR-103a-3p 的表达能够引起XPA和XPC 蛋白水平的变化,hsa-miR-103a-3p 低表达能使得XPA 和XPC 的表达上调,提高了核苷酸切除修复能力,从而增加了细胞对铂类药物的耐药性。
总之,本研究通过验证组学测序中hsa-miR-103a-3p 在OXA 敏感ESCC 细胞系中高表达,明确了hsa-miR-103a-3p在ESCC中的耐药作用,并初步预测hsa-miR-103a-3p的表达下调,通过上调RASSF8的表达,同时XPA和XPC的表达也上调,诱导核苷酸修复机制,促使ESCC 细胞对OXA 发生化疗耐药。临床相关信息分析提示hsa-miR-103a-3p 高表达的ESCC患者,生存时间较短,预后差。因此,hsa-miR-103a-3p有望成为预测ESCC化疗效果的潜在分子标志物,为ESCC的治疗及预后提供科学依据。
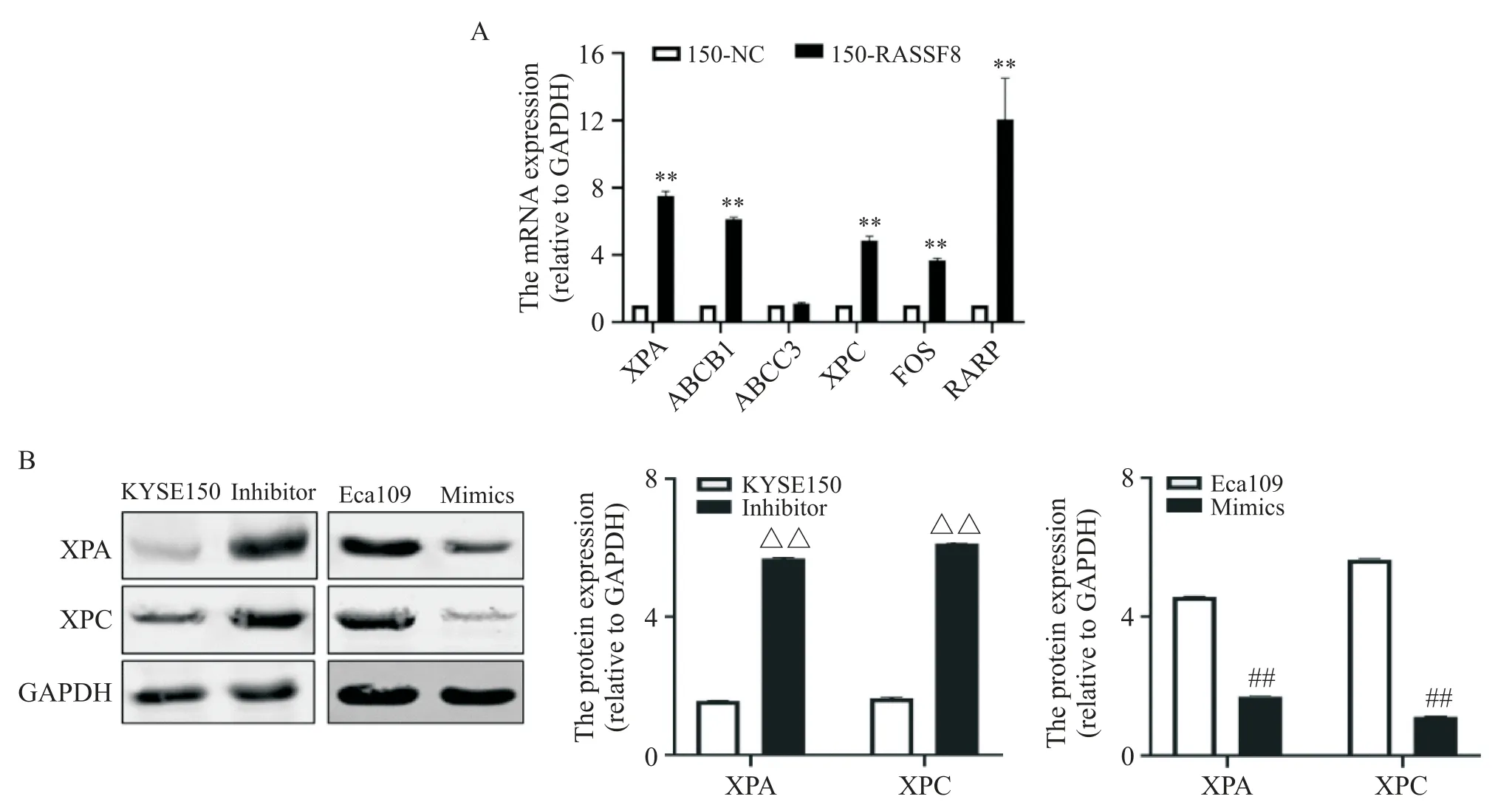
Figure 5.hsa-miR-103a-3p influenced the oxaliplatin(OXA)sensitivity of esophageal squamous cell carcinoma(ESCC)cell lines through regulating XPA and XPC.A:overexpression of RASSF8 promoted the mRNA expression of XPA and XPC;B:the protein expression of XPA and XPC in the cell lines with hsa-miR-103a-3p mimics/inhibitor transfection.Mean±SD. n=3.**P<0.01 vs 150-NC group;△△P<0.01 vs KYSE150 group;##P<0.01 vs Eca109 group.图5 hsa-miR-103a-3p可能通过调控XPA和XPA的表达影响ESCC细胞对奥沙利铂化疗敏感性

Figure 6.High expression of hsa-miR-103a-3p was correlated with the prognosis of ESCC patients.A:ESCC tumor tissues(T)had high hsa-miR-103a-3p expression compared with corresponding non-tumor tissues(N)using paired t-test(n=155,P<0.001);B:the patients with low hsa-miR-103a-3p expression had better survival than those with high hsa-miR-103a-3p expression(Kaplan-Meier survival analysis,log-rank test,P=0.043).图6 hsa-miR-103a-3p高表达的ESCC患者生存时间较短

