两种增温方式对杉木和木荷单萜烯通量及光合特性的影响
马方园,郭 豪,肖成玉,廖露露,周婉婷,方 熊,易志刚,*
1 福建农林大学资源与环境学院/土壤环境健康与调控福建省重点实验室,福州 350002 2 福建农林大学机电工程学院,福州 350002
全球增温从第一次世界气候大会(FWCC)首次被提出,到政府间气候变化委员会(The Intergovernmental Panel on Climate Change, IPCC)六次发布全球气候变化评估报告,气候变暖问题逐渐凸显并引起国内外众多学者乃至政府的高度关注。自1900年至今,地球表面温度以0.7—0.9℃/100a速度增加,但工业革命以来,该增速已提高到1.5—1.8℃/100a[1]。根据世界气象组织及最新的科学评估报告,2018年全球表面温度比1951—1980年的平均温度高出0.83℃,在2030—2052年间,全球增温幅度将达到1.5℃[1- 2]。全球变暖及伴随产生的冰川和冻土消融、降水格局改变和海平面气候上升等气候与环境变化被认为是21世纪森林生态系统的严重威胁[3]。全球增温等气候变化将对生态系统物质循环产生重要影响,进而影响生态系统的结构和功能。
生物源挥发性有机化合物(Biogenic volatile organic compounds,BVOCs)作为生态系统中生物体合成的重要次生代谢产物,其合成与释放对生态系统碳循环起重要作用。BVOCs全球年总排放量约1000 Tg C[4],植物的贡献约为70%[5]。BVOCs主要包括烯类(异戊二烯和单萜烯)、烷烃、烯烃、羰基、醇、酯、醚和酸等3万余种化合物[6],其中单萜烯(Monoterpene,MTs,C10H16)约占15%[5, 7]。MTs化学活性高、挥发性极强,其合成与排放会对区域大气化学和气溶胶过程产生显著影响。研究发现植物释放MTs极大程度上促进了夏季美国东部地区二次有机气溶胶的形成[8];高浓度单萜类化合物气团能促进新粒子向云凝结核(CCN)方向生长[9]。MTs在氧化过程中,会产生过氧化物、乙醛等寿命短、活性强的物质,这些物质可以将NO转化为NO2,再经过一系列复杂的化学反应后最终生成臭氧(O3),导致对流层O3体积分数增加。绝大多数MTs在大气中最终会转化为CO2,进入陆地生态系统碳循环;另外,MTs也极易与氢氧基(.OH)等氧化物质反应,延长CH4等温室气体在大气中的寿命,进一步加剧温室效应。由此可见,MTs的合成与释放在对流层化学反应、近地表臭氧形成、全球碳收支、地球大气层和气候变化有重要影响[10—11]。
MTs的合成与释放受到内因(树龄、树种和生长阶段)和外因(温度、光照、水分、CO2浓度、O3浓度和干旱等)多种因素共同调节,其中温度对其影响尤为明显。温度通过增强叶片内部合成酶的活性来延长叶片生长期限,进而直接影响叶级植物BVOCs的合成与释放[12]。研究发现采用红外辐射器使空气温度增加1℃后,非含氧单萜类、含氧单萜类、倍半萜以及更多活性化合物排放量增加了2—4倍[13]。亚北极地区经过3年1—2℃温和增温,其荒原上异戊二烯和单萜烯排放量分别增加了5—6倍和3—4倍[14]。温度升高会导致植物BVOCs的排放速率成倍增加[15- 17]或降低[18],主要因为在一定温度范围内,温度增加会提高合成酶的活性[19—20];当温度超过合成酶的生长温度时,反而会降低其活性[19, 21- 23]。在全球增温这一事实下,已有的植物BVOCs通量对温度升高响应规律的研究结果存在争议,因此,温度升高对植物BVOCs通量的影响仍需进一步研究。
IGBP(International Geosphere and Biosphere Programme)生态系统增温研究网络(NEWS: Network of Ecosystem Warming Studies)将增温方式分为4大类:1)温室(Greenhouse)和开顶式气室(Open-top chamber, OTC),2)土壤加热管道和电缆(Soil heating pipes and cables),3)红外线反射器(Infrared reflector),4)红外辐射器(Infrared radiator)。目前模拟增温主要采用悬挂在植物上方的红外灯管或埋入土壤中的加热电缆。加热电缆增温通过电路控制对土壤直接增温,对环境的干扰相对较大。红外辐射器增温是从植物冠层上面加热,通过植物或地表反射后导致空气增温,对环境的干扰相对较小,能够较真实模拟全球变暖[24]。目前已开展的增温实验,大多数是根据生态系统类型选择适当的增温装置,而增温方式可能会影响研究对象对增温的响应,从而增加对实验结果进行整合的困难。单一增温模式实验中,实验地点和植被类型可能会更大程度上影响试验对象对温度的响应,从而削弱增温本身的影响,进而增加模型预测的不确定性[25]。
杉木和木荷作为南亚热带代表性树种在福建省分布极广,是中国南方重要的用材树种,也是主要的人工林树种之一,在生态和经济方面具有极高的价值。本研究以杉木和木荷作为研究对象,利用OTC,设计电热线增温和红外辐射器增温两种方式,对不同增温方式下杉木和木荷的光合参数、部分生理指标进行比较,并分析两种增温方式处理下植物单萜烯通量的差异,为整合不同生态系统的增温实验、完善增温模型参数提供基础数据。
1 材料与方法
1.1 试验设计
本试验以针叶树种杉木(CunninghamiaLanceolata(Lamb.) Hook)和阔叶树种木荷(SchimasuperbaGardn. et Champ.)为研究对象,于2020年5月将1.5年生杉木和木荷移至花盆中缓苗后培养6个月,随后将植物放到OTC中处理,培养期间定期浇水,以保证植物正常生长。
试验装置如图1,设置对照(未增温)、电热线增温(持续增温3.5℃)、红外辐射器增温(持续增温3.5℃)3个处理,每个处理设置3个重复,其中电热线增温是在OTC内布置约0.7 m高的电热线(1000 W)实现增温,红外辐射器增温是在OTC上方悬挂2根红外辐射灯管(2×500 W)实现增温(灯管距地面2.0 m),并通过高精度数显智能温差控制器控制OTC内3.5℃温差(图2)。处理期间保持植物土壤含水率在20%—25%。增温处理30天进行样品采集。
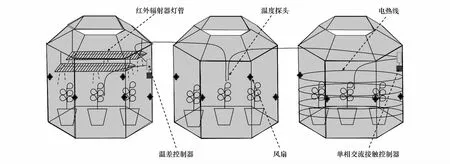
图1 试验装置示意图Fig.1 Schematic diagram of the experimental device
图2 增温效果图Fig.2 Effect of warmingHW:电热线增温 Heating wire heating;IR:红外辐射器增温 Infrared radiator heating
1.2 样品采集与分析
气体采集:选择晴朗、光照充足的天气,在9:00—16:00时间段,将长势一致的枝条包裹在自制的Teflon采样袋(40 cm×60 cm)中,包裹过程中注意不要损伤植物,使用活体植物动态顶空套袋法[26—27]采集植物释放气体样品,具体采样过程参照文献[26]。样品采集期间记录光合有效辐射(PAR)(Model MQ- 500, Apogee instruments, USA),并记录套袋中温湿度(RC- 4HC,中国精创 Elitech)。气体采集完毕后,使用手持式叶面积测量仪(CI- 203, CID Bio-Science, USA)测量包裹枝条的叶面积。
光合参数测定:气体采集结束,测量杉木和木荷的净光合速率(Pn)、气孔导度(gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr)等光合参数(LiCor- 6400, LI-COR Biosciences, USA)。具体测量方法参照文献[26]。
叶片采集:光合参数测定结束,摘取长势良好的叶片(新老叶混匀)放干冰中暂存,随后放- 80 ℃冰箱中保存,用于植物生理生化指标分析。
植物单萜烯通量分析:植物单萜烯通量使用预浓缩(Entech 7200, USA)-气质联用仪(7890B- 5977A, Agilent Technologies, USA)分析。具体分析方法参照文献[27]。
植物生理生化指标:叶绿素、过氧化氢、过氧化氢酶等生理指标参考《植物生理学实验教程》(苍晶主编)[28]。
1.3 数据分析及处理
单萜烯通量(pmol m-2s-1)
式中,F(pmol m-2s-1)为单萜烯通量;ΔC(pmol/mol)为样品和空白Teflon套袋中MTs浓度差;f(L/s)为进气口流量;A(m2)为套袋中枝条叶面积;Vm为标准状况下的气体摩尔体积22.4 L/mol;T(℃)为大气温度。具体计算过程参考Aydin等[29]。
数据分析:使用SPSS 19单因素方差分析(one-way ANOVA)对单萜烯释放通量、光合参数、植物生理生化指标差异性进行显著性分析,LSD法比较组间差异,使用Origin 8.0绘图。
2 结果
2.1 单萜烯通量
杉木MTs通量为:电热线增温(16239.608±4079.319) pmol m-2s-1>未增温(8503.879±1868.579) pmol m-2s-1>红外辐射器增温(4027.631±858.536) pmol m-2s-1,电热线增温处理导致杉木MTs通量增加约2倍,且各处理间存在显著性差异(P<0.05)。木荷MTs通量远低于杉木,其MTs通量为电热线增温(130.512±35.802) pmol m-2s-1>未增温(67.985±20.821) pmol m-2s-1>红外辐射器增温(49.228±25.954) pmol m-2s-1,但处理间MTs通量均不存在显著性差异(图3)。
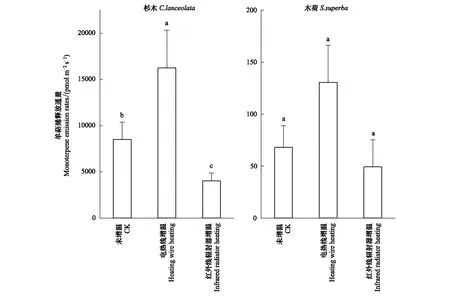
图3 不同增温方式对杉木和木荷单萜烯释放通量的影响Fig.3 Monoterpene flux in C. lanceolata and S. superba in response to different heating methodsCK:未增温 No heating;HW:电热线增温 Heating wire heating;IR:红外线辐射器增温 Infrared radiator heating;桩柱状图中不同小写字母表示不同处理间显著性差异(P<0.05)
杉木MTs通量中柠檬烯占比最大,未增温、电热线增温和红外辐射器增温三个处理中,柠檬烯通量分别为:5336.025、11903.633、2871.701 pmol m-2s-1,其分别占到各处理MTs通量65.10%、73.3%、71.3%。木荷MTs组分中,柠檬烯、γ-松油烯和α-松油烯占比最大,其中γ-松油烯和α-松油烯通量随着温度上升增加,电热线增温处理下γ-松油烯增加幅度更大,占MTs通量29.6%,IR处理下γ-松油烯的增加幅度更为明显,占MTs通量39.4%(图4)。
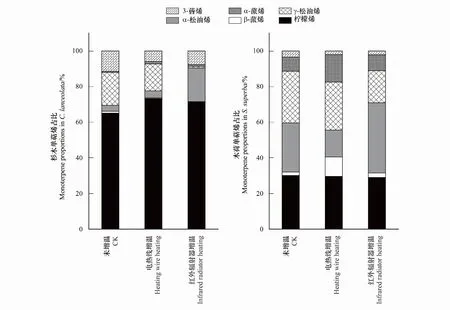
图4 不同增温方式对杉木和木荷单萜烯占比的影响Fig.4 Monoterpene proportions in C. lanceolata and S. superba in response to different heating methods
2.2 植物光合速率及相关参数
增温方式影响植物光合参数,且杉木和木荷对不同增温方式的响应不一致(表1)。增温处理导致杉木净光合速率下降,但处理间均无显著性差异(P>0.05)。增温处理后木荷净光合速率增加,其中电热线增温处理下效果显著(9.890±1.015) μmol CO2m-2s-1,且处理间存在显著性差异(P<0.05)。电热线增温处理导致两种植物气孔导度和蒸腾速率增加,但红外辐射器增温处理下两种植物气孔导度和蒸腾速率均降低。不同处理下木荷蒸腾速率存在显著性差异(P<0.05)。
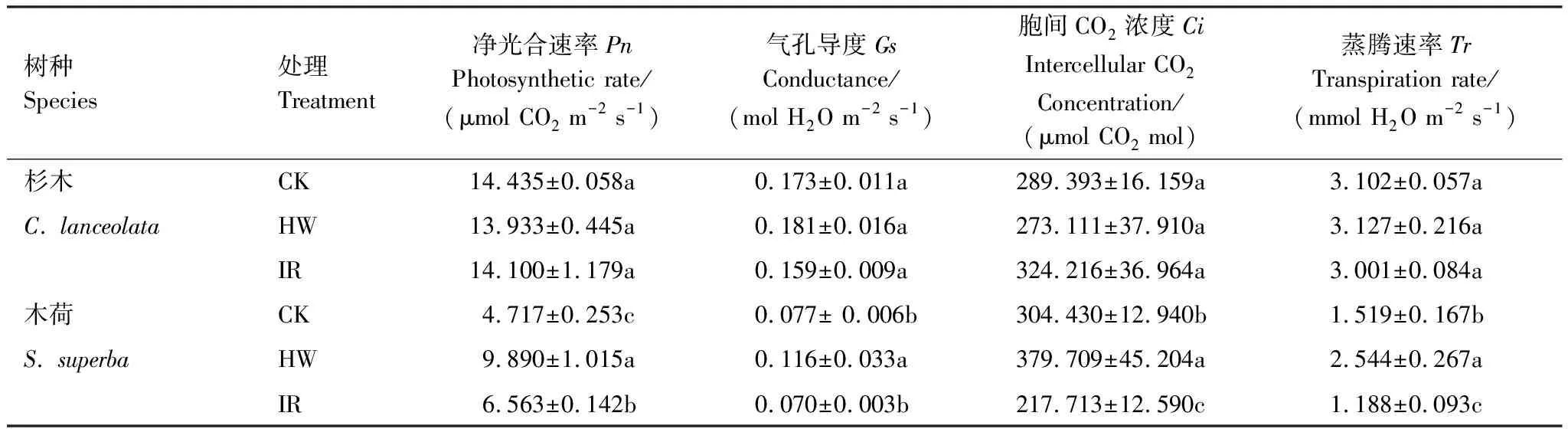
表1 不同增温方式对杉木和木荷光合参数的影响(平均值±标准偏差,n=3)
电热线增温、红外辐射器增温处理导致杉木叶绿素a含量分别降低28.0%、20.1%,不同处理间无显著性差异(表2);红外辐射器增温处理下杉木叶绿素b含量增加2倍。与未增温处理(1.935±0.455) mg/g相比,经过电热线增温、红外辐射器增温处理后木荷叶绿素a含量分别增加了39.5%、24.0%,且效果显著(P<0.05)。与杉木类似,红外辐射器增温导致木荷叶绿素b含量增加。
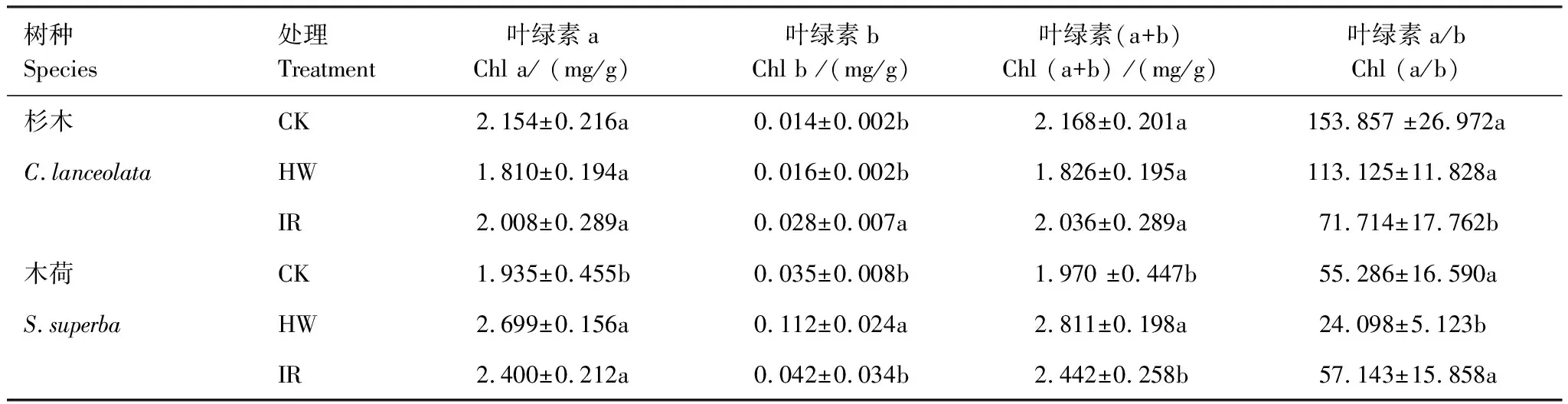
表2 杉木和木荷叶绿素对不同增温方式的响应(平均值±标准偏差,n=3)
2.3 过氧化氢和过氧化氢酶(CAT)
杉木H2O2含量结果表现为:电热线增温(1.184±0.009) mmol/g>红外辐射器增温(0.838±0.181) mmol/g>未增温(0.545±0.052) mmol/g,各处理间存在显著性差异(P<0.05)(图5)。增温处理下木荷H2O2含量增加,电热线增温处理H2O2含量增加显著(1.521±0.119) mmol/g,约增加86.85%;红外辐射器增温处理导致木荷H2O2含量增加16.58%,但未增温和红外辐射器增温无显著性差异。与H2O2相似,增温处理下杉木和木荷二者的过氧化氢酶活性均有增加。红外辐射器增温导致杉木过氧化氢酶增加显著(增加39.7%);而木荷在电热线增温下增加显著(增加31.1%)(图5)。
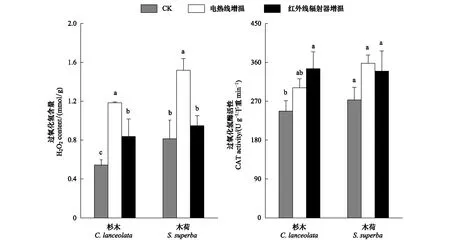
图5 不同增温方式对杉木和木荷过氧化氢含量和过氧化氢酶活性的影响Fig.5 The H2O2 and CAT in C. lanceolata and S. superba in response to different heating methods
3 讨论
3.1 不同增温方式对杉木、木荷单萜烯通量的影响
温度对植物BVOCs释放影响尤其突显。据报道,未来的几十年里,随着温度升高,植物BVOCs释放大约会增加30—45%。植物BVOCs释放依赖于温度变化[30]。研究表明,在气候变暖这一大趋势下,北极苔原沼桦MTs释放量将会增加3倍[16];气候变暖促进极地沼泽BVOCs释放增加[31]。本试验结果显示电热线增温导致杉木MTs通量显著增加(P<0.05)(图3),此结果与以前的研究报道一致,即在一定范围内,BVOCs通量随着温度升高而增加[13],这是由于温度升高,植物本身具有的防御机制会诱导其释放出更多的BVOCs从而增加自身的耐高温性[32]。温度升高植物会释放出更多的MTs和绿叶挥发物,从而避免损伤叶绿体内囊体膜[33]。红外辐射器增温导致杉木和木荷MTs通量下降(图3),这可能与植物的气孔导度变化有关(表1)。植物自身会调节气孔大小来调节植物叶片中的CO2和水分等以保持其体内的碳水平衡,从而适应外界环境温度变化。温度升高会引起蒸汽压亏缺增加,从而导致植物气孔关闭,并最终引起植物气孔导度下降[34]。气孔是植物释放MTs的通道,有研究发现,植物气孔导度发生变化时,由于萜烯类化合物在气液间的分配占比不同,萜烯类化合物在细胞间的分压也会发生改变[35—36]。红外辐射器增温导致杉木和木荷气孔导度降低,而萜烯类化合物在气孔内外的扩散速率不能维持原有的释放速率,从而导致MTs通量下降。
增温处理导致杉木净光合速率下降,电热线增温降低更显著(表1)。这种现象可能是植物体内活性氧积累导致的。H2O2等活性氧的形成是由于植物脂质过氧化和膜损伤,植物在高温、干旱和强光等外界环境胁迫条件下,H2O2是细胞光合电子传递链不可避免地产物。过氧化氢酶是植物生长发育过程中用于构建植物防御体系的关键酶之一,其可以催化H2O2生成H2O和O2,进而保护细胞膜的稳定性和完整性。另外,过氧化氢酶参与光保护及抵御逆境胁迫、延缓植物衰老的过程,能提高植物光合作用。杉木在电热线增温下H2O2含量高于另外两个处理,植物体内积累过多的活性氧,损害其生长发育。同时,电热线增温下杉木体内的过氧化氢酶活性较低,进而降低植物的净光合速率(图5)。
植物MTs释放和光合作用都是植物体参与碳循环的重要途径,二者之间关系密切。植物BVOCs释放与光合参数之间存在多组显著相关关系[27],该现象与本研究结果存在差异。有研究发现,植物叶片释放的高活性MTs会占到植物光合作用固碳的1.9%,这个值在夏季最高可达5.13%,且MTs和光合作用的显著正相关关系只有在夏季才会出现[37]。因此,本研究中MTs和光合作用之间不存在显著性相关关系可能是季节所致。比较不同增温方式对两种植物MTs通量的影响发现,与红外辐射器增温相比,杉木在电热线增温下MTs通量增加更为显著,各处理间存在显著性差异(P<0.05)。但不同增温方式对木荷MTs通量无显著性影响,这可能是由于增温处理时间较短,不同增温处理对木荷MTs通量的影响还未达到显著水平。
3.2 增温方式对不同树种单萜烯通量及光合特性的影响
根据全球BVOCs排放清单,植物为了适应环境变化,其释放MTs具有明显的种间特异性[38]。有研究表明多数阔叶林和落叶林是异戊二烯强排放体,而针叶林和农作物一般以释放MTs为主[29],这与本研究结果一致,即杉木MTs通量远高于木荷。这可能是植物体内释放异戊二烯和MTs过程不同导致的,有关研究表明,在植物体内,合成的MTs通常储存在植物专门的储存结构中(如树脂管、腺体和分泌细胞),且最后只有部分释放到大气中,而异戊二烯在植物叶片中被合成后,立即通过气孔释放到大气中[36]。
光合作用是植物进行物质生产的基础。本试验结果表明温度升高木荷光合速率增加,这可能是由于温度升高促进Rubisco的羧化速度,同时抑制1,5-二磷酸核酮糖(RuBP)的氧化作用,进而提高植物的光合作用,降低其呼吸作用[39]。温度升高抑制杉木光合速率,这可能是温度升高下植物中Rubisco表观活性和电子转移速率降低,从而导致植物光合速率下降。植物光合作用不仅受到温度和光照等环境因子的影响,还与植物自身的生理生态息息相关,叶绿素含量直接影响植物的光合速率,木荷体内叶绿素含量更高,有利于CO2获得更高程度的吸收和利用,同时也会促进对光能的固定,进而提高木荷光合速率。电热线增温和红外辐射器增温均导致杉木净光合速率降低,且电热线增温效果更显著,这是由于两种增温方式的原理不同。电热线增温可以产生恒定温差且直接对植物升温,并对植物新陈代谢产生直接影响,进而导致净光合速率降低。红外辐射器增温原理与之不同,它主要模拟全球变暖中向下增强的红外线辐射,这种增温模式可能更大程度上改变的是植物呼吸作用而对植物的光合作用产生的影响更小[24]。
4 结论
(1)不同增温方式对植物单萜烯通量影响差异较大。电热线增温导致杉木和木荷单萜烯通量增加,红外辐射器增温降低其单萜烯通量,这主要受植物气孔导度影响。杉木单萜烯通量明显高于木荷,意味着植物排放单萜烯等BOVCs具有明显的种间特异性。
(2)增温对杉木和木荷光合速率影响不一致。增温促进木荷但抑制杉木光合速率,其中电热线增温对两种植物的影响更明显,这是由于红外线辐射器增温模拟全球变暖中向下增强的红外线辐射,对植物的光合作用产生的影响更小。
(3)考虑到不同增温方式对生态系统中植物影响的差异,在开展模拟增温对生态系统结构和功能影响的研究时,尽量同时同地设置多种增温方式,分析其对生态系统产生的差异性影响,为完善生态系统对增温的响应提供更可靠的证据。

