基于红外测温的火针“温通”效应改善脊髓损伤作用靶点研究*
赵志恒 ,张胤弢 ,李璨 ,李蕾 ,徐家淳
(1.天津中医药大学第二附属医院脑病针灸中心,天津 300250;2.天津中医药大学研究生院,天津 301617)
脊髓损伤(SCI)是由坠落、交通事故及暴力损伤等因素导致一种破坏性的中枢神经系统疾病。SCI具有高致死率和高致残率的特点,可造成脊髓功能暂时或永久性的缺损,表现为损伤平面以下运动、感觉或自主功能的丧失[1-2]。尽管已有大量对于SCI的基础研究和临床治疗研究,但西医对此缺乏有效的治疗措施。
SCI属于中医“痿证”“痹证”“体惰”的范畴,临床研究已证实传统针刺疗法治疗该病获效显著[3-4]。而火针疗法属于针刺疗法的一种,具有独特的“温通”效应,可有效治疗痹证、痿证。研究表明,火针疗法可改善SCI后相关症状[5],但火针“温通”作用的起效靶点及作用机制仍待挖掘。
热休克蛋白(HSP)是在高温、机械损伤、炎症等各种应激性刺激下产生的具有多种生物学保护作用的内源性应激蛋白,这可能与火针“温通”效应的作用靶点有关。HSP可通过抑制神经元凋亡,在SCI后继发性损伤中起着重要的保护作用。因此,本研究拟在红外测温的基础上,观察火针疗法对HSP60的影响,探索火针疗法是否具有减轻SCI后神经元凋亡的作用,为明确火针疗法“温通”效应改善脊髓损伤的作用靶点提供部分实验依据。
1 材料
1.1 实验动物 SPF级雌性SD大鼠120只,体质量240~260 g,购自斯贝福(北京)生物技术有限公司,合格证号:SCXK(京)2019-0010;大鼠均饲养于南开医院实验动物中心(12 h光照-黑暗交替,室温22℃,相对湿度50%)。采用随机数字表法将只大鼠随机分为5组:假手术组、模型组、毫针组、艾灸组、火针组,每组分为1、3、7、14 d共4个时点(参考Lee等的研究[6]),每组每个时点6只大鼠。造模前适应性喂养1周,食水自由。
本研究动物实验方案经过天津市南开医院实验动物伦理委员会审核(NKYY-DWL-2020-166),符合动物保护、动物福利和伦理原则,死亡动物釆取随机原则补齐数量。
1.2 主要试剂与仪器 电动颅脑脊髓损伤撞击仪(安徽耀坤 ZL-008),小动物麻醉机(R540IP),InfiRay红外测温手机热像仪T2L,科研实验用异氟烷(R510-22-16),Anti-HSP60,4%多聚甲醛(天津易生源),贺氏细火针(0.3 mm),艾绒,免疫组化检测试剂盒(SP-0023,北京博奥森)。
2 方法
2.1 动物造模 采用小动物麻醉机异氟烷气体麻醉大鼠后,采用改良的Allen’s法制备SCI模型[7],以大鼠尾巴痉挛性摆动、双下肢及身体回缩抽动、呈弛缓性瘫痪为造模成功。模型组、毫针组、艾灸组、火针组均进行造模处理,假手术组只做胸(T)9~10椎板切除术。造模成功后每天挤压排尿3次,直至反射性膀胱排空建立。
2.2 干预方法 造模成功后,对各组大鼠进行相应干预。选穴:T7、T8、T11和 T12棘突下及 T9、T10棘突下左右旁开0.5 cm处夹脊穴,共8穴。
毫针组:选用杏林牌一次性针(0.3 mm×25 mm),采用常规针刺法施于穴位,进针深度为3~5 mm,常规留针30 min,每24 h针刺1次。
艾灸组:将大鼠固定后,在相应穴位用麦粒灸(约5 mg艾绒/壮)灸5壮,每24 h施灸一次。
火针组:选用细火针(0.3 mm×25 mm),75%医用酒精棉球充分消毒针具和针刺部位,术者手持贺氏细火针,在酒精灯外焰处沿针体—针尖的顺序烧红,然后快速点刺腧穴,进针深度为3~5 mm,每24 h针刺1次。
假手术组和模型组大鼠不进行治疗性干预,在相同时间给予相同强度的抓取、固定,相应时点检测。
2.3 检测指标
2.3.1 行为学评分 采用Basso Beattie Bresnahan(BBB)行为功能评分[8],观察火针对脊髓损伤模型大鼠神经功能缺损恢复程度的影响。
2.3.2 红外测温成像 采用InfiRay红外测温手机热像仪T2L对各组大鼠基础体温、干预即刻及干预后不同时点进行红外测温,测温环境:温度22℃,湿度50%。其中,假手术组和模型组因体温波动不明显,仅观察30 min,而毫针组、艾灸组和火针组大鼠均延长测温时点,测温至90 min。
2.3.3 免疫组化检测HSP60表达 各组大鼠(每组12 只)在相应时点(1、3、7、14 d)断头处死后,提取损伤节段脊髓组织,参照免疫组化检测试剂盒(SP-0023,北京博奥森)说明书进行免疫组化染色,镜下观察阳性细胞数,比较各组脊髓损伤部位HSP60的表达。
2.3.4 TUNEL染色检测神经元凋亡 各组大鼠(每组 12只)在相应时点(1、3、7和 14 d)断头处死后,提取损伤节段脊髓组织,参照试剂盒进行TUNEL染色,光镜下观察神经元凋亡情况。
2.4 统计学方法 采用SPSS22.0软件进行统计分析,实验数据用均数±标准差(±s)表示,根据正态性和方差齐性检验结果,组间比较采用Kruskal-Wallis H检验,P<0.05表示差异具有统计学意义。
3 结果
3.1 行为学结果 在相应时间点对各组大鼠进行神经功能评分,结果显示假手术组大鼠在各个时间点均无神经功能缺损症状;模型组大鼠在各个时间点神经功能评分均明显低于假手术组,差异具有统计学意义(P<0.05)。与模型组相应时点相比,毫针组在7 d、艾灸组在7、14 d,火针组在3、7和14 d评分均明显升高,差异具有统计学意义(P<0.05);与毫针组相比,火针组14 d时评分明显升高,差异具有统计学意义(P<0.05);与艾灸组相比,火针组在7 d和14 d评分明显升高,差异具有统计学意义(P<0.05)。见表1。
表1 各组大鼠不同时间点BBB评分(±s)Tab.1 BBB scores of rats in each group at different time points(±s) 分
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与毫针组相比,△P<0.05;与艾灸组相比,▲P<0.05。
组别 动物数 时间节点1 d 3 d 7 d 14 d假手术组 6 21.00±0.00 21.00±0.00 21.00±0.00 21.00±0.00模型组 6 0.67±0.82* 1.67±1.03* 3.67±1.96* 7.50±1.38*毫针组 6 1.50±1.22 2.33±0.82 6.67±2.25# 8.67±1.37艾灸组 6 1.17±0.41 2.67±1.03 5.50±2.07# 9.83±2.48#火针组 6 1.00±0.89 3.83±1.72# 7.16±0.98#▲ 13.00±3.58#△▲
3.2 红外测温结果 红外测温结果显示,各组大鼠基础体温较一致,在39℃左右。各组大鼠基础体温较高,考虑与固定时大鼠挣扎活动有关。假手术组与模型组大鼠在测温过程中温度波动较小,因此测温至固定后30 min。见表2、图1。

图1 红外测温成像下各组大鼠基础体温和0~30 min脊髓损伤局部温度变化Fig.1 Infrared thermometry changes in local temperature of SCI rats in each group at basal body temperature and 0~30 min
毫针组与火针组大鼠在针刺即刻体温出现明显降低,考虑与针刺后应激有关,艾灸组在艾灸即刻温度上升,考虑与艾灸辐射的热量有关。艾灸5min至30 min大鼠脊髓损伤局部体温波动不明显,艾灸停止后,即40min时,艾灸组大鼠温度明显降低,50min时恢复至基础体温左右,此后温度波动不明显。
毫针组与火针组体温波动呈现相似的趋势,针刺即刻时体温降低,5 min时温度回升。毫针组在针刺干预期间(30 min)体温一直低于基础体温,考虑与针刺应激相关,40 min时,停止干预后毫针组体温呈现上升趋势,波动在基础体温上下,维持到90min。火针组在火针干预5 min后温度呈缓慢上升趋势,升高0.5℃左右,且升温过程持续至90 min,见表2、3,图 2、3。

图2 红外测温成像下各组大鼠40~90 min脊髓损伤局部温度变化Fig.2 Infrared thermometry changes in local temperature of SCI rats of 3 groups at 40~90 min
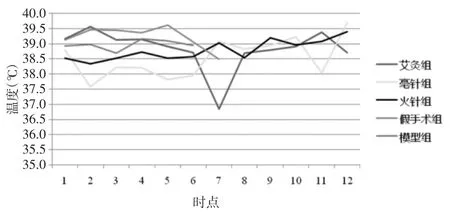
图3 各组干预后不同时间点损伤部位温度Fig.3 Temperature of the injury siteafter intervention in each group at different time points
表2 各组大鼠基础体温和0~30 min脊髓损伤局部温度变化(±s)Tab.2 Changes in local temperature of SCI rats in each group at basal body temperature and 0~30 min(±s) ℃

表2 各组大鼠基础体温和0~30 min脊髓损伤局部温度变化(±s)Tab.2 Changes in local temperature of SCI rats in each group at basal body temperature and 0~30 min(±s) ℃
组别 动物数 0 min 5 min 10 min 20 min 30 min假手术组 12 39.14±0.89 39.47±0.82 39.45±0.60 39.38±0.93 39.63±1.35 39.08±0.90模型组 11 38.93±0.64 38.98±0.88 38.69±0.69 39.16±0.87 39.10±0.50 38.95±0.41毫针组 13 38.81±0.95 37.59±1.62 38.24±1.93 38.22±2.19 37.84±2.20 37.96±2.22艾灸组 13 39.18±0.62 39.58±1.22 39.14±1.36 39.15±0.68 38.91±0.65 38.71±0.85火针组 12 39.19±0.92 38.53±1.09 38.35±1.27 38.52±1.41 38.73±1.29 38.53±1.21基础体温 时间节点
表3 3组大鼠40~90 min脊髓损伤局部温度变化(±s)Tab.3 Changes in local temperature of SCI rats of 3 groups at 40~90 min(±s) ℃
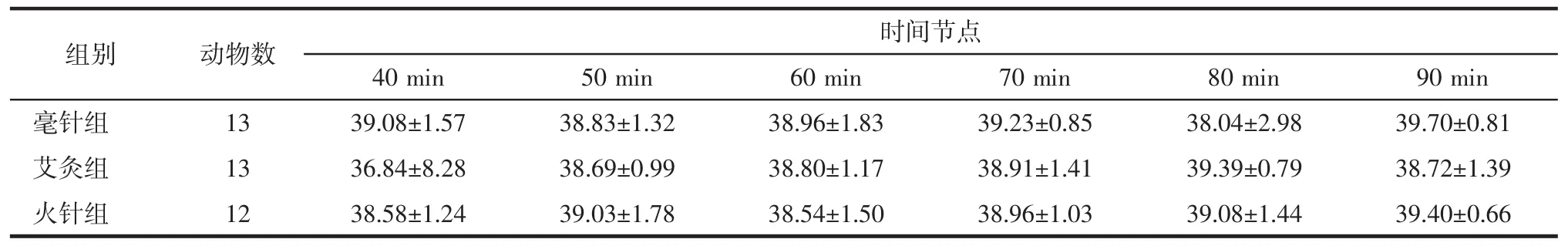
表3 3组大鼠40~90 min脊髓损伤局部温度变化(±s)Tab.3 Changes in local temperature of SCI rats of 3 groups at 40~90 min(±s) ℃
时间节点40 min 50 min 60 min 70 min 80 min 90 min毫针组 13 39.08±1.57 38.83±1.32 38.96±1.83 39.23±0.85 38.04±2.98 39.70±0.81艾灸组 13 36.84±8.28 38.69±0.99 38.80±1.17 38.91±1.41 39.39±0.79 38.72±1.39火针组 12 38.58±1.24 39.03±1.78 38.54±1.50 38.96±1.03 39.08±1.44 39.40±0.66组别 动物数
3.3 HSP60免疫组化结果 免疫组化染色结果显示,假手术组在各个时点HSP60的阳性表达相对稳定;而模型组在1 d时HSP60的阳性表达低于假手术组;与模型组各个时点相比,毫针组、艾灸组的HSP60阳性表达均增高;与毫针组和艾灸组相比,火针组HSP60阳性表达升高,且在7 d和14 d时升高最明显,见图4。

图4 各组HSP60免疫组化染色结果Fig.4 Immunohistochemical staining results of HSP60 in each group
3.4 神经元凋亡情况 TUNEL染色显示假手术组在各个时点均无或存在少量神经细胞凋亡情况;模型组在1 d时凋亡细胞明显增多,3、7和14 d时有所减轻;1 d时,与模型组相比,毫针组、艾灸组和火针组神经细胞凋亡情况与模型组相同,可见大量褐色细胞;3 d时毫针组、艾灸组和火针组神经细胞凋亡情况少于模型组,持续至7和14 d,其中火针组在14 d时仅可见少量神经细胞凋亡,见图5。表明毫针、艾灸和火针疗法均可有效减轻脊髓损伤后神经细胞凋亡情况,其中火针疗法作用较为明显。

图5 各组大鼠不同时点神经细胞凋亡情况(TUNEL染色)Fig.5 Apoptosis of nerve cells points in rats in each groupat different times(TUNEL staining)
4 讨论
《黄帝内经》云:“若有所堕坠,四肢懈惰不收,名曰体惰”,故SCI多归属于中医“痿证”“体惰”范畴。SCI的损伤部位及程度的不同可导致不同程度的神经功能缺损,表现为部分感觉或运动功能丧失、甚至受伤部位下方的完全瘫痪。不仅给患者带来巨大痛苦,而且给社会带来了沉重的负担。SCI的病理生理学进展被分为原发性和继发性损伤:原发性损伤通常由初始机械变化引起,并在损伤后立即发生,这是不可逆的;而继发性损伤是可逆的,被认为对SCI后的神经功能恢复有更显著的影响。
本病病位在督脉,督脉为“阳脉之海”,阳气者“精则养神,柔则养筋”,督脉受损则不能濡养四肢肌肉而表现为肢体瘫痪、痿弱失用,治当以温通助阳。火针疗法是将特制的针具经加热烧红后刺入人体腧穴以治疗疾病的方法,具有温通阳气之功效,首届国医大师贺普仁教授倡导火针疗法的使用,认为其具有“温通”的效应兼有“温热”和“针刺”的双重功效,火针的治病机制在温热。广泛应用于骨科、神经科等常见病种,且具有其优势病种,脊髓损伤即是其中之一[9]。
本课题组围绕火针治疗SCI的机制进行了一系列研究,发现火针疗法可促进SCI后神经元再生,有效改善模型大鼠神经功能缺损症状[10],但其起效靶点仍待进一步深入挖掘。课题组认为,火针针刺后强烈的针感和持续的热刺激对于机体来说可作为一种应激原,可能会在一定程度上激活热休克蛋白(HSP)家族相关蛋白,提高机体抵抗疾病能力。
HSP是生物细胞在各种应激性刺激(如高温、炎症、缺血缺氧、DNA损伤等)作用下产生的一组具有多种生物学保护作用的内源性应激蛋白,可增强机体对多种应激原的耐受能力,是应激反应中机体在分子水平上的保护机制[11]。已有研究发现,无论是针刺的机械刺激[12]还是艾灸的温热刺激[13-14]均可在一定程度上诱导HSP家族的合成,提高机体抵抗疾病能力。HSP在SCI后继发性损伤中起着重要的保护作用,已被证实是脊髓损伤后产生的一种重要的内源性保护因子[15-16],可通过不同途径发挥抗神经细胞凋亡、抑制神经炎症、减少自由基毒性的作用,有助于减轻SCI后继发性损伤[17-18]。
本研究发现,艾灸组在艾灸即刻温度上升,考虑与艾灸辐射的热量有关。艾灸5 min至30 min大鼠脊髓损伤局部体温波动不明显,艾灸停止后40min时,艾灸组大鼠温度明显降低,50 min时恢复至基础体温左右,此后温度波动不明显。而火针疗法针刺后,脊髓损伤局部温度首先呈现下降的趋势,毫针组亦呈现出相同的趋势,即针刺即刻时体温降低,5min时温度回升。这可能与针刺的“机械”刺激引起机体的应激反应相关。火针的操作方法为“速刺疾出”,但在干预5min后,脊髓损伤局部温度呈缓慢上升趋势,升高0.5℃左右且升温过程持续至干预90 min,与艾灸组表现不同,这可能是火针的“温通”效应的独特表现。
同时本研究发现火针疗法干预SCI大鼠后,在7 d和14 d时BBB评分明显升高,且HSP60的阳性表达明显升高,这种升高趋势在7 d和14 d时最明显。而TUNEL染色结果显示持续至7 d和14 d时神经细胞凋亡情况明显少于模型组,其中火针组在14 d时仅可见少量神经细胞凋亡,这表明毫针、艾灸和火针疗法均可有效减轻脊髓损伤后神经细胞凋亡情况,其中火针疗法作用较为明显。上述结果表明火针疗法的“温通”效应可能以HSP60为起效靶点,减轻神经元凋亡,发挥改善SCI后神经功能缺损的作用。