醋酸法提取刺葡萄皮渣中花色苷的研究*
李 娜,苏紫凌,谢钰婷,苏泽琳,林元山△
(1.湖南农业大学东方科技学院,湖南 长沙 410128;2.湖南农业大学生科院,湖南 长沙 410128)
1 前言
刺葡萄属东亚种群刺葡萄系列,为我国道地葡萄品种,风味独特,既可鲜食又可酿酒。湖南省怀化市、湘西州,贵州省铜仁市、凯里市,湖北省恩施等种植面积1.33万hm2以上[1]。花色苷是葡萄果皮中主要呈色的黄酮类物质,以C6-C3-C6 为基本骨架,以糖苷键与糖结合而成[2-3]。刺葡萄花色苷是天然色素,不仅食用安全,而且具有抗氧化、抗肿瘤、抗炎症的生物学功能[4-6]。刺葡萄经酿造后的皮渣中含丰富的花色苷,若未加以处理,不仅造成资源浪费,还会引起环境污染。为此,本研究探索简洁经济、环保友好的花色苷提取工艺,为刺葡萄酿造生产提供依据。
2 材料与方法
2.1 材料
本试验选用刺葡萄高山2号品种的酿酒皮渣,葡萄产自湖南怀化市会同县团河镇向阳紫族葡萄专业合作社,经80~90 d发酵后压榨过滤葡萄酒而得,含水量约80%,密封后,-20 ℃冰箱冷藏备用。盐酸,醋酸,乙酸乙酯,甲醇,乙醇,氯化钾,无水乙酸钠等试剂为国产分析纯。
2.2 试验方法
2.2.1 确定提取条件
参照龙葵果花色苷的提取工艺条件[7]并作适当调整,将高山2号刺葡萄酿酒皮渣,准确称取2.0 g酿酒皮渣若干份,葡萄皮渣与溶剂的固液比为1∶10(g∶mL),盐酸5%用为浸提溶剂,在40 ℃条件下提取时间90 min为花色苷基本提取工艺,经四层纱布过滤,采用pH示差法测定花色苷的含量。分别配制pH1.0、pH4.5的缓冲液,静置15 min使其显色稳定,采用光程为1 cm的比色皿在510 nm、700 nm下测定吸光度,根据式(1)计算提取液中花色苷含量。

式中:ΔD=(D510~D700 nm)pH1.0-(D510~D700 nm)pH4.5,Mw、ε分别为葡萄中常见花色苷锦葵色素-3-葡萄糖苷的相对分子质量和摩尔消光系数,其值均参照文献,Mw=493.2 g/moL,ε=28 000 L/(moL·cm);L为比色皿光程,其值为1 cm;N为样品稀释倍数。
2.2.2 花色苷提取的单因子试验设计
在花色苷基本提取工艺条件下,分别以固液比(1∶8,1∶10,1∶15,1∶20,1∶25);提取溶剂种类(水;盐酸、醋酸、乙醇、乙酸乙酯、甲醇等浓度为5 %);温度(30℃~70℃);提时间(30min,60min,90min,120min,150 min);醋酸溶剂体积分数(5%~30%)设计单因子试验处理,并计算花色苷的含量。
2.2.3 花色苷提取正交试验设计参照单因素试验结果的基础上,选择醋酸体积分数、浸提温度、浸提时间三因素三同水平上设计L9(33)正交试验进行优选,设计见表1。
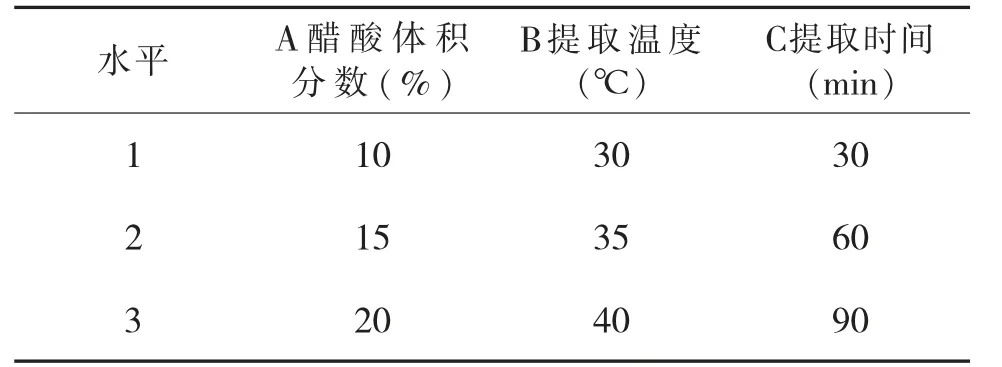
表1 刺葡萄酒渣提取花色苷的因素与水平设计
2.3 数据分析
采用Excel 2020软件对实验数据进行处理和统计学分析。
3 结果与分析
3.1 溶剂对花色苷浸提的影响
花色苷溶于水和多种极性溶剂,试验用蒸馏水和含量为5%不同溶剂进行花色苷的浸提,结果见图1,从图1 可以看出,溶剂提取差异显著(P<0.05,下同)。溶剂对花色苷提取效果由大到小依次为:甲醇>醋酸>乙酸乙酯>乙醇>盐酸>水,其中醋酸和甲醇浓度下提取液的颜色为紫红色,水、乙醇和盐酸提取液颜色偏青绿色。5%的甲醇溶液和5%的醋酸溶液提取花色苷含量分别达3.75 mg/g、3.22 mg/L,其显色度也较高。考虑到甲醇的毒性、低浓度的醋酸的安全性以及环境清洁的持续性,故选取醋酸作为提取溶剂。食用醋的主要成分为乙酸,作为食用辅料的历史悠久,已为广大民众接受,因此,本研究将进一步探索醋酸提取葡萄皮渣中花色苷的条件。

图1 溶剂对提取刺葡萄花色苷的影响
3.2 醋酸浓度对提取花色苷的影响
醋酸浓度对提取花色苷的影响见图2。从图2可以看出,醋酸在体积分数5%~20%,花色苷含量随着醋酸体积分数的增大而增大,但是在超过20%的时候,花色苷含量开始下降,醋酸浓度在15%~20%时,花色苷的含量无显著差异,在体积分数为15%、20%时,花色苷质量浓度分别为为3.91 mg/L、3.99 mg/L,故选取15%体积分数的醋酸溶液比较适宜。
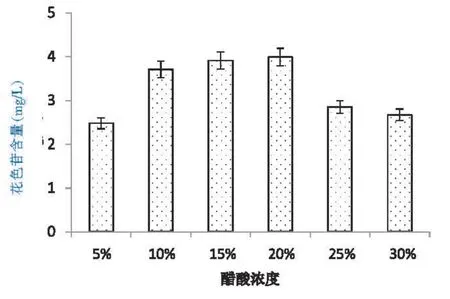
图2 醋酸体积分数对提取刺葡萄花色苷的影响
3.3 料液比对提取花色苷的影响
刺葡萄皮渣与溶剂的比例对花色苷浸提的影响结果见图3。由图3可知,以15%醋酸为溶剂,浸提90 min,40 ℃条件下,料液为1∶8~1∶25,花色苷提取的浓度由3.52 mg/L逐渐降至1.69 mg/L,但花色苷提取总量由28.2 mg逐渐提升降至42.3 mg。料液比在1∶15~1∶25,花色苷提取总量差异不明显,料液比在1∶15时,花色苷提取总量为38.7 mg,考虑到溶剂体积过大对后续工艺浓缩的负面影响,优选料液比在1∶15为宜。

图3 料液比对浸提花色苷的影响
3.4 提取温度对提取花色苷的影响
花色苷为黄酮类物质,具有抗氧化的功能,在花色苷提取过程中与空气接触能发生氧气反应,温度越高反应越快。图4显示30 ℃~70 ℃温度对提取花色苷的影响关系,温度超过35 ℃,花色苷含量随着温度增加而减少,可能是温度过高引起花色苷氧化,花色苷颜色偏暗。低于35 ℃时,可能花色苷溶解度偏低,35℃时,花色苷的含量达3.63 mg/L,此时提取温度较佳。
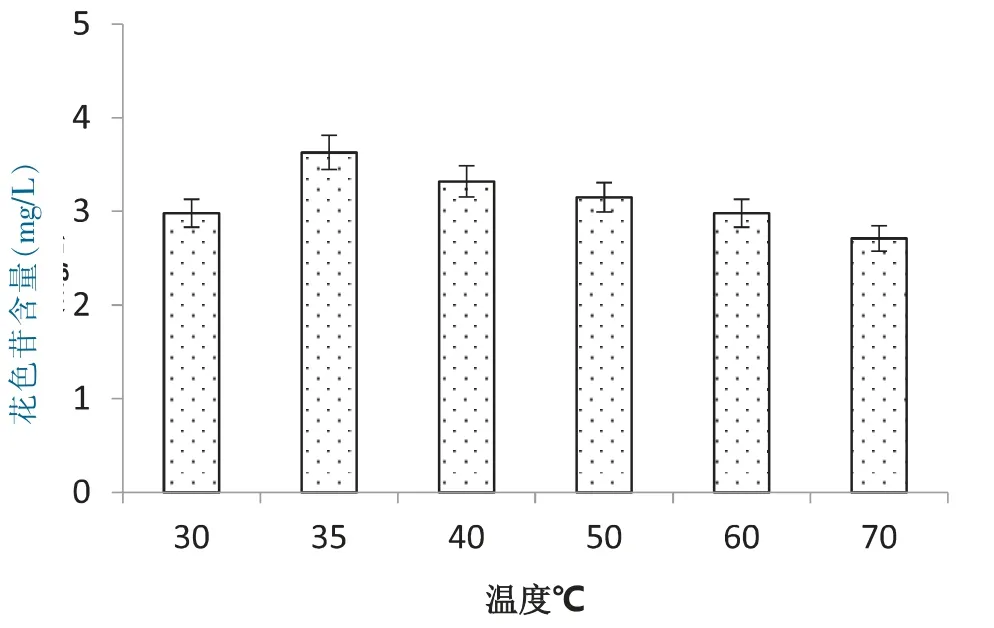
图4 温度对花色苷浸提的影响
3.5 浸提时间对花色苷提取的影响
浸提时间对花色苷提取的含量影响结果见图5。由图5可知,浸提60 min时,花色苷含量最优,达4.60 mg/L,随着浸提时间延长,花色苷还略有降低,花色苷不适宜长时间浸提。

图5 处理时间对提取花色苷的影响
3.6 刺葡萄酿酒皮渣提取花色苷的正交试验结果
根据单因素试验结果,选择醋酸体积分数、浸提温度、浸提时间三要素三水平进行正交试验,在料液比为1∶15的条件下,提取花色苷,结果见表2。由表2可知,因素A极差最大,其次是因素B,因素C影响最弱。影响刺葡萄酒渣提取花色苷因素顺序为A>B>C,这时,最优处理组合为A3B2C3,但该组合未出现在处理中。经验证,在料液比1∶15,醋酸体积分数20%,提取温度40 ℃,浸提时间60 min 条件下,花色苷含量达到率为5.18 mg/L,折算成刺葡萄皮渣干重的花色苷得到率为2.59‰。

表2 刺葡萄酒渣提取花色苷正交试验分析
4 讨论与结论
花色苷中多酚羟基的结构,具有抗氧化、清除自由基的功能。实验过程中可观察到花色苷在丙酮、醋酸乙酯等有机溶剂显色为青绿色,在醋酸、盐酸等酸性试剂下显色紫红,并随着浓度的增大而显色加深。国内研究文献主要用盐酸、甲醇等溶剂提取花色苷,鲜见醋酸在花色苷方面的提取应用[9]。本研究发现醋酸提取刺葡萄皮渣的花色苷提取效率优于盐酸,其安全性优于甲醇,这可为刺葡萄的花色苷在食品、保健、药物的应用方面提供安全保障,同时减轻了工业化应用时的环境污染压力。
刺葡萄在湖南怀化、吉首、邵阳等地属于土著品种,具有“皮厚肉少色素多”的特征,药食安全且历史悠久,非常适合酿造半甜型、甜型葡萄酒[10]。本研究中使用的高山2号刺葡萄,花色苷含量高,经醋酸工艺浸提,醋酸体积分数15%,料液比1∶15,提取温度40 ℃,浸提60 min,花色苷得率达259.00 mg/100 g,优于蓝莓花色苷得率207.39 mg/100 g[11]。这为刺葡萄酿酒皮渣中花色苷的大规模应用提供了理论支持。

