红霉素通过IGPD干预木糖葡萄球菌生物被膜形成机制的研究
周永辉,王 爽,崔文强,屈谦伟,罗 佳,杨奕樱
(1. 贵州中医药大学基础医学院,贵州 贵阳 550025 ; 2. 贵州中医药大学 贵州省法医中药毒理学特色重点实验室,贵州 贵阳 550025 ; 3. 中国科学院深圳先进技术研究院,广州 深圳 518055 ;4. 东北农业大学动物医学学院,黑龙江 哈尔滨 150030 ; 5.贵州中医药大学药学院,贵州 贵阳 550025)
奶牛乳房炎是导致奶牛淘汰的重要疾病之一,其致病菌主要有金黄色葡萄球菌、无乳链球菌、大肠埃希菌等[1-2]。近些年,随着抗生素的不合理使用导致细菌耐药等问题频发。有学者发现,木糖葡萄球菌(Staphylococcusxylosus)等凝固酶阴性葡萄球菌在奶牛乳房炎病例中的分离率呈逐年上升趋势,其不仅容易产生耐药性并且易携带耐药基因,已成为引起奶牛乳房炎发病的新特点[2-3]。木糖葡萄球菌是一种动物皮肤和黏膜的共生菌种,因此常存在于动物源性食物如奶类、奶类制品和发酵肉类制品中[4]。当木糖葡萄球菌形成生物被膜(Biofilm,BF)后,会使其逃避宿主免疫,产生极强的耐药性[5],导致奶牛乳房炎久治不愈,制约奶牛养殖业的发展[6]。因此,对木糖葡萄球菌生物被膜调控机制进行研究,寻找和研发新的干预生物被膜形成的药物或作用靶点,已成为当前解决由木糖葡萄球菌引起的奶牛乳房炎的重要手段之一。
生物被膜是附着在机体表面的微生物群落,在细菌的持久性感染中起着重要作用。与浮游细菌相比,生物被膜内的细菌对抗生素的抵抗力要超出多个数量级[7],而生物被膜的形成受多种复杂因素的影响和调节[8]。本课题组前期研究结果显示,木糖葡萄球菌组氨酸代谢通路中的关键酶咪唑甘油磷酸酯脱水酶(Imidazole glycerophosphate dehydratase,IGPD)在其生物被膜形成过程中具有重要调控作用,当IGPD基因(hisB)缺失后,会导致组氨酸含量和生物被膜的减少,说明其可以影响生物被膜的形成 ; 此外,由于IGPD仅存于植物和微生物中,使其成为优质的药物靶点之一,可作为潜在的药物靶标开发抑制剂[9]。
红霉素(Erythromycin)属于大环内酯类药物,对多种细菌及其形成的生物被膜有较好的抑制作用[10-11],本课题组也在前期发现,红霉素对木糖葡萄球菌生物被膜具有抑制作用[10],但其具体机制及是否以IGPD为靶点干预木糖葡萄球菌生物被膜的形成还有待研究。因此,本试验拟从红霉素对IGPD的调控及直接作用两方面探讨红霉素干预木糖葡萄球菌生物被膜形成的机制,为寻找干预木糖葡萄球菌生物被膜形成的药物靶点奠定基础,同时也为控制由木糖葡萄球菌生物被膜感染所引起的奶牛乳房炎等疾病提供依据。
1 材料与方法
1.1 菌种 木糖葡萄球菌ATCC 700404,购自美国模式培养物集存库。
1.2 主要试剂 红霉素,购自Sigma公司;结晶紫、甲醇、乙醇、冰乙酸、无水乙醇、戊二醛、叔丁醇、磷酸盐缓冲溶液,均购自天津市科密欧化学试剂有限公司;咪唑甘油磷酸酯(IGP),购自Santa Cruz Biotechnology公司;TSB培养基,购自海博生物科技有限公司;用于核酸操作的聚合酶、限制性内切酶、试剂盒等相关分子生物学试剂及耗材,均购自TaKaRa有限公司;蛋白纯化及分子互作所用药品及试剂,购自GE Healthcare公司。
1.3 主要仪器 低温高速离心机(Eppendorf 5430R),荧光定量PCR仪(Applied Biosystems),扫描电子显微镜[德国蔡司(ZEISS)公司],分子互作仪(Octet RED384,ForteBio)。
1.4 引物设计 通过Premier 5.0设计了荧光定量PCR及蛋白表达引物,引物由生工生物工程(上海)股份有限公司合成。序列信息见表1。
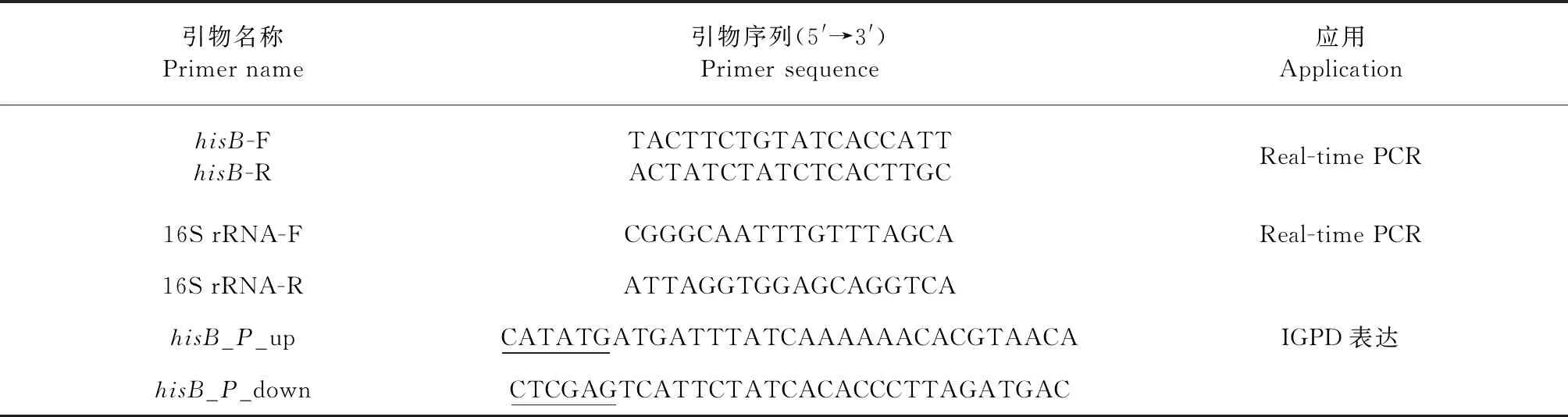
表1 本试验所用引物
1.5 试验方法
1.5.1 红霉素对木糖葡萄球菌生物被膜的抑制作用 无菌TSB培养基中培养木糖葡萄球菌至对数期,并稀释使其浓度为1×105CFU/mL,后续试验采用此浓度进行。根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)规定的判定标准测定红霉素对木糖葡萄球菌的最小抑菌浓度(Minimum inhibitory concentration,MIC);设置未加红霉素处理的木糖葡萄球菌液为对照组,1/2 MIC(0.8 μg/mL)作用下的木糖葡萄球菌液为试验组,参照杨艳北[10]操作方法,分别进行如下试验:(1)测定生长速率:24 h内每1 h取对照组和试验组菌液测定OD570 nm值进行比较;(2)结晶紫染色法:分别取100 μL对照组和试验组菌液加入96孔板,每组分别做6个重复孔,37 ℃恒温静置培养24 h,取出孔板测定OD570 nm值进行比较;(3)扫描电镜法:分别取2 mL 对照组和试验组菌液加入放有无菌毛玻璃片的6孔培养板中,37 ℃恒温静置培养24 h。取出玻片后,脱水镀膜,在扫描电子显微镜下观察生物被膜的形态。
1.5.2 红霉素对木糖葡萄球菌IGPD的调控作用 红霉素对hisB基因的影响:参照屈谦伟[12]操作方法,取1.5.1中稀释后的木糖葡萄球菌菌液500 μL加到5 mL培养基内,分组情况同1.5.1,37 ℃摇床振荡培养24 h,取出菌液离心,采用RNA提取试剂盒提取RNA,采用cDNA反转录试剂盒将RNA逆转录为cDNA。在NCBI网站上下载hisB基因序列,设计引物,以16S rRNA为内参基因。反应体系、反应程序和试验数据的处理均参照本实验室前期建立的方法[12]进行。
IGPD活性和组氨酸含量的测定:按照1.5.1培养对照组和试验组菌液,37 ℃摇床振荡培养24 h,超声破碎菌体,离心取上清。酶活性分析试验参照Bisson等[13]方法,反应底物为IGP,测定上清液OD280 nm值;组氨酸含量测定按照本课题组前期建立的方法[10]进行,配置Pauly试剂,处理样品,测定样品的OD476 nm值。
1.5.3 红霉素与IGPD的分子对接 从PDB数据库(http://www.rcsb.org/pdb/home/home.do)中下载IGPD的结构文件,使用薛定谔软件(Schrodinger docking software)的Glide模块用于分子对接。活性区域盒子中心坐标:(X:42.99,Y:132.2,Z:21.84,Radius:20 Å)。具体可参见Kataria等[14]的方法,用以计算模拟小分子红霉素与IGPD的作用关系。
1.5.4 红霉素与IGPD的相互作用 参照参考文献[12]操作方法,将IGPD蛋白纯化,得到IGPD蛋白样品,将IGPD蛋白与含0.05% Tween-20和1 mg/mL BSA的PBS溶液均匀混合,随后将IGPD蛋白偶联于Forte Bio Octet NTA传感器上;同时将红霉素进行2倍系列稀释加入样品孔;操作仪器使NTA传感器分别与不同浓度的红霉素相互作用,测定红霉素与IGPD的结合解离曲线。
1.5.5 统计分析 本试验采用 SPSS 20.0 软件对数据进行统计学分析。P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果
2.1 红霉素对木糖葡萄球菌生物被膜的抑制作用 红霉素对木糖葡萄球菌的MIC值为1.6 μg/mL。本试验首先测定了1/2 MIC(0.8 μg/mL)的红霉素对木糖葡萄球菌生长速率的影响,如图1A所示,与对照组相比,试验组的生长速率没有受到药物的影响(P>0.05);通过结晶紫染色法测定了1/2 MIC(0.8 μg/mL)的红霉素对木糖葡萄球菌生物被膜形成的干预作用,如图2B所示,与对照组相比,试验组的OD570 nm值极显著下降(P<0.01);通过扫描电子显微镜观察了1/2 MIC(0.8 μg/mL)的红霉素对木糖葡萄球菌生物被膜形态学的影响,结果如图1C和1D所示,对照组木糖葡萄球菌的生物被膜形态不同于游离菌,大量菌落排列紧密并黏附于盖玻片表面,形成成熟的生物被膜结构(图1C),试验组只有少量细菌黏附于盖玻片表面,其立体结构被破坏,不能形成成熟的生物被膜(图1D)。以上结果表明,红霉素可以有效抑制木糖葡萄球菌生物被膜的形成。

图1 红霉素对木糖葡萄球菌生物被膜的影响
2.2 红霉素对木糖葡萄球菌IGPD的调控作用 为了验证红霉素对木糖葡萄球菌IGPD的调控作用,首先通过Real-time PCR检测hisB基因的表达,结果如图2A所示,与对照组相比,试验组木糖葡萄球菌hisB基因表达极显著下调(P<0.01);随后测定了木糖葡萄球菌IGPD酶活性和组氨酸含量,结果如图2B和2C所示,与对照组相比,红霉素显著降低IGPD的酶活性(P<0.05)及组氨酸的含量(P<0.05)。

图2 红霉素对木糖葡萄球菌IGPD的调控作用
2.3 红霉素与IGPD的分子对接 采用分子对接技术对红霉素与IGPD的相互作用进行了准确模拟检测,对接结果显示,化合物红霉素酸与IGPD具有良好的结合(Docking score:-4.551)。小分子红霉素位于3个亚基形成的活性空腔中(封二彩版图3A),化合物与活性区域的氨基酸残基Arg88、Ser108形成了2个氢键,Leu40和Phe43形成2个疏水相互作用,Glu162和Glu66形成2个盐桥(静电相互作用)(封二彩版图3B)。

图3 红霉素与木糖葡萄球菌IGPD的分子对接
2.4 红霉素与IGPD的相互作用 为了验证红霉素与IGPD蛋白的直接结合作用,进行了生物分子互作试验,结果如封二彩版图4所示,红霉素与IGPD蛋白的结合在60 s内达到平衡,其解离平衡常数(Kd)为550 μmol/L,并且两者结合呈剂量依赖性,表明红霉素可以与IGPD蛋白直接相互作用。
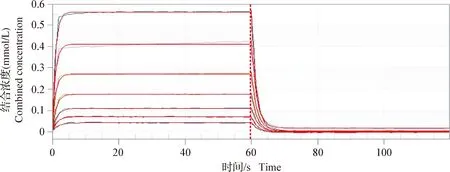
图4 红霉素与IGPD结合解离曲线
3 讨论
在早期的研究中,木糖葡萄球菌被认为是一种“无害”的菌株,但越来越多的证据显示木糖葡萄球菌与亚临床奶牛乳房炎有关[15]。此外,有学者认为,木糖葡萄球菌或多种细菌为适应自然环境而形成微菌落聚集物,形如膜状并不可逆地附着于病灶的表面,在机体内形成生物被膜(BF)[16],形成BF后具有高度的耐药性并能逃避免疫系统的攻击[5],使感染慢性化并难于控制,这也可能是凝固酶阴性细菌引起的奶牛乳房炎久治不愈的原因。因此,对木糖葡萄球菌生物被膜调控机制进行研究,寻找和研发新的干预生物被膜形成的药物及靶点,是目前解决奶牛乳腺炎的有效手段之一。
红霉素在兽医临床应用广泛,对于多种细菌及其形成的生物被膜有较好的抑制作用,例如,有研究表明,亚抑菌浓度的鱼腥草素钠与红霉素联用对表皮葡萄球菌生物被膜具有破坏作用[17];此外有研究显示,红霉素可以抑制多种细菌混合形成的生物被膜[18]。在本试验中,通过结晶紫染色及扫描电镜发现红霉素可以降低生物被膜形成量,同时抑制木糖葡萄球菌生物被膜立体结构的形成,说明红霉素对木糖葡萄球菌生物被膜形成具有较好的抑制作用。此前有报道表明,红霉素抑制木糖葡萄球菌生物被膜的形成可能与其调控了谷氨酰胺合成酶(GlnA)[10]和乳酸脱氢酶(LDH)[19]有关,但其是否存有其他机制及靶点还有待研究。
此前,本课题组通过试验发现,IGPD在木糖葡萄球菌生物被膜形成过程中扮演着重要调控作用,并可能作为潜在的药物靶标来开发抑制剂[9],那么红霉素是否以IGPD为靶点干预了木糖葡萄球菌生物被膜的形成,值得进一步的研究。本试验采用Real-time PCR、酶活性测定和组氨酸含量测定等试验,结果显示,红霉素可以显著下调hisB基因的表达,同时降低IGPD的酶活性及组氨酸的含量,这些结果表明红霉素能够通过调控IGPD,从而影响组氨酸合成通路,进而抑制生物被膜的形成;进一步采用分子对接及等离子共振试验,可见红霉素与IGPD有较好的直接相互作用,表明IGPD可能是红霉素作用的靶标;通过红霉素对IGPD的调控及直接结合两方面作用的结果,推测红霉素可能以IGPD为作用靶点抑制木糖葡萄球菌生物被膜的形成。
本试验通过一系列试验初步证实红霉素可能通过作用于IGPD抑制木糖葡萄球菌生物被膜的形成,但红霉素干预生物被膜形成是否还有其他机制有待进一步研究;本试验除可为寻找干预木糖葡萄球菌生物被膜形成的药物靶点提供科学依据外,在以红霉素为母核结构研发新的抗生物被膜药物上也能提供一些思路;此外,中药因其多靶点、毒副作用小等优点已逐渐被关注[20],而在未来的研究中,也会重点关注是否能够筛选到以IGPD为作用靶位干预生物被膜形成的中药。

