lncRNA GK-IT1通过调控醛缩酶A影响非小细胞肺癌细胞的恶性进展
刘子杨,王小文,陈 力
重庆医科大学附属第一医院胸心外科,重庆 400016
肺癌是世界上最常见的恶性肿瘤之一,全世界每年约有120万新增患者[1]。在我国,2020年肺癌新发病例数和死亡病例数居各类肿瘤之首[2]。肺癌可分为 非 小 细 胞 肺 癌 (non-small-cell lung cancer,NSCLC)与小细胞肺癌。据估计,NSCLC 约占所有肺癌的80%,是最常见的具有高侵袭性的肺癌类型之一。尽管诊断及治疗方式在不断发展,NSCLC患者5年生存率仍然低于20%,死亡的主要原因是发生远处转移[3],而在此过程中肿瘤细胞的侵袭与迁移可能发挥着重要作用。目前,对于NSCLC 侵袭与迁移的机制尚不完全清楚。因此,寻找新的影响NSCLC 侵袭与迁移的潜在靶点,对提高NSCLC 治疗效果及改善患者临床预后有着积极意义。
众所周知,绝大多数癌细胞的能量产生形式为糖酵解,其中糖酵解酶起着关键作用。而糖酵解酶属于兼职酶,不仅具有催化功能,还可发挥类似RNA 结合蛋白的作用。醛缩酶是糖酵解过程的参与者之一,其中醛缩酶A(aldolase A,ALDOA)是几乎所有癌症中含量最丰富的醛缩酶异构体[4],其在多种类型的癌症(包括肺癌、肝细胞癌、结肠直肠癌和胰腺癌)中高表达[5]。ALDOA 可以与长链非编码RNA(long non-coding RNA,lncRNA)共同调节癌细胞的生物学功能,比如ALDOA可以与lncRNADIO3OS共同调节胰腺癌细胞的增殖和侵袭能力[6]。研究表明,lncRNAArst可通过调控ALDOA介导的肌动蛋白骨架完整性来抑制胶质瘤进展[7]。目前,关于lncRNA 与ALDOA 之间关系的研究还相对较少。因此,探索lncRNA 是否通过ALDOA 影响NSCLC 的生物学功能可能是一个潜在的研究方向。
lncRNA 已被证实与肿瘤的发生发展过程息息相关[8]。lncRNA 广泛参与不同水平的基因调控,比如表观遗传调控、转录和转录后加工等[9],也可作为肿瘤抑制因子或癌基因而发挥作用[10]。值得注意的是,lncRNA 的独特特征也可能反映癌症的进展,影响肿瘤中的多种生物学过程[11-13]。在之前的研究[14]中,我们发现甘油激酶-内含子转录本1(glycerol kinase-intronic transcript 1,GK-IT1)在食管鳞癌细胞中高表达,且能调控其增殖与凋亡,但GK-IT1在NSCLC 及其他肿瘤疾病中发挥的作用尚不明确。因此,本研究旨在探索lncRNAGK-IT1与ALDOA 对NSCLC 细胞恶性表型的影响,以期为进一步研究NSCLC的疾病发展与靶向治疗提供新的策略。
1 材料与方法
1.1 材料
1.1.1 细胞与临床组织标本 人NSCLC 细胞株A549、H358 均购自武汉普诺赛公司。正常支气管上皮细胞BEAS-2B,人NSCLC 细胞株H1299、H1975受赠于重庆医科大学实验研究中心。
42 对癌及癌旁组织均来自2020 年12 月-2021 年7月在重庆医科大学附属第一医院首次确诊的NSCLC患者。其中男性17 例,女性25 例,年龄40~82 岁。按照第8 版肺癌TNM 分期系统进行T 分期统计,其中T1/T2期24例,T3/T4期18例。所有组织标本由重庆医科大学实验研究中心保存。
1.1.2 主要试剂及仪器 RPMI 1640 培养基、DMEM F-12K 培养基、胎牛血清均购自美国Gibco 公司,BeyoClick EdU-555 细胞增殖检测试剂盒和Cell Counting Kit-8(CCK-8)试剂盒购自上海碧云天生物技术有限公司;TRIzol 裂解液、SYBR Premix EX Taq Ⅱ试剂盒、PrimeScript 反转录试剂盒购自大连TaKaRa 公 司;GK-IT1的 小 干 扰RNA (small interfering RNA, SiRNA)、 阴 性 对 照(SiRNA negative control,Si-NC)及转染试剂均购自重庆莱伯斯生物技术有限公司;荧光原位杂交(fluorescencein situhybridization,FISH)实验试剂盒及混合探针购自广州锐博生物有限公司;GK-IT1、ALDOA及甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的特异性引物由上海生工生物工程股份有限公司合成;PAGE 凝胶(10%)购自上海雅酶生物医药科技有限公司,抗波形蛋白(vimentin) 抗 体(R22775)、抗E 钙 黏 蛋 白(Ecadherin) 抗 体(R22490)、抗N 钙 黏 蛋 白(Ncadherin)抗体(R23341)、抗肌动蛋白(β-actin)抗体(380624) 购自成都正能生物有限公司,抗ALDOA抗体(ab150396)购自英国Abcam公司。
实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪(CFX96)购自美国Bio-rad 公司,多功能酶标仪购自美国Thermo Electron 公司,显微镜和配套成像系统购自日本Olymous公司。
1.2 实验方法
1.2.1 细胞培养及转染 NSCLC 细胞A549 使用DMEM F-12K培养基(含10%胎牛血清和1%青霉素/链霉素),H358使用RPMI 1640培养基(含10%胎牛血清和1%青霉素/链霉素),于37 ℃、5% CO2的细胞培养箱中培养。取对数生长期的细胞,以4×105个/孔的密度接种至6 孔板内,待细胞生长至汇合度为70%时,按照转染试剂说明书,向细胞中分别转入Si-GK-IT1#1、Si-GK-IT1#2、Si-NC 或ALDOA 过表达质粒(购自上海汉恒生物科技有限公司),待24、48 h 后进行后续实验。SiRNA 序列信息如下:Si-GK-IT1#1 正义链为5′-CGU UGA GAG UCU UAG UAAA-3′,反义链为5′-UUU ACU AAG ACU CUC AACG -3′;Si-GK-IT1#2 正 义 链 为5′-GGA AGG UUC UGU AGC UAUA-3′,反义链为5′-UAU AGC UAC AGA ACC UUCC-3′;Si-NC 正义链为5′-UUC UCC GAA CGU GUC ACGU-3′,反义链为5′-ACG UGA CAC GUU CGG AGAA-3′。
1.2.2 qRT-PCR 检测NSCLC 组织及细胞株中的GKIT1表达水平 在50 mg 冻存的NSCLC 组织和癌旁组织中,分别加入1 mL TRIzol;在人正常支气管上皮细胞BEAS-2B及转染了SiRNA的A549、H358细胞中加入1 mL TRIzol。提取的总RNA 用酶标仪检测其纯度与浓度。取1 μg RNA反转录为cDNA。qRT-PCR检测NSCLC组织及癌旁组织的GK-IT1及ALDOA相对表达水平,再以相同的方法检测上述细胞株中的GK-IT1的表达水平。qRT-PCR 的10 μL 扩增体系:5 μL SYBR Premix Ex Taq Ⅱ、1 μL cDNA、上下游引物各0.5 μL、3 μL DEPC 水。程 序 设 置 为:95 ℃3 min;95 ℃5 s,60 ℃25 s,72 ℃25 s,循环数为40次。每个 样 本 设 置3 个 复 孔,采 用2-ΔΔCT法 对GK-IT1、ALDOA表达水平进行分析。所设计的GK-IT1引物上游序列为5′-AGC GGT AGA GTC AGC TCT GTT TG-3′,下游序列为5′-CAC CAT GCC CAG CCG TAAC-3′。ALDOA特异性引物的上游序列为5′-GGA AAA GGG CAG GGG TCA TTA-3′,下游序列为5′-AGT AGC AAG TTC CTG CGGC-3′。GAPDH引物上游序列为5′-GAA GGT GAA GGT CGG AGT C-3′,下游序列为5′-GAA GAT GGT GAT GGG ATT TC-3′。
1.2.3 CCK-8 实验 实验分为Si-NC、Si-GK-IT1#1、Si-GK-IT1#2共3组。将各实验组细胞按3 000个/孔接种于96孔板,每组3个复孔。待细胞贴壁之后,取出一块96 孔板,避光,每孔加入10 μL CCK-8 工作液,继续避光孵育90 min。随后以酶标仪检测波长为450 nm 处的吸光度值[D(450 nm)],共检测4 d,绘制细胞生长曲线。共转染Si-GK-IT1#2与ALDOA过表达质粒后,进行CCK-8 挽救实验,分为对照(control, Ctrl)、 Si-GK-IT1#2 及Si-GK-IT1#2+ALDOA组,操作同前。
1.2.4 EdU 实验 实验分为Si-NC、Si-GK-IT1#1、Si-GK-IT1#2 共3 组。将各组细胞以2×105个/孔接种于铺有爬片的24 孔板,待细胞汇合度为70%~80%时,按照EdU 试剂盒说明书进行后续实验。待上述步骤完成后,小心取出爬片,抗荧光淬灭剂封片,荧光显微镜拍照。记录视野内EdU阳性细胞与细胞总数之比。共转染Si-GK-IT1#2 与ALDOA过表达质粒后,行EdU 挽救实验,分为Ctrl、Si-GK-IT1#2、Si-GKIT1#2+ALDOA组,操作同前。
1.2.5 Transwell侵袭实验 基质胶制备:各取97 μL培养基,分别加入3 μL Matrigel,充分混匀,每个小室加入100 μL 混匀后的液体,放置于37 ℃环境中1 h,使Matrigel凝聚成胶。实验分为Si-NC、Si-GK-IT1#1、Si-GK-IT1#2共3组。使用不含血清的培养基将各组细胞按2×105个/孔加入上室内,下室加入500 μL完全培养基,放入细胞培养箱内培养24 h。随后取出小室,4%多聚甲醛固定,0.5%结晶紫染色,棉签轻柔擦掉上层残留细胞,待自然晾干后拍照。随机取3个视野,统计视野内可见细胞个数。共转染Si-GK-IT1#2 与ALDOA过表达质粒后,行Transwell 侵袭实验,分为Ctrl、Si-GK-IT1#2、Si-GK-IT1#2+ALDOA组,操作同前。
1.2.6 细胞划痕实验 实验分为Si-NC、Si-GK-IT1#1、Si-GK-IT1#2 组。在6 孔板背面垂直于长轴用直尺标记划竖线,再将各实验组细胞按6×105个/孔接种于6孔板,缓慢轻柔混匀。待细胞铺满小孔后,用枪头顺着竖线笔直划痕,PBS 清洗掉落的细胞。第0、24 h取样,测量并记录细胞迁移的距离,计算迁移率。共转染Si-GK-IT1#2 与ALDOA过表达质粒后,行细胞划痕实验,分为Ctrl、Si-GK-IT1#2、Si-GK-IT1#2+ALDOA组,操作同前。
1.2.7 FISH 实验 按照说明书利用所合成的混合探针在H358 和A549 细胞上进行FISH 实验。用1×PBS预洗细胞5 min。将2.5 μL 探针加入100 μL 含10%甲酰胺、2×柠檬酸盐钠、10%硫酸葡聚糖的预杂交液中进行杂交。在37 ℃的湿化室中杂交过夜。杂交结束后,PBS清洗2次,每次5 min,成像并记录。细胞红色荧光范围表示GK-IT1的亚细胞定位。
1.2.8 RNA 免疫共沉淀实验 A549 或H358 细胞在1 mL 裂解缓冲液中裂解,吹打混匀,置于冰上10 min。4 ℃、14 000×g离心10 min 后取上清。加入蛋白 A/G 磁 珠 进 行 RNA 免 疫 共 沉 淀 (RNA immunoprecipitation,RIP)实验。分别将裂解产物与5 μL 兔抗ALDOA、正常兔抗IgG 在4 ℃条件下孵育过夜,4 ℃、12 000×g离心10 min,保留沉淀,加入1 μL洗脱缓冲液,清洗3次,每次2 min。使用Trizol裂解液提取RNA,进行qRT-PCR 检测,操作步骤与检测条件同前。设置抗IgG 组与抗ALDOA 组。采用2-ΔΔCT法对GK-IT1表达水平进行统计,以此确定相对抗IgG 组,结合于抗ALDOA 组的RNA 中GK-IT1是否呈明显富集。
1.2.9 生物信息学分析 通过RNA-蛋白质相互作用预 测 网 站 RPIseq (http://pridb. gdcb. iastate. edu/RPIseq/)分析GK-IT1与ALDOA 蛋白的相互作用关系,结果以RF classifier(Range Forest classifier)和SVM classifier (Support Vector Machine classifier) 2种算法呈现。计算RNA 与蛋白质的相互作用概率。相互作用概率大于0.5,表明相应的RNA 与蛋白质相互作用概率较大。
1.2.10 Western blotting实验 将各组细胞收集待用,加入RIPA 细胞裂解液于4 ℃反应30 min,超声裂解,4 ℃、12 000×g离心15 min之后提取蛋白。按照BCA试剂盒说明书测定蛋白浓度。按照说明书配置PAGE凝胶(10%),每个电泳槽加入20 μg蛋白样本,进行电泳分离,在冰浴条件下将蛋白转移至PVDF 膜,将PVDF 膜放至脱脂奶粉中,然后于常温摇床上封闭1 h。分别加入上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白抗体(抗vimentin 抗体、抗E-cadherin抗体、抗N-cadherin抗体)、抗β-actin抗体和抗ALDOA 抗体,于4 ℃摇床上过夜。室温摇床上孵育正常兔抗IgG 1 h。TBST 洗膜3 次,每次5 min,显影分析电泳条带。
1.3 统计学分析
分别采用SPSS 22.0 及GraphPad Prism 8.0 软件进行数据分析和绘图。定量资料用±s表示。采用独立样本t检验分析2 组数据间的差异;多组比较采用单因素方差分析(One-Way ANOVA),若差异有统计学意义则用最小显著性差异法进行2 组间比较。P<0.05表示差异有统计学意义。
2 结果
2.1 NSCLC组织中GK-IT1与ALDOA高表达
42 对癌及癌旁组织的qRT-PCR 分析结果显示,NSCLC 组织中GK-IT1与ALDOA的表达量均高于癌旁组织(图1A、B,均P<0.05)。将42 例病例按T 分期分为T1/T2组(n=24)和T3/T4组(n=18),分析2组GK-IT1表达量的差异。结果显示,T3/T4组中GK-IT1的表达水平明显高于T1/T2组(图1C,P=0.009)。
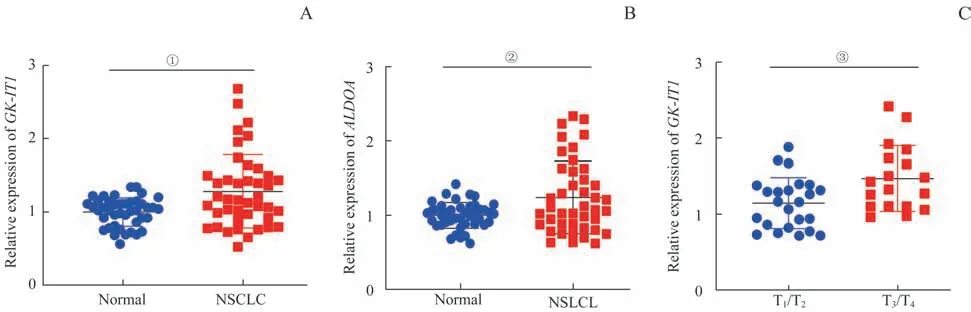
图1 NSCLC组织中GK-IT1及ALDOA的表达Fig 1 Expression of GK-IT1 and ALDOA in NSCLC tissues
2.2 GK-IT1在NSCLC细胞株中的表达水平及敲低效率
为了筛选出实验所用的细胞系,用qRT-PCR 检测人正常支气管上皮细胞BEAS-2B 以及NSCLC 细胞株(H358、A549、H1975、H1299)中GK-IT1的相对表达水平。与正常支气管上皮细胞BEAS-2B 相比,A549 及H358 细胞中GK-IT1的表达量明显升高,而H1299 和H1975 细胞中GK-IT1表达量无明显变化(图2A,均P>0.05),故采用A549 及H358 细胞进行后续实验。为了避免脱靶效应,将设计好的2 条SiRNA 序列(Si-GK-IT1#1 及Si-GK-IT1#2)转染至A549 及H358 细胞内,采用qRT-PCR 检测GK-IT1的表达量。结果显示,与Si-NC 组相比,H358 细胞中2条SiRNA 序列的敲低效率分别为48%和53%,A549细胞中Si-GK-IT1#1 和Si-GK-IT1#2 的敲低效率分别为37%和50%(图2B、C,均P<0.05)。
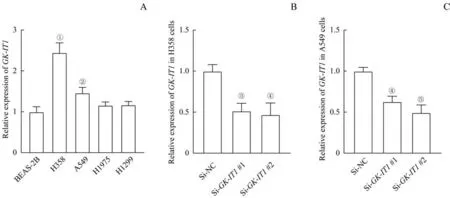
图2 GK-IT1在NSCLC细胞系中的表达及其敲减效果Fig 2 GK-IT1 expression and knockdown effect in NSCLC cell lines
2.3 敲减GK-IT1 对A549 及H358 细胞增殖能力的影响
完成SiRNA 转染之后,利用CCK-8 实验检测NSCLC 细胞的增殖能力。结果表明,敲减GK-IT1明显降低了H358 及A549 细胞的增殖能力(图3A、B,均P<0.05)。EdU 实验结果显示,Si-GK-IT1#1 及Si-GK-IT1#2组细胞的EdU 阳性比例明显低于Si-NC 组,表明GK-IT1敲减的NSCLC 细胞增殖能力降低(图3C,均P<0.05)。
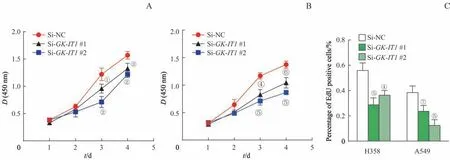
图3 敲减GK-IT1对NSCLC细胞增殖的影响Fig 3 Effects of GK-IT1 knockdown on the proliferation of NSCLC cells
2.5 敲减GK-IT1 对A549 及H358 细胞侵袭和迁移能力的影响
分别敲低A549、H358 细胞中的GK-IT1后,采用Transwell侵袭实验进行检测。结果显示,与Si-NC组相比,Si-GK-IT1#1 及Si-GK-IT1#2 组穿膜细胞个数明显减少,侵袭能力明显减弱(图4A~C,均P=0.000)。并且在细胞划痕实验中,发现Si-GK-IT1#1及Si-GK-IT1#2 组细胞的24 h 迁移率较Si-NC 组明显降低(图4D~F,均P=0.000)。
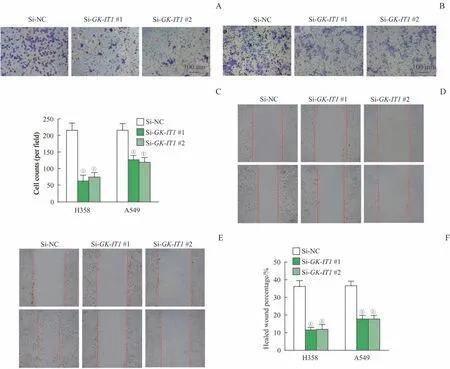
图4 敲减GK-IT1对NSCLC细胞侵袭及迁移能力的影响Fig 4 Effects of GK-IT1 knockdown on the invasion and migration of NSCLC cells
2.6 GK-IT1亚细胞定位的检测
为了探究GK-IT1影响细胞功能的作用机制,采用FISH 实验对A549 及H358 细胞中的GK-IT1进行亚细胞定位检测。红色荧光的范围可反映GK-IT1的细胞内分布情况。从图5可知,GK-IT1存在于细胞核和细胞质,但其主要分布于细胞质中。
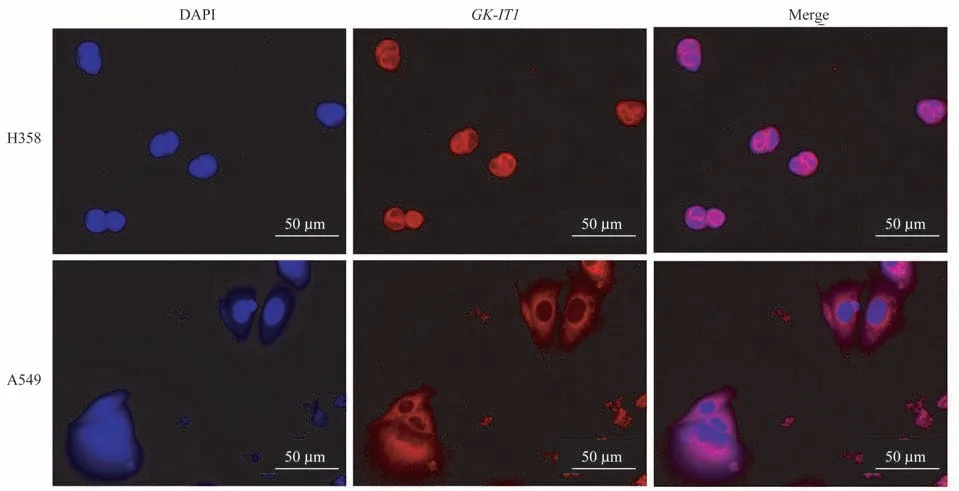
图5 GK-IT1的亚细胞定位Fig 5 Subcellular localization of GK-IT1
2.7 敲减GK-IT1 对A549 及H358 细胞中ALDOA及EMT相关蛋白表达的影响
敲低GK-IT1后,通过Western blotting 检测A549、H358细胞中vimentin、E-cadherin、N-cadherin及ALDOA蛋白的表达(图6)。与Si-NC组相比,Si-GK-IT1#1及Si-GK-IT1#2组A549、H358细胞中vimentin、ALDOA蛋白表达水平下降,而E-cadherin蛋白表达水平升高(均P<0.05),N-cadherin蛋白表达水平变化无统计学意义(均P>0.05)。提示GK-IT1可能通过调节ALDOA 及EMT相关蛋白的表达来影响NSCLC的EMT过程。

图6 敲减GK-IT1对NSCLC细胞中ALDOA及EMT相关蛋白表达水平的影响Fig 6 Effects of GK-IT1 knockdown on the expression of ALDOA and EMT-related proteins in NSCLC cells
2.8 GK-IT1与ALDOA蛋白的相互作用
进一步通过生物信息学分析探索A549、H358细胞中GK-IT1与ALDOA 之间的潜在关系,结果显示,RF classifier 和SVM classifier 结果分别为0.65 和0.87(图7A),说明GK-IT1与ALDOA 蛋白的相互作用概率较大。RIP 实验结果表明,与抗IgG 组非特异性抗体相比,结合于抗ALDOA 组ALDOA 抗体的RNA 中GK-IT1呈明显富集,差异有统计学意义(图7B,P=0.000),提示GK-IT1可能与ALDOA 蛋白相互作用。
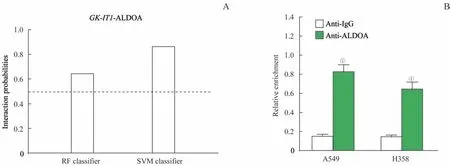
图7 GK-IT1与ALDOA的相互作用Fig 7 Interaction between GK-IT1 and ALDOA
2.9 ALDOA 过 表 达 对 敲 减GK-IT1 的NSCLC 细胞增殖、侵袭和迁移的影响
为了进一步明确GK-IT1是否通过ALDOA来调控NSCLC 细胞的增殖、侵袭及迁移,在A549 及H358细胞中进行过表达ALDOA的挽救实验。CCK-8 实验结果显示,与Si-GK-IT1#2 组相比,Si-GK-IT1#2+ALDOA组的细胞增殖能力明显增强(图8A、B,均P<0.05);EdU 实验结果表明,Si-GK-IT1#2+ALDOA组细胞的EdU 阳性比例较Si-GK-IT1#2 组明显升高,细胞增殖能力增强(图8C,均P<0.05);Transwell侵袭实验结果表明, 与Si-GK-IT1#2 组相比,Si-GK-IT1#2+ALDOA组的细胞穿膜个数明显增多,细胞侵袭能力增强(图8D~F,均P=0.000);细胞划痕实验结果说明,Si-GK-IT1#2+ALDOA组细胞的24 h 迁移率较Si-GK-IT1#2 组明显升高,细胞迁移能力增强(图8G~I,均P=0.000)。Western blotting结果显示:Si-GK-IT1#2+ALDOA组细胞中ALDOA 和vimentin 蛋白表达水平均高于Si-GK-IT1#2 组,而E-cadherin 蛋白的表达水平低于Si-GK-IT1#2 组(图9,均P<0.05)。
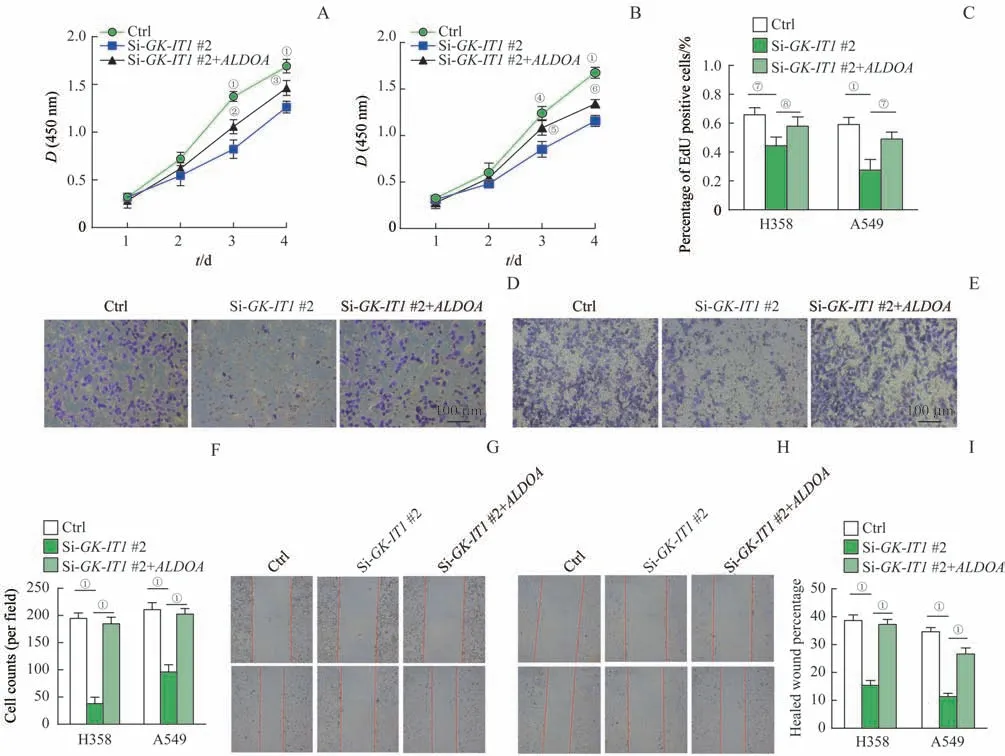
图8 过表达ALDOA对敲除GK-IT1的NSCLC细胞增殖、侵袭和迁移的影响Fig 8 Effects of ALDOA overexpression on the proliferation,invasion and migration of GK-IT1-knockdown NSCLC cells

图9 过表达ALDOA对敲除GK-IT1的NSCLC细胞ALDOA及EMT相关蛋白表达的影响Fig 9 Effects of ALDOA overexpression on the expression of ALDOA and EMT-related proteins in GK-IT1-knockdown NSCLC cells
3 讨论
lncRNA 可与RNA 结合蛋白或(和)转录因子等相互作用,影响信号通路转导,是多种细胞生物学过程的重要调控因子[15-17]。例如,LINC01354通过其p3段与RNA 结合蛋白hnRNP-D 相互作用,调控β-连环蛋白基因CTNNB1的稳定性,影响结肠癌细胞的增殖和转移[18]。大量的lncRNA已被证实与肿瘤的发展密切相关,而GK-IT1在NSCLC中的作用机制尚不明确。本研究发现GK-IT1在NSCLC组织和细胞系中高表达;多项细胞功能实验结果表明,敲减GK-IT1明显抑制NSCLC 细胞的恶性进展。因此,寻找GK-IT1影响NSCLC疾病发展的潜在靶点或可作为新的探究方向。
ALDOA 在肺癌及胰腺癌等多种疾病中高表达,可增强NSCLC 的有氧糖酵解,促进细胞周期蛋白D1的表达、G1/S 期转换和细胞增殖[19]。不仅如此,ALDOA 还可直接与lncRNAZNF674-AS1相互作用,发挥类似RNA 结合蛋白的作用,从而影响卵巢颗粒细胞的糖酵解和增殖[20]。通过生物信息学预测与RIP 实验,我们发现lncRNAGK-IT1与ALDOA 存在相互作用。FISH 实验结果提示GK-IT1主要位于细胞质,且ALDOA 也主要位于肺癌细胞的细胞质中[21]。由于细胞质中的lncRNA可通过与RNA结合蛋白相互作用来调节基因转录[22]。因此,GK-IT1可能通过与细胞质中ALDOA 蛋白结合来实现对NSCLC 细胞增殖、侵袭及迁移的调控。
EMT 是影响肿瘤细胞可塑性的重要因素[23],也是肿瘤转移的重要步骤和癌症患者预后的独立预测指标[24]。lncRNA或ALDOA均可对EMT进行调控,从而影响肺癌疾病进展。例如,lncRNAFEZF1-AS1通过Wnt 通路调节E-cadherin 的表达,诱导NSCLC 的EMT 发生及肿瘤转移[25];下调ALDOA可通过促进E-cadherin 表达,降低vimentin 表达来调控EMT,从而影响肺癌的肿瘤形成能力和迁移能力[21]。本研究结果显示,敲低GK-IT1后,EMT 相关蛋白的表达水平受到影响(图6)。前述生物信息学分析及RIP实验结果提示GK-IT1与ALDOA 蛋白存在相互作用。过表达ALDOA的挽救实验结果表明,敲低GK-IT1对细胞增殖、侵袭及迁移产生的影响被逆转。因此,我们得出lncRNAGK-IT1可通过与细胞质中的ALDOA 相互作用,调控EMT 相关蛋白的表达,进而影响NSCLC细胞的增殖、侵袭及迁移。
综上,GK-IT1在NSCLC 中高表达,可通过ALDOA 蛋白调节EMT 过程来影响NSCLC 的恶性进展。近年来对RNA 结合蛋白的研究发现,lncRNA 可通过泛素化或磷酸化参与蛋白质修饰[26-27]。GK-IT1是否通过上述方式调控ALDOA 还需进一步探讨。如果能以GK-IT1与ALDOA的相互作用为切入点,研究出相应的靶向药物,干扰糖酵解进程,或可为NSCLC的治疗提供新的思路,进而可能改善疾病预后。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有实验均已通过重庆医科大学附属第一医院伦理委员会的审核批准(文件号2020-732,日期2020-12-14)。所有实验过程均遵照医学伦理原则和《赫尔辛基宣言》的条例进行。受试对象或其亲属已经签署知情同意书。
All experimental protocols in this study were reviewed and approved by Ethics Committee of the First Affiliated Hospital of Chongqing Medical University (approval letter No. 2020-732, dated 12/14/2020), and all experimental protocols were carried out by following the guidelines of principles of medical ethics andHelsinki Declaration. Consent letters have been signed by the research participants or their relatives.
作者贡献/Authors'Contributions
刘子杨、王小文参与了实验设计;刘子杨、陈力参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was designed by LIU Ziyang and WANG Xiaowen. The manuscript was drafted and revised by LIU Ziyang and CHEN Li.All the authors have read the last version of paper and consented for submission.
·Received:2022-02-23
·Accepted:2022-05-06
·Published online:2022-05-28

