PEDV E 蛋白的跨膜结构域对其细胞定位的影响研究
郭德轩,郑亮,张宁,郑小会,吴志军1,,曹宏伟1,,张华1,
(2.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院;3.黑龙江八一农垦大学生物技术中心)
猪流行性腹泻(Porcine Epidemic Diarrhea,PED)是由猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus,PEDV)引起的一种急性、高度接触性肠道传染病,主要以呕吐、腹泻和脱水为特征,感染此病毒的哺乳仔猪死亡率高达100%[1]。自1971 年英国首次报道PED 以来[2-3],该病在许多国家频繁爆发。尽管已有部分PEDV 疫苗上市[4-5],但疫情仍然持续爆发,给世界各国养猪业造成巨大经济损失,引发公共卫生问题[6],受到世界各国养猪业和相关科研人员的关注。
PEDV 是导致PED 的病原体[7]。研究发现,PEDV属于冠状病毒科甲型冠状病毒属,是一种有囊膜的单股正链RNA 病毒,具有感染性,其基因组编码了4个结构蛋白:纤突蛋白(S)、膜蛋白(M)、囊膜蛋白(E)和核衣壳蛋白(N),16 个非结构蛋白(nsp1-nsp16)和ORF3[8]。在PEDV 全基因组中,其所编码的E 蛋白是病毒最小的结构蛋白,由76 个氨基酸组成,分子质量为8.8 kDa,它是位于病毒囊膜上的小包膜蛋白,E蛋白决定病毒的形状并参与病毒的复制[9]。此外,E 蛋白是一个离子通道蛋白,具有离子通道(Ion channel,IC)活性,有较强的疏水性[10]。有研究报道,冠状病毒E 蛋白可分为三个不同的氨基酸区域,分别为NTD区域、跨膜区域和CTD 区域,并且该基因序列的保守性很高,不同冠状病毒该区域的氨基酸数量有较小差别[11-12]。研究表明,PEDV E 蛋白定位于内质网和细胞核内,可引起内质网应激[13]。Zheng 等[14]发现PEDV E 蛋白能够在IPEC-J2 细胞中表达,亚细胞定位于内质网区域。在研究中,通过分析PEDV E 蛋白生物学特性发现,PEDV E 蛋白是具有一个跨膜区的跨膜蛋白,该区域是调控全长蛋白的关键氨基酸区域。所以,推测该跨膜氨基酸区域可能在病毒蛋白亚细胞定位及行使功能过程中起到关键作用。
内质网是蛋白质的翻译重要场所,是蛋白质合成的主要细胞器,一方面选择性运出分泌蛋白和膜蛋白,另一方面保留内质网定位蛋白以维持其结构和功能[15]。对内质网定位信号的研究,有助于对其他细胞器蛋白定位及运输的探讨[16]。
为了验证此猜想,研究围绕跨膜区氨基酸构建了三种重组质粒,并验证其正确表达后转染HEK-293T 细胞和IPEC-J2 细胞,检测其重组蛋白分布情况以及亚细胞定位情况。为进一步研究其跨膜区在E蛋白行使功能过程中起到何种作用奠定了基础。尤其是对研究PEDV E 蛋白定位信号具有指导性,研究将有助于了解PEDV 包装过程,更有助于进一步探索PEDV 的发病机理和预防。
1 材料与方法
1.1 材料
1.1.1 质粒与细胞
pCMV-Myc 质粒、pCMV-Myc-E 质粒由黑龙江八一农垦大学生物技术中心509 实验室构建并保存。DH5α 感受态细胞由黑龙江八一农垦大学生物技术中心509 实验室制备。猪小肠上皮细胞(IPECJ2)、人胚肾细胞(HEK-293T)由黑龙江八一农垦大学生物技术中心509 实验室保存。
1.1.2 试剂与抗体
TRIzol 试剂(101002)购自Thermo Fisher Scientific 公司;反转录酶M-MLV(Rnase H-)、限制性内切酶、Ex Taq 聚合酶均购自Takara 公司;转染试剂LippfectamineTM2000(11668019)购自Invitrogen 公司;质粒小提试剂盒(D6943-02)和胶回收试剂盒(D2500-02)购自Omega 公司。小鼠抗Myc 标签单克隆抗体(TA-01)、TRITC 标记的羊抗小鼠IgG(ZF-0313)均购自北京中杉金桥生物技术有限公司。
1.1.3 引物设计
根据已发表在GenBank 网站中的PEDV CV777毒株基因序列报道,设计具有特异性的E 基因上下游引物,上游序列:5’-CCGGAATTCGGATGCTACAATTAGTGAATGATA-3’(EcoR I)和下游引物:5’-ATAAGAATGCGGCCGCTACGTCAATAACAGTAC-3’(Not I)。E 蛋白截短基因E-T1 上下游引物,上游序列:5’-CCGGAATTCGGATGCTACAATTAGTGAATGATA-3’(EcoR I)和下游引物:5’-GGGGTACCCAGTTAACCAATTGGACGAAGGTA-3’(Kpn I),E 蛋白截短基因E-T2 上下游引物,上游序列:5’-CCGGAATTCGGATACTTTGGCTTTTCGTACT-3’(EcoR I)和下游 引 物:5’-GGGGTACCCAGTTAACCAATTGGACGAAGGTA-3’(Kpn I),E 蛋白截短基因E-T3 上下游引物,上游序列:5’-CCGGAATTCGGTGCTTCACTTGTCACCGGTTGTGTA-3’(EcoR I)和下游引物:5’-GGGGTACCTACGTCAATAACAGTACTGGGGAGGG-3’(Kpn I)。将E 基因插入到pCMV-Myc 的EcoR I/Not I 位点,将E-T1、E-T2、E-T3 基因插入到pCMVMyc 的EcoR I/Kpn I 位点。
1.2 实验方法
1.2.1 RNA 的提取
采用TRIzol 法提RNA,从-80 ℃冰箱取出病变猪小肠,将组织用液氮研磨,收集在DEPC 水浸泡过高压灭菌烘干(无RNA 酶)的1.5 mL 的离心管中,并加入500 μL 的Trizol 溶液,剧烈摇晃1 min 左右,静置10~15 min,使组织充分裂解。取200 μL 的三氯甲烷溶液加入离心管中,立刻上下颠倒15 s,静置12 min。13 200 r·min-1低温高速离心10 min。离心后上下分层,吸取上清到新的DEPC 水浸泡过高压灭菌烘干(无RNA 酶)1.5 mL 离心管中,再取600 μL 的异丙醇溶液加入管中,缓慢地上下颠倒15 s,放在冰盒中静置12 min。13 200 r·min-1低温高速离心15 min。吸弃掉600 μL 上清,吸取600 μL 的75%乙醇溶液到离心管,上下颠倒混匀,冰盒中静置5 min,10 500 r·min-1低温高速离心5 min。弃掉大部分上清,4 ℃离心,13 200 g 离心1 min。吸弃掉剩余液体,吹干酒精5 min,再加入20 μL 的DEPC 水,静置15 min,使RNA 充分溶解。溶解后,检测其总RNA 浓度标记好,进行反转录试验。
1.2.2 RT-PCR
取DEPC 水浸泡过高压灭菌烘干(无RNA 酶)PCR 管,体系如下:模板0.5 μg,10 mM Oligo(dT)1 μL,DEPC 水2 μL。RT-PCR 的温度设置:70 ℃运行10 min,4 ℃保存。一个循环后放在冰中3 min 冷却。之后向上述PCR 管中分别加入如下体系:5×MMLV buffer 2 μL,dNTP Mixture 2 μL,RNase Inhibitor(40 U·μL-1)0.5 μL,RTase M-MLV 0.5 μL,DEPC水1.5 μL。PCR 仪设置程序:30 ℃运行10 min,42 ℃运行60 min,70 ℃运行15 min,4 ℃保存,一个循环后取出,放在冰上冰2 min。得到cDNA 样品作为模板进行常规PCR 或于-20 ℃冰箱保存。
1.2.3 PCR 扩增
以cDNA 为模板进行配置,体系如下:模板1 μL,dNTP 2.0 μL,10×PCR buffer 3.0 μL,上下游物各0.2 μL,Taq 酶0.13 μL,用ddH2O 补足20 μL。放到PCR 仪中进行扩增,运行期间,配置1%琼脂糖凝胶,待胶凝固后,点样跑胶。跑完胶后切下带有目的条带的胶,进行胶回收后,直接连接或保存在-20 ℃。
1.2.4 转化
取出在16 ℃水浴锅中的连接产物,置于DH5α感受态细胞中,再放进冰中冰浴30 min。时间结束之后,42 ℃热激90 s,立刻放入冰中,静置3 min。加入900 μL 无抗性LB 培养液,37 ℃摇晃复苏30~60 min。复苏后,5 000 r·min-1离心3 min,涂布于含有氨苄青霉素的固体培养基上,随后倒置放在37 ℃培养箱中培养。第二天观察菌落,若有菌落出现,挑下菌落对应抗性的培养基中,37 ℃摇床培养16 h,随后使用质粒试剂盒提取质粒。
1.2.5 转染细胞
将HEK-293T 和IPEC-J2 细胞进行传代,每孔500 μL 铺板到24 孔板中,第二天观察细胞长到每孔的80%左右时,转染转化得到的质粒。先向离心管中加入适量的无血清的DMEM 培养基,之后按照每孔800 ng 质粒和每孔1 μL 脂质体Lippfectamine TM2000 分别加进去,静置5 min。将装有质粒与脂质体LippfectamineTM2000 的溶液混合,静置20 min,将混合液加入到相应的孔中,放入二氧化碳培养箱中培养,6 h 后将不含胎牛血清的DMEM 培养基换成10%胎牛血清的DMEM 培养基,继续培养。
1.2.6 间接免疫荧光(IFA)鉴定
待转染质粒24 h 后,从温箱中取出细胞培养板,吸弃细胞培养液,用PBS 清洗细胞培养孔两遍,多聚甲醛加入到每个细胞培养孔500 μL,固定10 min。时间结束后,吸弃多聚甲醛,用PBS 清洗细胞孔三遍,15 min 换液洗一遍。每孔加入0.1%Trion-100(曲拉通)500 μL,透膜放置20 min,用PBS 清洗细胞孔三遍,15 min 换液洗一遍。每孔加入500 μL 的5%BSA封闭2 h,用PBS 清洗细胞孔三遍,15 min 换液洗一遍。用鼠源抗Myc 单克隆抗体(1∶500)作为一抗,室温孵育2 h,用PBS 清洗细胞孔三遍,15 min 换液洗一遍。用TRITC 标记的山羊抗小鼠IgG(1∶500)作为二抗室温避光孵育2 h,用PBS 清洗细胞孔三遍,15 min换液洗一遍。用免疫荧光显微镜观察PEDV E 以及E-T1、E-T2、E-T3 的蛋白表达,待正确表达后,用荧光封片剂DAPI 进行压片染核。
2 结果与分析
2.1 PEDV E 基因、E-T1 基因、E-T2 基因和E-T3基因的扩增
在感染PEDV 的病变猪小肠中含有PEDV 全基因组,所以研究利用Trizol 裂解法提取病变的猪小肠总RNA,再通过反转录的将RNA 反转录成cDNA。以cDNA 为模板,用设计好的PEDV E 基因、E-T1 基因、E-T2 基因和E-T3 基因的上下游引物(含双酶切位点)进行PCR 扩增。已知PEDV E 蛋白的15-37 氨基酸区域是跨膜区域,研究围绕此跨膜区构建不同截短基因,最终得到对应大小的PEDV E 基因、E-T1基因、E-T2 基因和E-T3 基因的片段,符合预期结果,结果如图1。
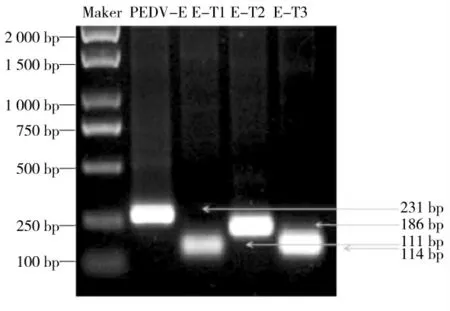
图1 PEDV E 基因、E-T1 基因、E-T2 基因和E-T3 的扩增Fig.1 Amplification of PEDV E gene,E-T1 gene,E-T2 gene and E-T3
2.2 E 基因、E-T1 基因、E-T2 基因、E-T3 基因及载体的双酶切
利用对应限制性内切酶EcoR I/Not I 切割E 基因以及pCMV-Myc 载体片段,用EcoR I/Kpn I 切割E-T1 基因、E-T2 基因、E-T3 基因片段,通过常规PCR 电泳得到相对应的基因和载体的双酶切条带,符合预期结果,结果如图2。

图2 PEDV E 基因、E-T1 基因、E-T2 基因和E-T3 基因双酶切Fig.2 Double restriction digestion of PEDV E gene,E-T1 gene,E-T2 gene and E-T3 gene
2.3 重组质粒的双酶切鉴定
经过双酶切、连接、转化、提取质粒后,取重组质粒pCMV-Myc-E 加入EcoR I/Not I 两种限制性内切酶、Myc-E-T1、Myc-E-T2 和Myc-E-T3 加入EcoR I/Kpn I 两种限制性内切酶,最后放入37 ℃水浴锅酶切12 h 或过夜进行双酶切鉴定。通过常规PCR 电泳得到基因和载体相对应片段的双酶切鉴定条带,符合预期结果,结果如图3。

图3 PEDV E 基因、E-T1 基因、E-T2 基因和E-T3 基因双酶切鉴定Fig.3 Identification of PEDV E gene,E-T1 gene,E-T2 gene and E-T3 gene by double restriction digestion
2.4 免疫荧光鉴定重组质粒的表达情况
将pCMV-Myc-E 质粒、Myc-E-T1、Myc-E-T2和Myc-E-T3 质粒分别转染HEK-293T、IPEC-J2 细胞系24 h 后,利用间接免疫荧光方法检测其核分布情况,结果显示,在HEK-293T 细胞系内,转染pCMV-Myc-E 质粒的实验组检测到了PEDV E 蛋白定位在细胞质上,并且发现Myc-E-T1 和Myc-E-T2分布在细胞质中,与Myc-E 的分布极其相似;而Myc-E-T3 的细胞定位在整个细胞中,其中在细胞核的区域较多,在细胞质的区域中较少,在IPEC-J2 细胞系内有同样的结果,结果如图4。
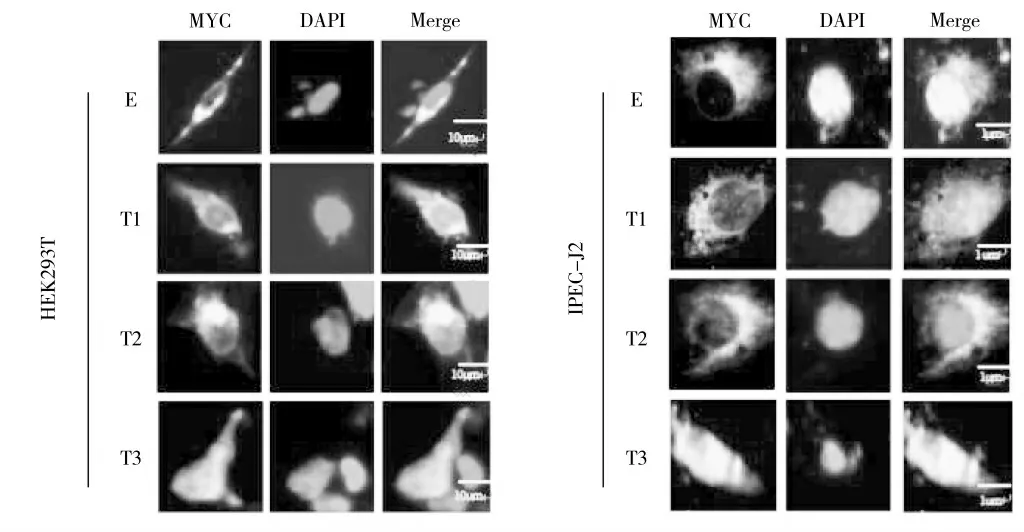
图4 PEDV E、T1、T2、T3 蛋白的间接免疫荧光检查Fig.4 PEDV E,T1,T2,T3 protein indirect immunofluorescence(IFA)
2.5 亚细胞定位
转染pCMV-Myc-E 质粒、Myc-E-T1、Myc-E-T2和Myc-E-T3 质粒到HEK-293T、IPEC-J2 细胞系24 h 后,利用间接免疫荧光的方法检测其与内质网的共定位情况,发现PEDV E 蛋白能够定位于细胞内质网区域,而T1 和T2 能够与内质网发生强烈的共定位现象,与E 蛋白相似,但T3 则未见此定位情况,结果如图5。综上结果说明T1 和T2 可能行使着与E 蛋白类似的功能,而T3 则没有。

图5 PEDV E、T1、T2、T3 蛋白亚细胞定位Fig.5 PEDV E,T1,T2,T3 protein subcellular localization
3 讨论
猪流行性腹泻(PED)是由猪流行性腹泻病毒(PEDV)引起的传染性肠疾病,以呕吐,腹泻和脱水为病症基本特征。20 世纪80 年代后该病在中国广泛传播,从那时起,PEDV 成为引起腹泻最常见的病毒之一。2010 年10 月,由PEDV 变异毒株引起的PED大规模暴发,给全国养猪业带来了巨大的经济损失[17]。目前,PED 是中国养猪行业最大威胁之一。PEDV 的高变异性越加复杂异构,对高效疫苗的发展构成了重大挑战,PEDV 的研究也将会越来越广泛和深入。
E 蛋白是构成PEDV 的结构蛋白之一,能够参与病毒囊膜的形成并且在病毒复制与出芽过程中发挥重要作用[18]。Xu 等[19]发现PEDV E 蛋白能够在IEC细胞中表达,亚细胞定位于内质网区域,产生非折叠蛋白,激活细胞中GRP78 的蛋白表达;同时,PEDV E蛋白对p65 蛋白表达呈现出上调的趋势。PEDV E 蛋白跨膜区16-20AA 缺失和L25P 突变的新变异进一步上调了内质网应激指标的产生,改善了IL-6 和IL-8 的表达,并在体外促进了细胞凋亡[20]。余丽芸等[21]通过把PEDV 的E 基因导入甲病毒载体系统,构建成携带PEDV 的E 基因的重组SFV 病毒颗粒。
通过生物信息学软件分析发现[22],PEDV E 蛋白是一个具有一个跨膜区的跨膜蛋白,推测跨膜区可能在蛋白行使功能中占有重要的地位。以PEDV E蛋白作为研究对象,发现通过其跨膜结构域构建三个不同的截短基因,经通过克隆技术后得到相应的重组质粒,将其转染细胞,发现重组质粒Myc-E-T1、Myc-E-T2 与pCMV-Myc-E 蛋白类似,定位在细胞质上并与内质网发生共定位,而Myc-E-T3 则没有。说明T1 与T2 行使着与E 蛋白相同的功能。后续研究会更加深入地了解PEDV 生物学以及致病机制,并为开发有效疫苗和控制策略提供理论基础。

