鞘内注射干扰素调节因子8小干扰RNA对术后持续性疼痛大鼠痛阈及脊髓小胶质细胞活化的影响*
徐昌顺, 林 春, 蔡振宇
(1. 厦门大学附属第一医院疼痛科, 厦门 361001; 2. 福建医科大学基础医学院 脑老化与神经变性疾病重点实验室 福建医科大学疼痛研究所, 福州 350108)
外科手术引起的慢性疼痛仍是一个备受关注的临床问题。术后慢性疼痛的发生率因人而异,据报道,多达20%~56%的患者在手术后出现慢性疼痛[1]。手术后慢性疼痛,也称为术后持续性疼痛(persistent postsurgical pain,PPsP),即国际疼痛研究协会(International Society for the Study of Pain,IASP)定义的手术及其邻近部位持续3个月以上乃至数年的痛觉过敏[2]。近来研究表明[3],在手术后急性疼痛持续化或转为慢性痛的病理生理进程中,小胶质细胞的激活被认为是中枢敏感化的“发动机”,与术后持续性疼痛的产生及维持有关[4]。干扰素调节因子8(interferon regulatory factor 8,IRF8)是IRF转录因子家族的成员。已有文献证实IRF8在中枢神经系统(CNS)的小胶质细胞中有特异性表达,是小胶质细胞活化成反应性表型过程中的关键性转录因子[5]。为此,本研究拟通过皮肤/肌肉切开和牵拉(skin/muscle incision and retraction,SMIR)建立术后持续性疼痛(PPsP)大鼠模型,探究鞘内注射IRF8 SiRNA对SMIR诱导的PPsP大鼠痛阈改变及脊髓小胶质细胞活化的影响,旨在为PPsP的临床治疗提供新的思路。
1 材料与方法
1.1 实验动物
清洁级雄性SD大鼠,体重180~250 g,购自福建医科大学实验动物中心[实验动物许可证号:SCXK(闽)2016-0007]。动物饲养室有良好的通风和空气过滤系统,大鼠于自然光下饲养,室温维持在(25±1)℃左右,湿度55%左右,自由摄食水。
1.2 实验仪器与设备
Von Frey纤维丝(Aesthesio,USA);微型撑开器(深圳瑞沃德生命科技有限公司);EL-800多功能酶标仪(BIO-TEK,USA); Mini PROTEAN转模系统(BIO-RAD,USA);凝胶成像分析系统(上海培清);流式细胞仪LSRFortessaX-20(美国BD公司);解剖显微镜(日本尼康);透射电子显微镜(美国FEI公司)。
1.3 主要药品与试剂
盐酸利多卡因注射液(上海禾丰制药有限公司); IRF8 SiRNA(英国Cohesionbio公司);Anti-GAPDH(武汉ABclonal生物科技有限公司);Anti-CD45(PE-Cyanine7,美国Biolegen);Anti-CD11b/c(PE,美国Invitrogen);Anti-Iba1、Anti-CX3CR1(英国Abcam);Alexa Fluor 647标记山羊抗兔IgG、DAPI染色液、DEPC水、大鼠IgG、RIPA 裂解液、BCA 试剂盒(碧云天生物技术有限公司);MinuteTM新鲜组织单细胞悬液分离试剂盒(美国Invent公司)。
1.4 模型建立与鞘内给药
雄性SD大鼠120只按随机数字量表法分为:假手术组(Sham组,SH,n=12),模型组(SMIR组,SM,n=48),溶媒组(SMIR +DEPC组,SD,n=12)和IRF8沉默组(SMIR +irf8 SiRNA组,SS,n=48)。其中,模型组大鼠麻醉起效后于后腿中部隐静脉内侧作1.5~2 cm的纵行皮肤切口显露大腿部肌肉,再于深面股薄肌表面做一长约7~10 mm的手术切口,牵拉大腿皮肤和浅层肌肉至2 cm,持续牵拉1 h,术毕逐层缝合肌肉和皮肤[6];而假手术组仅切开,不做牵拉,余处理与模型组相同;IRF8沉默组实施鞘内插管操作[7],并于鞘内插管后一周建立PPsP大鼠模型,在建模后第5、6日分别通过鞘内导管给予IRF8 SiRNA溶液20 μl(溶于DEPC水中,150 pmol),溶媒组给予同等剂量的DEPC水。
1.5 疼痛行为学评估
采用50%机械刺激缩爪反应阈值(paw withdrawal threshol, PWT)反映大鼠痛阈改变情况。实验大鼠建模前均实施PWT测定作为基础值,并于建模后 1、3、7、12、22、33 d重复实施疼痛行为学测量;在鞘内置管各组大鼠,还需测量置管前PWT基础值。以 “up-and-down” 法测定推算其50%PWT[8,9]。具体为:Von Frey纤维丝垂直刺激大鼠后足掌部,避开爪垫,持续时间≤4 s,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。测定首先从2 g开始,当该力度刺激不能引起阳性反应,则给予相邻大一级力度刺激;如出现阳性反应则给予相邻小一级力度刺激,如此连续进行,直至出现阴性反应和阳性反应的骑跨值时,再连续测定4次。最大力度为15 g,大于此值时记为15 g。每次刺激间隔30 s,每次测量为同一后足并且纤维丝弯曲弧度相同,确保每次施加的刺激相同。
1.6 大鼠隐神经取材及电镜标本制备
建模后第12日,取假手术组和模型组大鼠各3只,麻醉后,于解剖显微镜下截取术野隐神经,保存于电镜固定液中前固定,再经漂洗、后固定、梯度脱水、包埋、修整、切片后进行醋酸铀、柠檬酸铅染色,制成电镜标本,于TECNAI型透射电镜下观察隐神经纤维超微结构改变情况。
1.7 Western blot检测Iba1蛋白的相对表达量
于建模后第12日,疼痛行为学测量结束后,每组随机取6只大鼠脊髓L4-6节段背角组织,称重后加入RIPA 裂解液充分裂解后匀浆,离心后取上清液,BCA试剂盒测定总蛋白含量。制备分离胶和浓缩胶,蛋白上样,凝胶电泳至溴酚蓝跑出分离胶后,将蛋白转移至 PVDF 膜上,5%脱脂奶粉室温下封闭2 h,根据目的蛋白分子量裁剪条带,分别加入稀释后的兔抗鼠一抗(Iba1,1∶1 000;GAPDH,1∶ 5 000), 4℃孵育过夜。次日用 TBST液洗涤条带 3 次,每次15 min,加入HRP标记的山羊抗兔二抗(1∶2 000)室温下孵育2 h,TBST 液洗 3 次,每次 15 min,之后进行ECL显影。应用 Image J 软件分析条带灰度值,根据目的蛋白和内参蛋白(GAPDH)对应灰度值的比值表示蛋白相对表达水平。
1.8 流式细胞术检测小胶质细胞活化情况
本研究采用流式细胞术检测模型组及鞘内给药组脊髓背角中小胶质细胞的活化情况。取各时点行为学测试后大鼠6只,麻醉后经心灌注取术侧脊髓背角L4-6节段,按照MinuteTM新鲜组织单细胞悬液分离试剂盒说明书步骤,制备脊髓组织单细胞悬液并细胞计数。每管取1 ×106cells/100 μl,加大鼠lgG封闭,再依次加入一抗(CD45, 0.25 μg/106; CD11b/c,0.125 μg/106;CX3CR1,1∶10 000)及Alexa Fluor 647标记山羊抗兔IgG的二抗(1∶500),4℃,避光翻滚混匀各30 min,重悬后再转移至流式上样管后加DAPI 染色液上机检测。实验结果采用 Flowjo-V10软件处理分析并绘制相关图表。
1.9 统计学处理
2 结果
2.1 鞘内注射IRF8 SiRNA对大鼠痛阈的影响
结果表明,建模前,SM组与SH组大鼠基础PWT无统计学意义(P>0.05);与术前基础值相比, SM组术后第1日术侧后足PWT开始下降,持续到术后第22日(P<0.05,P<0.01),并在术后第33日恢复至术前水平;与SH组相比,SM组术侧后足PWT在术后第1日,第3日,第7日,第12日,第22日均显著下降(P<0.05,P<0.01),提示SMIR能够引起术侧显著且持久的机械痛觉过敏,这与之前的研究结果相似[10];与SD组相比,SS组术侧后足PWT在术后第7日,第12日,第22日均显著增加(P<0.05,P<0.01);但SS组术侧后足痛阈恢复程度上仍未达到正常水平,与SH组相比,建模后第7日(P<0.01),第12日(P<0.01),第22日(P< 0.05,表1)。

Tab. 1 Changes of pain threshold induced by SMIR in each group (g,
2.2 PPsP大鼠隐神经超微结构改变情况
通过比较SH组与SM组大鼠术后第12日术野隐神经电镜结果发现:两组大鼠隐神经纤维被厚的髓鞘包绕,髓鞘板层致密、完整,且边界清晰,未出现神经受损时的脱髓鞘反应。髓鞘平均厚度在SH组为(377.0 3±69.60)nm,SM组为(369.50±73.26) nm,两组间相比无统计学意义(P>0.05,图1),说明SMIR并未造成外周神经损伤。
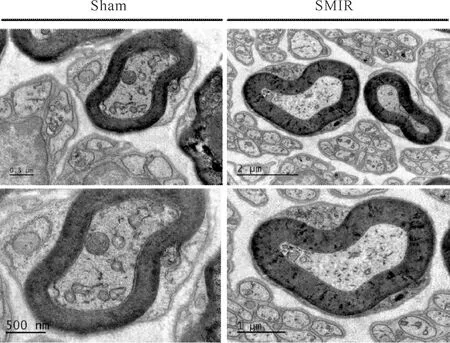
Fig. 1 Transmission electron micrograph of the saphenous nerve fiber on the 12th day after SMIR
2.3 鞘内注射IRF8 SiRNA对脊髓背角Iba-1表达的影响
建模后第12日,脊髓背角Iba-1蛋白相对表达量(统一规化于GAPDH):SH组为 0.283± 0.058,SM组为 1.101±0.073,与SH组相比,SM组明显上调(P<0.01,图2);鞘内给予IRF8 SiRNA后,SD组为 0.906±0.067,SS组为 0.609±0.074,与SD组相比,SS组Iba-1表达受到抑制(P<0.05,图2),但与SH组相比,SS组Iba-1蛋白的表达亦上调(P< 0.05,图2);而SM组与SD组之间,Iba-1蛋白的表达无统计学意义(P>0.05,图2)。

Fig. 2 Expressions of Iba-1 in spinal dorsal horn in each group
2.4 鞘内注射IRF8 SiRNA对小胶质细胞活化的影响
在SM组, PPsP大鼠脊髓背角小胶质细胞活化从术后第1日即开始增加,至第3日达到高峰,于第7、12日继续维持在高水平,直至第22日开始恢复,并于第33日恢复至术前水平(图3);与D0相比,小胶质细胞活化比率在术后第3日、第7日、第12日、第22日均显著增加(P<0.05,P<0.01,表2)。鞘内给药前,SS组大鼠脊髓背角小胶质细胞活化改变模式与SM组基本一致,与建模前相比,SS组术后第3日达到高峰(P<0.01),而在各时点两组间相比,差异无统计学意义(P>0.05);鞘内给药后,SS组脊髓背角小胶质细胞活化比率明显下降,并维持在低水平至术后第33日,与SM组相比,SS组术后第7日、第12日均显著降低(P<0.01,表2,图3)。

Fig. 3 Flow cytometry scatter diagram of representing activated microglia of spinal dorsal horn at different time points
Tab. 2 Effects of the activation of microglia in spinal dorsal horn by intrathecal administration of IRF8 SiRNA in PPsP rats n=6)
3 讨论
术后持续性疼痛,被认为是影响患者术后康复和生活质量的重大健康问题,具有重要的法律和医疗经济后果。关于术后慢性疼痛研究的动物模型, Flatters等[6]率先提出了大鼠皮肤肌肉切口牵拉(SMIR)的动物模型,很好的模拟了手术过程中切口牵拉的外科行为。在本项研究中,我们通过SMIR诱导了大鼠术后长达30 d的痛觉过敏,并在术后第33日左右恢复至术前水平,其术后疼痛反应模式与文献报道的基本一致[10]。并且先前研究还指出,SMIR术后对隐神经取材切片,发现各组隐神经有髓鞘纤维数量之间无显著差异[6],同样地,本研究中我们选取大鼠SMIR后第12日的术野隐神经纤维进行透射电镜观察结果也显示,接受皮肤肌肉切口牵拉的大鼠术野外周神经并未出现神经纤维受损时的脱髓鞘反应,电镜下隐神经纤维被厚的髓鞘包绕,髓鞘板层致密、完整,边界清晰,进一步证实SMIR诱导的PPsP为非神经损伤性慢性疼痛。因此,可以认为SMIR手术在神经形态学层面对神经纤维未产生显著伤害,它所诱导产生的持续性术后痛可能是因为持续的物理性牵拉,致使神经元内发生分子生物学层面的改变。故SMIR大鼠模型能够更好的模拟持续性术后疼痛发生发展的条件,为研究术后持续性痛的分子生物学机制提供一个很好的平台。
先前报道,小胶质细胞在SMIR诱导的PPsP大鼠脊髓背角被活化成反应性表型,参与术后持续性疼痛的发生发展[4]。小胶质细胞作为CNS的常驻免疫细胞,时刻监视中枢局部微环境的变化,当神经受损或促炎细胞因子释放增加时,小胶质细胞迅速被活化增殖,在CNS中提供免疫防御的第一线。本实验首先采用Western blot检测脊髓背角Iba-1蛋白的表达情况,结果表明SMIR促进 PPsP大鼠脊髓背角小胶质细胞增殖;其次,再采用不同的小胶质细胞表面分子标记,将脊髓背角活化的小胶质细胞进行分选并计算其所占目标细胞阳性百分比。在细胞表面分子标记的选择上,本实验选择CD45、CD11b/c和CX3CR1三种分子表面标记物。CD45主要系巨噬-单核细胞来源的分子表面标记,并由所有造血细胞表达[11],而中枢神经系统小胶质细胞完全来自卵黄囊的巨噬细胞,所以CD45+标记了所有巨噬-单核系来源细胞;CD11b/c(OX-42)在静息及激活的小胶质细胞表面均有表达,是已知的小胶质细胞的标记物[12];CX3CR1也称为fractalkine受体或GPR13,在中枢神经系统中,CX3CR1仅在小胶质细胞上表达,并作为管家基因参与小胶质细胞的活化及其向突触神经元的迁移[13]。因此,本实验采用以上三种分子表面标记,参照Toledano等[14]介绍的流式细胞检测设门逻辑,即可标记出脊髓背角活化的小胶质细胞,即CD45+细胞中CD11b/c+和CX3CR1+双阳性细胞群界定为活化的小胶质细胞。本实验研究结果表明,小胶质细胞的激活于SMIR术后第3日上调,至第7日达高峰并维持至术后第22日,呈现时间差异性。本实验结果与早期的研究一致[4],但同时又补充了SMIR诱导的PPsP大鼠脊髓背角小胶质细胞激活的时间表达动力曲线。
IRF8作为干扰素调节因子家族成员(IRF1-9),在免疫细胞(如淋巴细胞和树突状细胞)的分化成熟中起着重要的调控作用[15]。近来有研究表明,IRF8在外周神经损伤诱导的神经病理性疼痛中有明显上调,并被鉴定为小胶质细胞活化成反应性表型过程中的关键性转录因子,参与神经病理性疼痛的形成[5]。刘荣国等[16]研究指出, 慢性坐骨神经缩窄损伤(chronic constriction injury of sciaticnerve, CCI)所诱导的神经病理性痛模型大鼠,鞘内注射IRF8反义寡核苷酸可抑制脊髓小胶质细胞的活化和缓解痛敏行为;反复冷刺激(repeated cold stress,RCS)可诱导啮齿类动物产生触觉异常性疼痛,并激活小鼠脊髓背角小胶质细胞,而irf8敲除小鼠未能显示RCS诱导的PWT降低[17],本实验研究结果也显示,鞘内注射IRF8 SiRNA沉默irf8后,SMIR诱导的PPsP大鼠痛阈改变模式发生改变,表现为PPsP大鼠PWT的降低被逆转,提示鞘内给予IRF8 SiRNA可逆转SMIR诱导的PPsP大鼠痛觉过敏,值得注意的是,通过给予IRF8 SiRNA抑制irf8的生物学功能,鞘内给药组大鼠机械痛觉过敏虽有明显改善,但其PWT仍无法完全恢复到术前水平。因此,除了IRF8介导的小胶质细胞活化参与,似乎还有其他机制也参与了SMIR诱导产生的机械痛敏。例如,已有文献报道,SMIR可诱导脊髓合成并释放P物质来介导中枢敏化[18]。因此,SMIR诱导机械痛觉过敏可能还存在其他机制,还需要进一步探索。本研究的结果还发现irf8沉默后,SMIR诱导的PPsP大鼠脊髓背角的小胶质细胞Iba-1蛋白表达明显下调,并且小胶质细胞的活化也呈抑制状态,irf8未沉默前,SMIR诱导的小胶质细胞活化不变,表现为SMIR术后第3日,脊髓背角小胶质细胞的活化达到高峰,随后于SMIR后第5日、第6日鞘内施于IRF8 SiRNA,小胶质细胞的活化比例也随之降低,但自始至终其活化比例均高于术前水平,说明除了IRF8调控SMIR诱导的小胶质细胞激活,也可能存在有其他机制,值得进一步研究。
综上所述,本研究发现SMIR诱导的PPsP大鼠显著且持续的机械痛觉过敏为非明显的外周神经损伤所致,可能是基于脊髓背角小胶质细胞活化所介导;并且鞘内给予小胶质细胞活化的特异性调节基因小干扰RNA可抑制脊髓背角小胶质细胞的激活,并逆转SMIR诱导的痛觉过敏。我们的研究加深了对小胶质细胞参与术后持续性疼痛作用机制研究的认识,这可望为术后持续性疼痛的预防和治疗提供新思路。

