PKC抑制剂对力竭运动大鼠肾脏裂孔膜蛋白表达的影响*
安静芳, 李 航, 杨 帆, 谢文杰, 李鹏飞, 刘 姣, 崔 迪, 周 刚
(湖南大学体育学院, 长沙 410082)
运动性蛋白尿是体育运动中常见的生理现象,即当运动强度超过机体所能承受最大负荷量时,极易引发肾脏组织损伤,出现蛋白尿、血尿等现象,是运动量过大、运动性疲劳发生的重要指征。尽管一过性尿蛋白的出现也被认为是运动后生理性表现,但运动性尿蛋白的出现是肾功能损伤的早期表现,预示着肾脏滤过系统发生改变。诸多研究认为蛋白尿与肾小球功能和结构的改变有关,而运动性尿蛋白发生机制尚不清楚。足细胞足突构成的裂孔隔膜(slit diaphragm,SD)是滤过屏障的最后一道防线,其裂孔隔膜蛋白(如ZO-1、nephrin、podocin、CD2AP等)表达下降可直接导致蛋尿白的发生[1, 2]。由于肾脏富含长链多不饱和脂肪酸,极易受到活性氧(reactive oxygen species,ROS)带来的损害,进而造成组织损伤[3]。我们前期的实验已经证明,一次性力竭运动后大鼠肾脏ROS、iNOS增加,导致ONOO-生成增多,进而SD蛋白nephrin表达下降,肾小球形态发生改变,毛细血管基底膜增厚变形,证明力竭运动通过氧化应激机制,导致肾脏组织结构损伤[4, 5]。肾脏组织中的ROS生成主要来源于NADPH氧化酶(Nox),Nox的两种亚型Nox2和Nox4在病理和生理状态下ROS的生成中发挥重要作用[5-7]。然而,目前关于Nox上游机制仍不清楚。有研究发现,PKC(蛋白激酶C)抑制剂或PKCδ抑制剂可使大鼠肾脏Nox的活性降低约80%[8]。PKC和Nox2抑制剂可以阻止电刺激诱导的骨骼肌中ROS的产生[5, 9]。PKC可能是调控nephrin表达关键的胞内信号,参与高糖诱导的nephrin丢失[10]。本研究采用大鼠跑台力竭运动模型,联合使用PKC抑制剂,研究PKC在过度运动对肾脏裂孔膜蛋白nephrin、podocin表达的影响中的调控作用,从PKC-Nox-ROS-SD途径阐明运动性尿蛋白的形成机制,对预防肾脏运动性氧化损伤和缓解运动性尿蛋白症状具有指导作用。
1 材料与方法
1.1 实验动物与运动方案
8周龄雄性SD大鼠30只,体重240~260 g(购于湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004),分笼饲养,每笼5只,自由饮水和饮食,自然光照,室温25℃±1℃;适应性饲养一周后随机分成3组,分别为对照组(C组),运动组(E组),运动联合PKC抑制剂组(EPI组),每组10只。C组大鼠静养,无运动;E组和EPI组大鼠进行3 d适应性跑台训练(ZH-PT跑台,淮北正华生物仪器设备有限公司),速度5 m/min,训练时间5~10 min;休息1 d后进行一次性力竭运动90~120 min。力竭运动方案跑速从5 m/min开始,每5 min增加5 m/min,匀加速最终速度保持在25 m/min直至大鼠力竭;运动过程中根据大鼠运动情况适当增加电刺激(1 mA以下)、光刺激和声音刺激,强迫大鼠运动。判断大鼠力竭标准为外界刺激不能使其继续运动,且四肢瘫软无力,双眼无神,翻转后无翻正反射等。EPI组大鼠运动前1 d及1 h分别进行腹腔注射PKC抑制剂白屈菜红碱(chelerythrine)(5 mg/kg),C组和E组注射相应体积生理盐水。
1.2 样品采集与处理
1.2.1 血液样本 大鼠力竭运动结束即刻腹腔注射10%水合氯醛水溶液(0.4 ml/100 g体重),待其昏迷、心跳变缓、掐后爪无反射反应后心脏取血:固定四肢,酒精擦拭腹部皮毛,沿胸腔解剖,暴露心脏,用5 ml无菌注射器自左心室取血,用于检测血糖、血尿素、血尿酸水平。
1.2.2 尿液样本 力竭运动结束后用5 ml无菌注射器于膀胱取尿液,用于检测尿蛋白、尿糖、尿酸水平。
1.2.3 肾组织样本 心脏取血后解剖腹腔,取左、右肾脏,在培养皿内去除多余组织,生理盐水洗净血迹,滤纸吸干水分后将肾组织放入样品管,立即投入液氮冷冻,样品采集结束后再转移至-80℃超低温冰箱保存、待测。
1.3 血液和尿液生化指标测定
尿蛋白采用考马斯亮蓝法(CBB法)测定;尿糖、血糖采用葡萄糖氧化酶-过氧化物酶法测定;尿酸、血清尿酸采用磷钨酸法测定;血尿素氮采用脲酶法测定(所用试剂及试剂盒均购自于南京建成生物科技公司)。
1.4 肾脏ROS生成检测
采用荧光探针法(DCFH-DA)检测肾脏组织ROS生成情况。具体操作流程如下:1)称取肾脏组织约0.5 g置于冰上剪碎,按10%(1 mg∶10 μl)的比例加入生理盐水,在匀浆管内以3 000 r/min进行冰上匀浆,后在4℃离心机内离心10 min,3 000 r/min,取上清液用于ROS测定。2)在96孔板的每孔中加入100 μg肾脏组织匀浆液,并加入100 μmol/L NADPH和10 μmol/L DCFH-DA,然后在其中一半孔中加入SOD(500 U/ml),对应的另一半孔中加同等量匀浆介质,恒温箱37℃孵育30 min,多功能酶标仪(QM40-NIR,奥地利)设定激发波长485 nm,发射波长528 nm,读取并记录OD值。3)用测试孔OD值减去SOD孔的OD值来计算,ROS水平;BCA法测定匀浆液蛋白浓度作为定量参考(DCFH-DA购于美国Sigma-aldrich生物公司,NADPH、SOD、BCA蛋白定量试剂盒购于碧云天生物技术研究所)。
1.5 肾脏PKC、Nox2、Nox4、nephrin、podocin蛋白表达检测
采用蛋白免疫印迹技术(Western blot)检测蛋白表达情况。称取肾组织约0.5 g置于冰上剪碎,按10%(1 mg∶10 μl)的比例加入PBS匀浆液(pH为7.4,5 mmol/L磷酸、250 mmol/L蔗糖、0.1 mmol/L EDTA、1 mmol/L PMSF和1 mmol/L DTT)。匀浆后,匀浆管以12 000 r/min,离心25 min,取上清液,使用BCA法测定蛋白浓度。Western blot测定肾脏相关蛋白表达,以GAPDH作为蛋白内参,具体步骤如下:1)配制10%~15% SDS-PAGE胶;2)加入蛋白样品及蛋白标准分子量marker,电压120 V电泳约1.5 h;3)固定电流300 mA在4℃缓冲液中转膜至PVDF膜约1 h;4)使用TBST配制5%脱脂牛奶封闭30 min;5)4℃过夜孵育一抗;6)用1%TBS-T溶液洗膜;7)室温下孵育二抗1 h;8)洗膜后ECL显色;9)扫描成像;10)运用ImageJ进行定量分析,以GAPDH为内参。一抗GAPDH购于杭州贤至,其余抗体均购于美国Santa Cruz生物公司:nephrin(F1019)、podocin(G2619)、Nox2(gp91-phox,K3018)、Nox4(L1019)、PKC(H2510)。HRP-羊抗小鼠二抗(BST13I07A50),HRP-羊抗兔二抗(BST13I07A54)购于博士德生物公司。
利用ImageJ6.0计算目的蛋白与内参蛋白条带灰度值,用目的蛋白条带灰度值与内参蛋白条带灰度值之比表示相对蛋白表达量。
1.6 统计学处理
2 结果
2.1 一次性力竭运动及PKC抑制剂对大鼠血尿素氮、血糖、血尿酸水平的影响
如表1所示:与C组相比, E组大鼠血尿素氮、血尿酸含量明显增高(P<0.01,P<0.05),血糖水平显著降低(P<0.01);与E组相比,EPI组大鼠血尿素氮明显降低(P<0.05),血糖含量显著增多(P< 0.01)。

Tab. 1 Blood urea nitrogen, blood glucose and blood uric acid levels (mmol/L, n=10)
2.2 一次性力竭运动及PKC抑制剂对大鼠尿蛋白、尿糖、尿酸水平的影响
如表2所示:与C组比,E组大鼠尿蛋白、尿糖、尿酸含量都明显增加(P<0.01);与E组相比,EPI组大鼠尿蛋白和尿糖水平明显降低(P<0.05)。
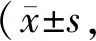
Tab. 2 Urine protein, urine sugar and uric acid levels n=10)
2.3 一次性力竭运动及PKC抑制剂对大鼠肾脏ROS水平的影响
如表3所示:与C组相比,E组大鼠肾脏ROS生成显著增多(P<0.01);与E组相比,EPI组大鼠肾脏ROS生成明显减少(P<0.01)。
2.4 一次性力竭运动及PKC抑制剂对大鼠肾脏PKC、Nox2、Nox4蛋白表达的影响
如表3、图1所示:与C组相比,E组大鼠肾脏PKC、Nox2、Nox4蛋白表达明显增加(P<0.05);与E组相比,EPI组PKC、Nox2蛋白表达显著降低(P<0.01)。

Fig. 1 Effects of one single bout of exhaustive exercise and PKC inhibitor on the protein expressions of PKC, Nox2 and Nox4 in kidney
2.5 一次性力竭运动及PKC抑制剂对大鼠肾脏nephrin、podocin蛋白表达的影响
如表3、图2所示:与C组相比,E组大鼠肾脏nephrin、podocin表达明显下降(P<0.05);与E组相比,EPI组nephrin、podocin蛋白表达显著增加(P<0.05,P<0.01)。

Tab. 3 The levels of ROS, PKC, Nox2, Nox4, podocin, Nephrin protein in n=10)

Fig. 2 Effects of one single bout of exhaustive exercise and PKC inhibitor on the protein expressions of podocin and nephrin in kidney
3 讨论
本研究通过建立一次性力竭运动大鼠模型,研究运动氧化应激条件下肾脏组织裂孔膜蛋白表达情况,主要发现:1)一次性力竭运动诱导大鼠运动性蛋白尿,该过程中肾脏裂孔膜蛋白nephrin、podocin蛋白表达水平降低;2)一次性力竭运动导致大鼠肾脏Nox源ROS生成增加、PKC蛋白表达增加,抑制PKC可通过Nox/ROS途径缓解运动性蛋白尿。
由运动引起的蛋白尿是体育训练中常见的生理现象,其临床表现与病理性蛋白尿具有相似的表现,运动后肾脏缺血/再灌注产生氧化应激反应,肾小球滤过系统遭到破坏,由此出现“类病理性”现象,主要表现在尿蛋白、尿酸、尿素氮等生化指标发生改变[11],其生理性主要表现为“一过性”。在运动实践中,运动性尿蛋白的产生是运动者身体疲劳的重要指标,如果症状严重,则可能是过度运动导致的肾脏损伤的后果。而延缓或者减轻此现象在一定程度上可帮助运动员提高运动表现,延缓肾脏机能失调,避免运动员在疲劳状态下出现运动损伤。运动性尿蛋白在临床上的表现与肾脏疾病早期症状相似,因此对于运动性尿蛋白形成机制的研究可能为病理性尿蛋白的研究提供思路。
有研究指出,尿酸可以作为抗氧化剂,被ROS氧化成尿囊素。因此运动产生过量ROS的同时,也有大量尿酸可用于抗氧化[12]。本研究中大鼠在力竭运动后,尿酸水平明显增高。PKC抑制剂组大鼠运动后尿液尿酸水平无明显降低,推测可能是由于PKC抑制剂抑制ROS过量产生,而尿酸在抗氧化中没有过多的可用性,因此在尿液检测中出现大量尿酸。尿素氮是反映运动负荷和身体机能状况的有效指标。运动负荷过大可导致机体尿素排泄率降低,体内潴留的非蛋白氮增多,血尿素氮含量增加[13]。尿蛋白与尿糖排泄量反映肾脏滤过系统的改变程度,在足细胞损伤,裂孔膜结构异常时增高,出现尿蛋白与尿糖现象。有研究发现,nephrin表达降低导致小鼠足细胞中NF-κB表达上调,进而发生肾小球硬化和蛋白尿[14]。大强度运动后发生蛋白尿提示可能是裂孔膜蛋白表达下降所致。本研究发现,一次性力竭运动导致裂孔膜蛋白nephrin和podocin表达同时降低,且肾脏ROS生成水平明显提高,提示运动刺激肾脏发生氧化应激,导致肾脏功能发生改变。Nephrin、podocin在SD中高度表达,这些跨膜蛋白的表达降低可能会直接导致白蛋白透过肾小球进入尿液[15]。在大负荷导致大鼠运动性蛋白尿的研究中指出运动性蛋白尿发生的同时裂孔膜蛋白表达持续降低[16]。本实验室前期的肾脏实验中报道了关于力竭运动对大鼠肾脏的影响,结果均呈现一致性[4, 5]。也有研究指出,血浆晚期蛋白氧化产物(AOPPs)的积累通过激活ROS依赖的p38 MAPK降低足细胞裂孔膜蛋白nephrin和podocin的表达,导致蛋白尿发生[17]。
ROS生产与抗氧化系统之间的不平衡会诱发氧化应激,Nox是已知主要产生ROS的功能酶[18]。有研究表明,肾皮质中ROS生成的主要来源是Nox[19]。Hiroshi Kono等人指出在敲除Nox的小鼠中,ROS的生成不再增多[20]。本研究结果显示,PKC抑制剂的干预降低肾脏Nox2表达,而Nox4表达无明显下降,说明PKC并不直接介导运动导致的骨骼肌Nox4的蛋白表达。小鼠实验中,夹竹桃素对Nox的慢性干预通过降低ROS生成下调nephrin和podocin蛋白表达,减少尿蛋白含量[17]。Günnur Kocer 等人的研究表明力竭运动引起的Nox活性增加是运动过程中氧化应激水平升高的重要来源,是导致运动后蛋白尿发生的原因之一[21]。本实验研究显示,一次性力竭运动刺激Nox源ROS水平增加,PKC抑制剂阻止了这一现象,说明PKC可能参与蛋白尿形成的上游调节机制。本研究还发现一次性力竭运动增强肾脏Nox2和Nox4 蛋白表达,PKC抑制剂可有效抑制Nox2的表达上调,提示高强度运动刺激肾脏氧化应激机制可能是通过PKC/Nox2途径实现的。谢文杰等人指出高强度游泳训练可通过上调PKCδ蛋白表达及磷酸化水平导致心肌ROS过量生成[22]。刘姣等人通过建立一次性力竭运动模型,发现PKC可通过Nox2调控大鼠骨骼肌中ROS产生[23]。有研究指出高糖水平和游离脂肪酸刺激二酰基甘油(DAG)-PKC通路,进而通过PKC依赖的Nox激活刺激ROS的生成[24]。J.Menne等人在糖尿病肾病的实验中指出高糖条件下小鼠肾小球裂孔膜蛋白nephrin表达明显减低,而podocin和CD2AP的表达保持不变,在阻断PKC-α的小鼠中nephrin表达保持不变,证明抑制小鼠体内PKC-α的信号通路可以减少肾脏中nephrin的丢失,同时对蛋白尿的发生有抑制作用,本研究得出一致结果[25]。
综上所述,一次性力竭运动应激激活Nox/ROS信号途径,造成肾脏裂孔膜蛋白nephrin和poodocin表达下降引发运动性蛋白尿;PKC作为Nox上游调控因子,抑制其表达可作用于Nox/ROS途径缓解运动性蛋白尿发生。氧化应激机制在运动性肾脏损伤研究中已有大量文献支持,本研究在此基础上,重点关注氧化应激的上游分子PKC,研究PKC抑制剂对于nephrin和poodocin蛋白表达的影响,为进一步探讨肾脏氧化应激信号通路提供新的思路。鉴于PKC有几种分型,未来有必要深入研究不同PKC分型对Nox的作用以及PKC调节Nox不同分型的具体机制,同时PKC的上游激活机制也是未来研究关注的焦点之一。

