循环肿瘤细胞对非小细胞肺癌患者预后评估的Meta分析
李明珍,何韶华,靳英辉,,陈 成,阎思宇,王永博,刘 欢,周治清,肖 涵,杨瑞瑞,谭力铭
1. 怀化市第二人民医院精准医学中心(湖南怀化 418000)
2. 武汉大学中南医院循证与转化医学中心(武汉 430071)
3. 怀化市第二人民医院胸部肿瘤内科(湖南怀化 418000)
4. 怀化市第二人民医院消化肿瘤内科(湖南怀化 418000)
5. 怀化市第二人民医院临床药学部(湖南怀化 418000)
肺癌是全球发病率及死亡率最高的恶性肿瘤之一[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌的75%~80%,治疗后复发转移是患者死亡的主要原因[2]。尽管肺癌治疗方法取得了长足进步,NSCLC患者根治性手术后复发率仍高达30%~70%,5年总体生存率低于20%[3-4]。目前尚未发现更好的临床生物标志物能预测NSCLC复发高危人群[5]。循环肿瘤细胞(circulating tumor cells,CTCs)是原发肿瘤或转移灶脱落后释放入外周血液循环的肿瘤细胞[6]。CTCs检测属于液体活检技术,具有非侵入性的优点,可识别术后疾病进展的高风险患者,纵向监测疾病进展和治疗反应[7]。目前认为肿瘤复发或转移可能与进入外周血的CTCs有关[8],多项研究显示CTCs检测可评估直肠癌、乳腺癌及食管癌等肿瘤的预后[9-11],但其在监测肺癌发生发展及预后评估方面的效果尚存争议。本研究旨在对CTCs在NSCLC患者中的预后价值进行系统评价与Meta分析,以期为相关临床应用提供参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准:①研究类型为队列研究;②研究对象为病理确诊的NSCLC患者,肿瘤分期不限;③暴露的测量时间为初始治疗前一周内检测其外周血基线CTCs水平;④结局指标包括无进展生存期(progression-free survival,PFS)和(或)总生存期(overall survival,OS);⑤统计分析方法采用多变量Cox回归分析,基线CTCs水平作为其中的协变量,且报告其风险比(HR)值及95%CI,或有充足数据可以计算HR值及95%CI。
排除标准:①病例总数低于20例;②无法获取或无法转换数据的研究;③非中英文文献。
1.2 文献检索策略
计算机检索中国知网、万方、中国生物医学文献服务系统、维普、PubMed、Web of Science、The Cochrane Library、Embase数据库,收集检测NSCLC患者基线CTCs水平的相关研究,检索时限为建库至2021年9月28日。中文检索词为循环肿瘤细胞、非小细胞肺癌、预后等;英文检索词为circulating tumor cell、NSCLC、prognosis等。采用主题词与自由词结合的方式进行检索,同时辅以手工检索和文献追溯法收集相关文献。以PubMed为例,具体检索策略见框1。

框1 PubMed检索策略Box 1. Search strategy in PubMed
1.3 文献筛选、资料提取与文献质量评价
由2名研究者独立筛选文献、提取资料,并交叉核对,如遇分歧,则通过讨论或由第三方解决。文献筛选时首先阅读文题和摘要,在排除明显不相关的文献后,进一步阅读全文,以确定最终是否纳入。资料提取内容包括:①纳入研究的基本信息,包括第一作者、样本量、CTCs检测方法、CTCs截断值等,以研究中设定的截断值定义CTCs水平,截断值及以上为高水平,反之为低水平;②文献质量评价的相关要素;③结局指标和多因素分析结果。文献质量评价采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)评分,总分为9分,分数越高,文献质量越高[12]。
1.4 统计学分析
采用RevMan 5.3和Stata 15.0软件进行统计分析。采用倒方差法对多因素Cox模型中OS及PFS的HR值及95%CI进行数据处理,对于只提供HR值,未提供置信区间或标准差,并且通过其他途径也无法获取数据的文献,则不进行定量合成;对于未提供HR值,但有充足数据可以计算的,则通过公式换算得到近似估计HR值及置信区间;对于只提供生存曲线的研究,则参考其他方法获取估算的HR值及置信区间[13]。如在同一研究中有多个多因素Cox模型,则选取调整因素最多的模型纳入研究。通过Q检验和I2检验进行异质性检验,若I2≤50%,P≥0.1,采用固定效应模型合并HR值,反之,则采用随机效应模型。对异质性来源进行分析,按CTCs检测方法、肿瘤分期及CTCs截断值进行亚组分析。对纳入研究绘制漏斗图及进行Egger检验评估发表偏倚,P<0.05表示存在发表偏倚。
2 结果
2.1 文献筛选流程及结果
初检获得相关文献2 267篇,经逐层筛选,最终纳入19项研究,其中中文5篇,英文14篇。文献筛选流程及结果见图1。
2.2 纳入文献基本特征
19项研究共包括1 853例患者。其中10项研究采用CellSearch法检测CTCs,13项研究仅纳入了肿瘤分期为III/IV期的患者,18项研究NOS质量评价≥7分,纳入研究的基本特征和文献质量评价见表1。
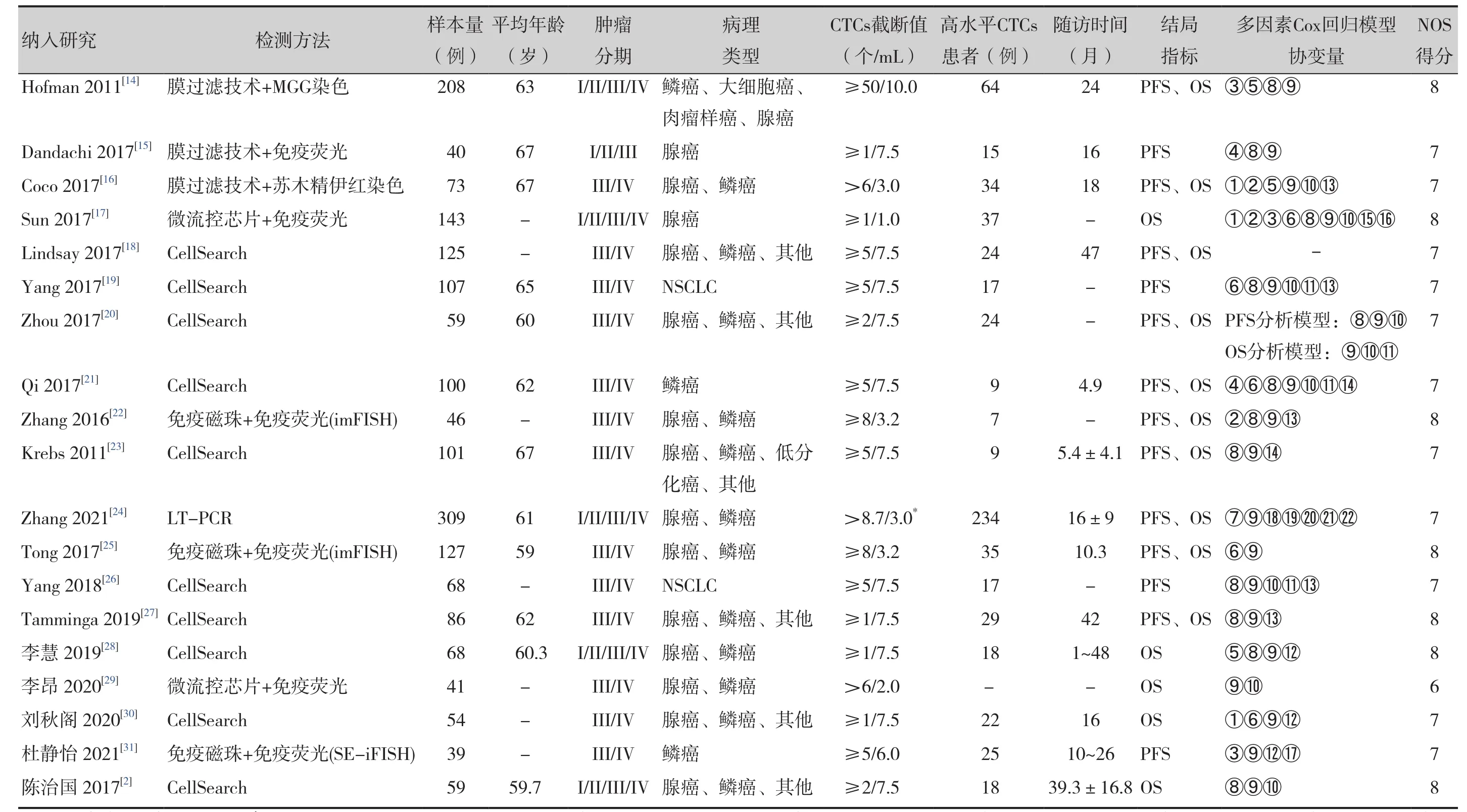
表1 纳入文献的一般特征Table 1. Basic characteristics of theincludedstudies
2.3 Meta分析结果
2.3.1 CTCs与PFS的相关性
14项研究报道了CTCs与NSCLC患者PFS的相关性[14-16,18-27,31]。Meta分析结果显示,与低水平CTCs患者相比,高水平患者在PFS方面预后更差 [HR=2.49, 95%CI(1.50,4.13),P=0.0004],同时纳入研究的异质性较高(P< 0.001,I2=86%)(图2-A)。按CTCs检测方法、肿瘤分期、CTCs截断值进行亚组分析,结果尚未发现异质性来源,详见图2。按CTCs检测方法进行亚组分析,结果显示,采用CellSearch检测方法的高水平CTCs患者较低水平患者在PFS方面预后更差[HR=3.51,95%CI(1.55,7.95),P<0.05](图2-B)。按肿瘤分期、CTCs截断值的亚组分析结果显示,除截断值≥8个/3.2 mL组外,其他各亚组均显示高水平CTCs组较低水平患者在PFS方面预后更差(图2-C、图2-D)。
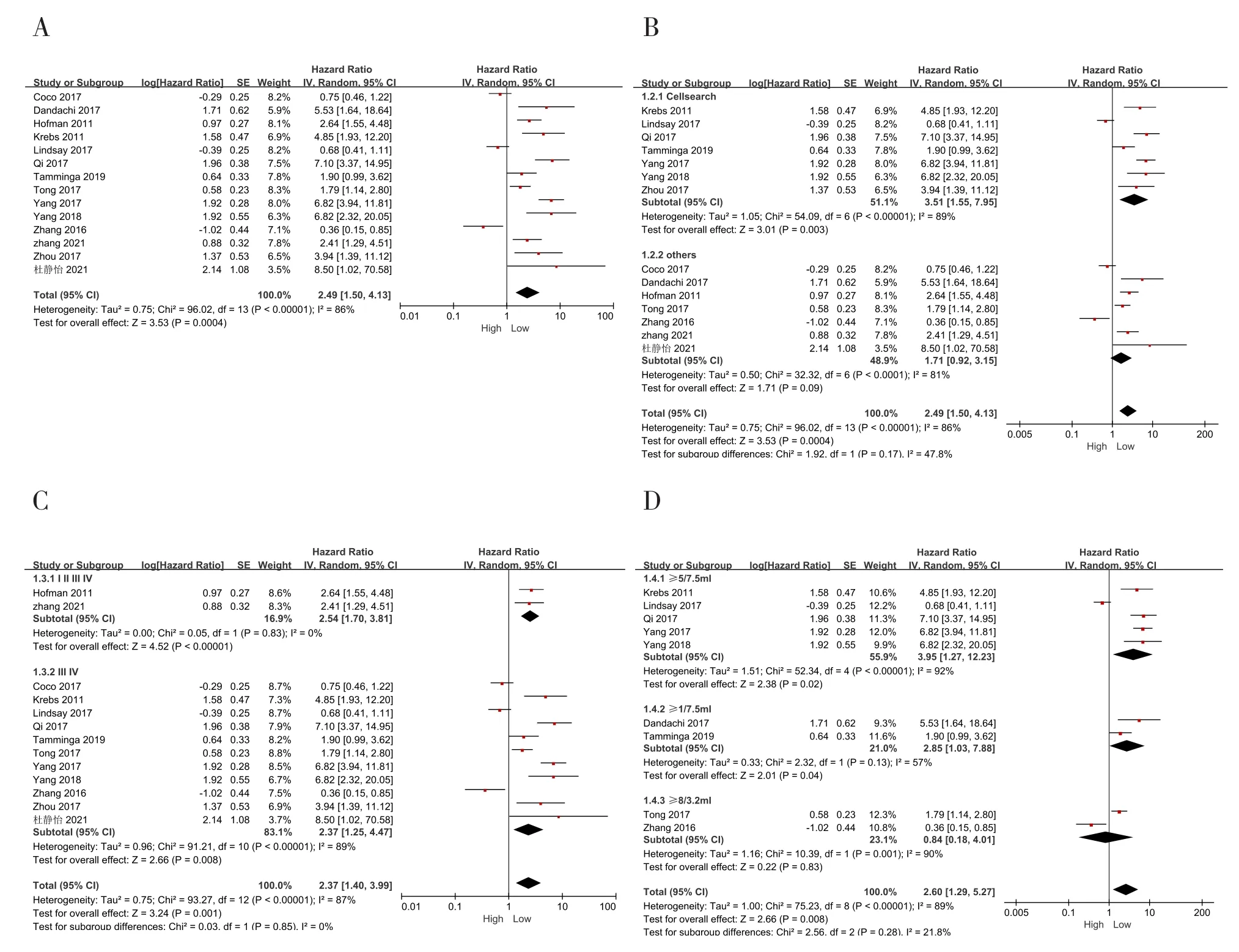
图2 CTCs与PFS的相关性Figure 2. Correlation between CTCs and PFS
2.3.2 CTCs与OS的相关性
15项研究报道了CTCs与NSCLC患者OS的相关性[2,14,16-18,20-25,27-30]。Meta分析结果显示,NSCLC患者的CTCs水平与其OS无显著相关性[HR=1.18, 95%CI(0.70,1.99),P=0.54],同时纳入研究的异质性较高(P<0.001,I2=89%),见图3-A。按CTCs检测方法、肿瘤分期、CTCs截断值进行亚组分析,结果尚未发现异质性来源,各亚组均显示高水平CTCs对OS并没有显著的预测能力(图3-B、图3-C、图3-D)。
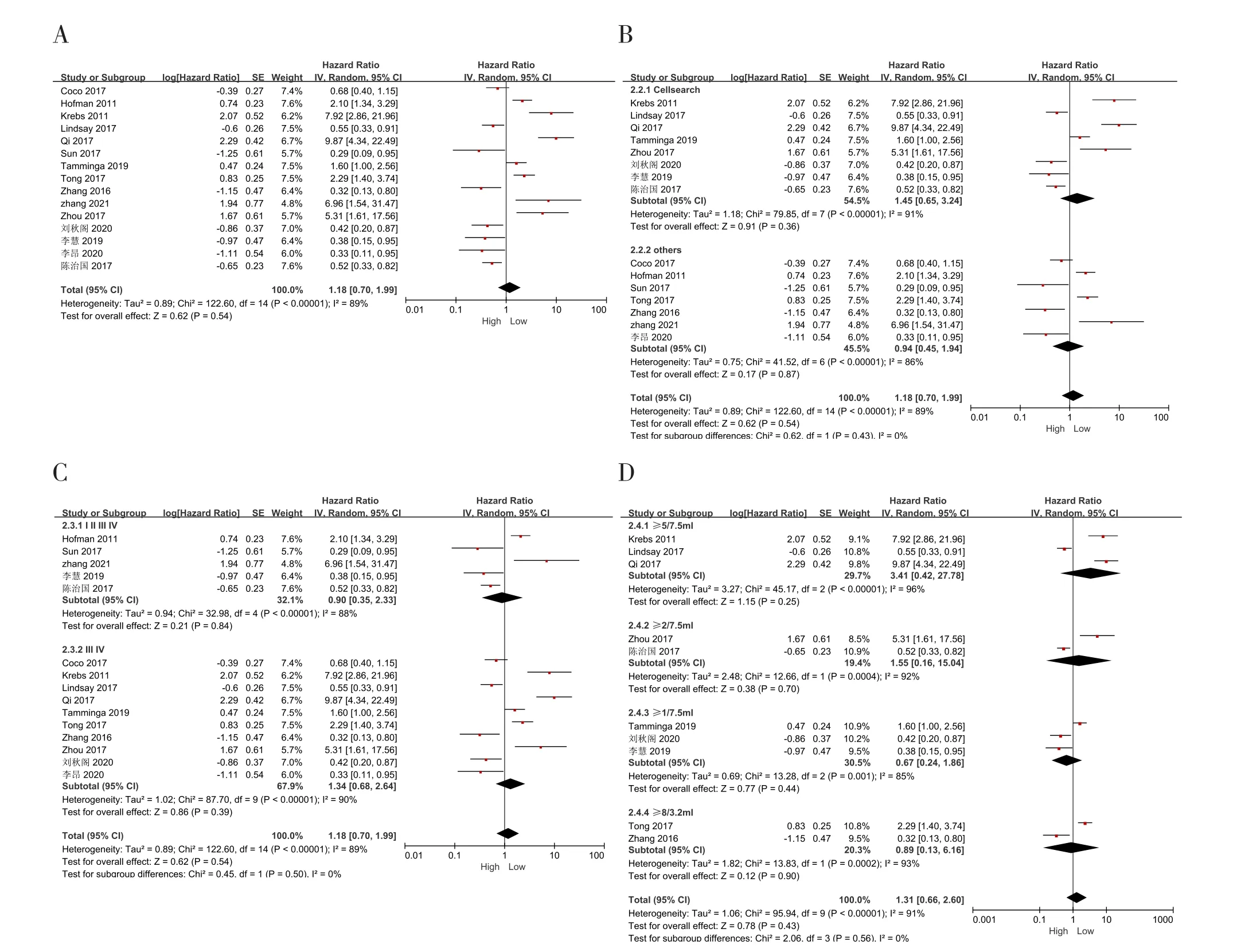
图3 CTCs与OS的相关性Figure 3. Correlation between CTCs and OS
2.4 发表偏倚
针对PFS和OS研究的漏斗图显示,散点分布大体对称,且Egger检验P值分别为0.163、0.775,提示存在发表偏倚的可能性较小。详见图4。
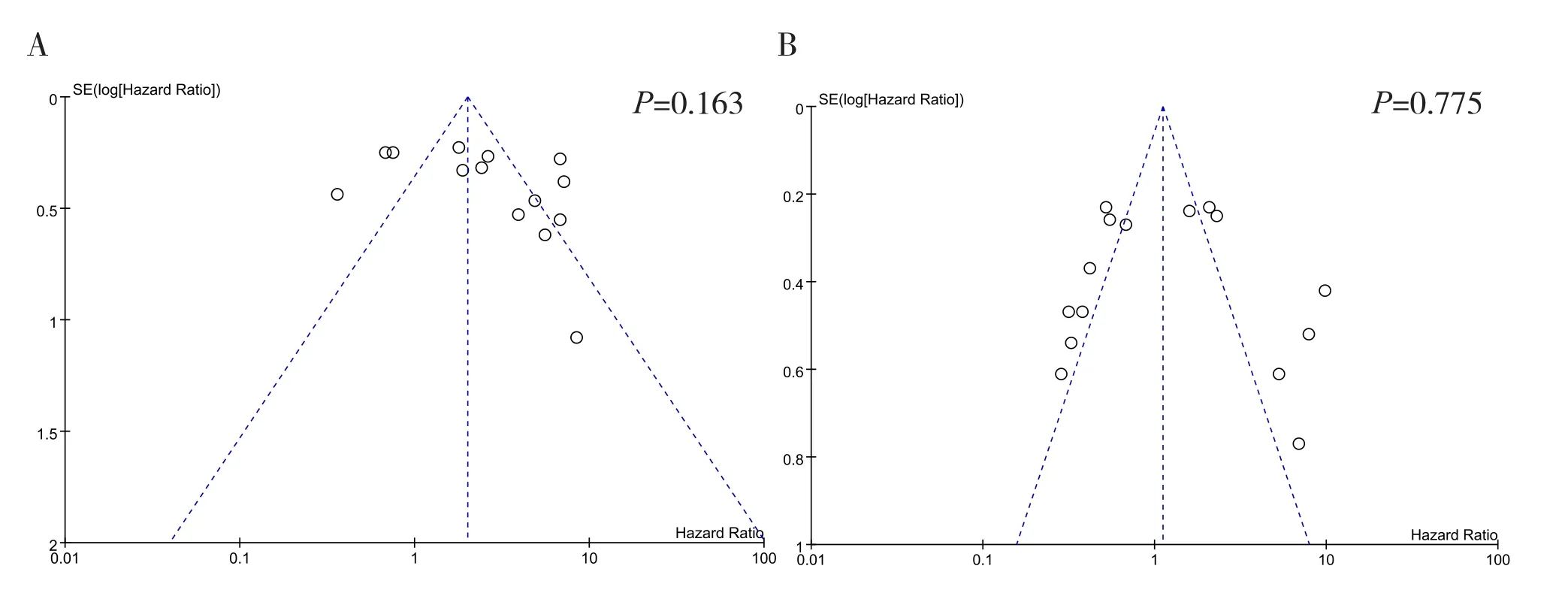
图4 发表偏倚漏斗图Figure 4. Funnel plot verifies publication bias of studies
3 讨论
NSCLC患者行根治性手术后5年复发率高达25%~50%,其复发以全身转移为主,局部复发并不多见[32]。目前对于肺癌疗效的评价指标普遍采用依赖CT检测的RECIST评价标准,但对疗效判定存在一定的滞后性[31]。近年来,随着分子诊断及靶向治疗的发展,肿瘤特异性的基因组和表观遗传学改变通常通过手术或活检来识别[4]。由于时间和空间的异质性,基于组织的分子信息检测也存在不及时、不便利的局限性[33]。与传统的组织活检相比,液体活检具有微创性、全面性及动态监测等优点[33],且更能反映患者远处转移的真实情况。CTCs检测作为液体活检的重要分支,对肿瘤患者的疗效、预后以及个体化治疗等有重要的指导作用。
目前,CTCs的检测技术包括CellSearch系统、膜过滤技术、AdnaTest系统、配体靶向PCR法(ligand-targeted PCR method,LT-PCR)等方法。其中LT-PCR是中国唯一获批的肺癌CTCs检测技术,CellSearch系统则在美国获批用于临床 CTCs 的检测[34]。尽管有研究证实NSCLC患者术后CTCs的检出率约为49%[14],但不同检测方法的局限性依然对CTCs检测造成了较大的困难。因此可能需要更多的研究进行联合检测来提高CTCs的特异性及敏感性。此外,美国食品药品监督管理局批准了CellSearch法用于乳腺癌的推荐截断值,但未推荐用于肺癌的截断值[8]。目前,国际上对肺癌CTCs阳性判断标准并不统一,尚需大样本、多中心的研究予以证实[34]。
肿瘤细胞的血行播散是肿瘤出现远处转移的主要原因[35]。原发灶肿瘤细胞在合适的微环境下发生上皮-间质转化,导致细胞间黏附能力减弱、迁移和侵袭能力增强,脱离原发灶后进入外周血循环形成CTCs[36]。有研究发现上皮-间质转化和肿瘤播散入血早于肿瘤转移病灶形成,因此在影像学可检测的实体病灶形成之前进行高危人群 CTCs 检测对早期肺癌的筛查具有重要的预测作用[37]。CTCs水平可以反映肿瘤负荷和生物侵袭性[38]。CTCs检测在恶性肿瘤预后中的潜力已在多项研究中得到证实[9-11]。Ried等研究发现,Ⅰ期肿瘤患者外周血中CTCs数量小于3 个/mL,Ⅱ~Ⅲ期患者CTCs计数为3~20 个/mL,Ⅳ期患者CTCs计数大于20 个/mL[39],提示CTCs水平与肿瘤分期可能存在相关性。患者经过放化疗、靶向治疗或根治性手术后监测血液中的CTCs水平也可以在一定程度上反映手术和药物治疗的疗效,CTCs计数减少时意味着患者对该治疗方案反应良好,反之则可能出现了耐药性或肿瘤进展[36]。本研究显示CTCs检测对NSCLC患者的PFS具有较显著的预测作用,这与Jiang等Meta分析结果一致[8]。杜静怡等研究也证实了患者基线CTCs计数与PFS相关,且在多因素Cox分析中基线CTCs计数是影响患者PFS的独立因素[31]。在亚组分析中,仅其他CTCs检测方法及截断值≥8个/3.2mL组的结果显示基线CTCs水平对PFS无显著预测作用,这可能是由于不同CTCs检测方法的特异性及敏感性存在差异。此外,虽然纳入研究的数据显示CTCs计数越多,NSCLC患者的OS越短,但本研究中的结果显示基线CTCs 水平对OS无显著预测能力,这可能是由于人口学特征及临床混杂因素对患者的OS 影响较大,如年龄、身体状况及治疗依从性等。
本研究尚存一定的局限性:①不同CTCs检测方法的特异性及敏感性可能会导致偏倚,且CTCs阳性判断标准(截断值)也尚未统一,未来需进一步规范;②受限于纳入研究数量,无法对病理分型、随访时长等对结果的影响展开分析,且各研究多因素Cox回归模型也存在不一致性,不同研究之间可能存在潜在偏倚;③当前纳入研究缺乏长期随访数据,CTCs对长期结局的预后作用仍需未来研究的证据支持。
综上所述,本研究显示CTCs高水平组NSCLC患者相较低水平组患者的PFS更差,差异达到统计学意义,亚组分析结果表明无论肿瘤分期早晚,CTCs高水平组相较低水平组患者的PFS更差,但CTCs水平与OS的相关性并不显著。外周血CTCs监测已被证明可早于影像学检查检测出肿瘤发生发展,但基于CTCs结果的早期干预能否让患者真正获益尚不明确。CTCs可作为早期识别患者潜在转移灶的辅助指标,有助于评估NSCLC患者疗效及预后。然而,更重要的是标准化的液体活检技术需要在未来得到证实,以及需要更多的前瞻性研究来验证CTCs技术预测肿瘤复发的适用性及经济性,从而增加CTCs的临床效用。

