富硒乳酸菌的筛选及富硒发酵乳抗氧化活性研究
李理,朱珺,林国栋,陈苏,陈丽娥,陈作国
(杭州娃哈哈集团有限公司 杭州娃哈哈科技有限公司浙江省食品生物工程重点实验室,杭州 310018)
0 引 言
硒是人体必需的14 种微量元素之一,动物和人体内不能合成,必须通过饮食获得。1957 年首次认识到硒对营养性肝坏死的保护作用后[1],其抗氧化、抗癌、保护心脏、提高机体免疫力、防治近视以及白内障、解毒、延缓衰老、增强生殖功能等多种生物活性和药理作用被相继报道,被誉为“生命火种”、“心脏的守护神”和“抗癌之王”[2-3]。我国约2/3 的地区近7 亿人口处于缺硒的状态[4]。与我国硒摄取的实际状况相结合,1988 年中国营养家学会将微量元素硒列入我们每日必须摄入的15 种膳食营养素之中。为了保证人体日均生理补硒的安全性,我国对富硒食品中硒的限量也有严格的要求,《食品安全国家标准-食品营养强化剂使用标准》GB14880-2012 中对大米、小麦粉、面包、饼干、含乳饮料中硒的使用量进行了限制,其中含乳饮料中硒的使用量为50~200 μg/kg。
大量研究表明,硒元素在人体内的吸收、代谢以及生物功效的发挥,与其形态有着紧密的联系[5]。一般而言,无机硒的水溶性高,毒性最大,生物利用率低;有机硒毒性较无机硒小,可以与功能性大分子物质的结合,能够在抗氧化、抗肿瘤等生物活性方面产生协同效应,且生物利用率高,能够满足人体多样化的营养需求[6];纳米硒毒性最小,易于被人体吸收且能够发挥无机硒和有机硒所共有的功能性质[7]。目前硒的富集方法主要有植物富集法、动物富集法和微生物富集法[4]。采用微生物转化富集到的有机硒与天然食物的有机硒的组成相似,如硒代半胱氨酸、硒代蛋氨酸等,既可提高硒的生理活性,又可降低其毒性,有利于机体吸收[6,8]。
近年来,许多研究报道了乳酸菌可以将无机硒转化成有机硒[9-11]。考虑到有机硒和乳酸菌均具有一定的生物活性,对人体健康和人体营养需求的重要作用,在饮食中添加硒,尤其是富硒的发酵食品和含硒的膳食补充剂,已经受到广泛重视和认可。本研究以32 株乳酸菌为材料,通过检测对亚硒酸钠的耐受性和转化能力来筛选富硒性能优良的菌株,再通过优化菌株发酵性能、亚硒酸钠添加量、亚硒酸钠添加方式等,确定富硒发酵乳的最佳制备工艺,最后检测抗氧化活性的相关指标,评价富硒发酵乳的抗氧化活性,以期为富硒发酵食品的开发提供原料和依据。
1 材料与方法
1.1 材料与仪器
32 株乳酸菌,由浙江省食品生物工程重点实验室自主分离得到,其中菌株4030、4394、4187 分离自贵州发酵蔬菜,菌株4115 分离自贵州米酒,菌株4246、4446 分离自贵州腌肉糟,菌株823 分离自内蒙古发酵酸牛奶,菌株815、918 分离自青海发酵酸牛奶,菌株1577、1602、1774、1818、1610 分离自西藏传统发酵酸牛奶、菌株1800 分离自西藏青稞酒曲、菌株1636、1595、3888 分离自西藏乳扇,菌株1626、1643 分离自西藏酥油,菌株3471 分离自新疆发酵酸马奶,菌株2538、3708、2518、3816、3824 分离自新疆发酵酸牛奶,菌株3788、3828、3832 分离自新疆奶疙瘩,菌株3379分离自新疆酥油;MRS 肉汤、技术琼脂粉,广东环凯微生物科技有限公司;M17 肉汤,青岛海博生物技术有限公司;脱脂乳粉,恒天然(中国)有限公司;细菌/细胞总DNA 提取试剂盒,北京天根生化科技有限公司;亚硒酸钠,Sigma 生物试剂有限公司;1,1-二苯肼-2-三硝基苯肼(DPPH),上海麦克林生化试剂有限公司;过氧化氢、甘油、氯化钠、硝酸、盐酸、高氯酸、氢氧化钠、硼氢化钠、铁氰化钾、亮绿、硫酸亚铁、无水乙醇,均为国产分析纯试剂。
SG604 生物安全柜,美国Baker 公司;OptimaTMXPN 超速离心机,美国贝克曼库尔特有限公司;DNP-111 电热恒温培养箱,上海海向仪器的设备厂;DU800 紫外分光光度计,美国Beckman 公司;AFS9330 原子荧光光谱仪(配硒空心阴极灯),北京吉天仪器有限公司;分析天平、Delta320pH 计,瑞士梅特勒-托利多有限公司;MSH-R-O3P 数显加热型磁力搅拌器,澳大利亚KEWLAB 公司;HH-US 恒温水浴锅,上海赫田科学仪器有限公司;7000 PCR 扩增仪,美国Applied Bio Systems 公司;KQ-300GVDV 双频恒温超声清洗破碎仪,昆山舒美超声仪器有限公司。
1.2 实验方法
1.2.1 菌株的分离纯化、鉴定和保藏
采用平板划线法分离纯化,得到的单菌落转接至液体培养基中扩大培养,菌液进行革兰氏染色、镜检和H2O2酶试验,初步鉴定为乳酸菌后,再进行16S rDNA测序鉴定。
取适量菌株纯化后的培养物,离心弃上清后用细菌/细胞总DNA 试剂盒提取DNA,选择乳酸菌通用引物27F 和1492R 对菌株的16S rDNA 片段进行扩增。PCR 产物寄送至苏州金唯智生物科技有限公司测序。测序结果进行BLAST 比对,确定菌株种属。经鉴定后的菌株纯培养物连续传代2 次后,获得的菌液加甘油作为保护剂,-80 ℃保存。
1.2.2 菌株活化
将甘油管中保存的菌液在无菌条件下分别接种至MRS/M17 液体培养基中,37 ℃培养12~24 h,活化2~3 代后即可供菌株筛选使用。
1.2.3 富硒乳酸菌的筛选
将活化的菌液按3%比例接种至含有亚硒酸钠(15 mg/L)的MRS/M17 液体培养基中,37 ℃培养至大约对数生长期(10~12 h),分光光度计测600 nm 处的吸光值,3 次平行试验。取10 mL 培养至对数期的菌液,12 000 rpm 离心10 min 后,上清液过0.22 μm 针头式水系滤膜以完全除去菌体。按《食品安全国家标准 食品中硒的测定》GB5009.93-2017 中第一法氢化物原子荧光光谱法分别检测培养基中和菌上清中的总硒含量,根据检测结果,计算各菌株的硒转化率。
硒转化率=(培养基中硒含量-上清中硒含量)/培养基中硒含量×100%
1.2.4 富硒乳酸菌发酵性能评价
将筛选得到的富硒性能较优的菌株按接种量为3×106CFU/mL 分别接种至10%脱脂乳+3%蔗糖中,40 ℃培养12 h,每隔1 h 测定pH 值,3 次平行试验。以培养时间为横坐标,以pH 值为纵坐标,绘制生产酸曲线。发酵结束后,取终点样品测定发酵乳中乙醛、双乙酰含量,并进行感官评价。其中乙醛和双乙酰含量测定方法参考文献[12],感官评价方法参考文献[13]。
1.2.5 适宜亚硒酸钠浓度的确定
根据《食品安全国家标准-食品营养强化剂使用标准》GB14880-2012 中对乳饮料中硒含量的要求,分别配置含亚硒酸钠质量浓度为50、75、100、125、150、200 μg/L 的发酵基料,菌株按3×106CFU/mL 接种至发酵基料中,40 ℃培养至pH 值接近4.6,观察发酵乳颜色,同时测定硒转化率,确定最适加硒量。
1.2.6 发酵乳中硒含量的测定
发酵乳中总硒含量测定采用《食品安全国家标准食品中硒的测定》GB5009.93-2017 中第一法氢化物原子荧光光谱法进行。发酵乳中无机硒含量检测如下:准确移取试样30.00 mL(精确到0.01 mL)于100 mL 小烧杯中,加热浓缩值5 mL 以下,转移至10 mL 离心管中,纯水定容值10 mL,涡旋混匀,超声10 min 后,于80~90 ℃水浴振荡提取1 h,其间每隔20 min 取出上下颠倒,使样品充分混匀,水浴结束后,再使用超声提取20 min。提取完毕,冷却至室温,以8 000 rpm 离心15 min。取上层清液,用NaOH 溶液(5 g/L)调节pH值至4~7后,经0.22 μm 针头式有机过滤膜过滤,滤液采用GB5009.93-2017 中第一法进行硒含量检测。
1.2.7 富硒发酵乳的制备
准确称取100.0 g 脱脂乳粉、30.0 g 白砂糖、870.0 g饮用水混合均匀,预热至70 ℃、20 MPa 均质,105 ℃杀菌10 min,冷却至40 ℃左右。优选菌株按3×106CFU/mL的量接种至含有亚硒酸钠的发酵基料中,40 ℃发酵至pH 值4.6 左右,破乳终止发酵,冷却至10 ℃,无菌分装,得到富硒发酵乳。
1.2.8 富硒发酵乳抗氧化活性的测定
按1.2.7 所述制备富硒发酵乳,同时制备原料乳中不添加亚硒酸钠发酵的无硒发酵乳和原料乳中添加亚硒酸钠,但不经菌株发酵的无机硒乳,参考许牡丹等人[14]方法,并作适当改进,比较3 种乳样品的抗氧化活性。
1.2.8.1 羟自由基清除能力测定
取1.0 mL 1,10-邻菲罗啉溶液(6 mmol/L)与2.0 mL PBS 溶液混合,再加入1.0 mL 硫酸亚铁溶液(6 mmol/L),立即混匀。准确加入1.0 mL 乳样品后加入1.0 mL 过氧化氢溶液(0.1%)和无菌水,反应总体积为8.0 mL。混合好的溶液37 ℃孵育1 h 后,于536 nm 处测定吸光值。羟自由基清除率=(As-Ac)/(Ab-Ac)×100%,式中:As为样品组吸光值;Ac为对照组吸光值(包括邻菲罗啉、PBS、硫酸亚铁和过氧化氢);Ab为空白组吸光值(包括邻菲罗啉、PBS 和硫酸亚铁)。
1.2.8.2 DPPH 自由基清除能力测定
用无水乙醇配置0.2 mmol/L 的DPPH 溶液。1 mL DPPH 乙醇溶液与1 mL 乳样品充分混匀,避光室温反应30 min,于517 nm 处测定吸光值,记为As,以等体积无水乙醇替换DPPH 溶液测量吸光值,记为Ab,以等体积蒸馏水替换样品测量吸光值,记为Ac。
DPPH 自由基清除率= [1-(As-Ab)/Ac] ×100%
1.2.8.3 超氧阴离子自由基清除率
取0.1 mL 乳样品于4.5 mL 的Tris-HCl 缓冲溶液(50 mmol/L,pH=8.0)混合,25 ℃水浴20 min 后,加入0.4 mL 邻苯三酚溶液(以HCl 为溶剂配置成25 mmol/L),25 ℃水浴反应5 min,立即用2 滴HCl 溶液(8 mmol/L)终止反应,于325 nm 处测吸光值,记为As,用无菌水调零,无菌水代替样品测得的吸光值,记为A0。
超氧阴离子自由基清除率=(A0-As)/ A0×100%
1.2.9 统计分析
测定指标均表示为3 次平行试验的平均值±标准偏差。显著性分析采用SPSS 17.0 软件中的Duncan’s多重比较检验法进行分析,显著水平设置为0.05。
2 结果与分析
2.1 菌株的16S 鉴定结果
将分离得到的32 株菌的测序结果在GenBank 的BLAST 数据库中比对核苷酸序列的同源性,同源性在98%以上认为是同一种属。鉴定结果如表1 所示,32 株菌均为乳酸菌。

表1 菌株16S rDNA 鉴定结果
2.2 富硒菌株的筛选
32 株乳酸菌在亚硒酸钠添加量为15 mg/L 的MRS/M17 液体培养基上菌体生长情况如图1 所示。由图1 可知,与未加硒培养的对照组相比,菌株1577、1818、1643、2518、3816、3824、3832、4030、4115、3728、1800、3471 的生长明显受到抑制,OD 值下降显著(P<0.05),菌株1602、1774、981、1595、1626、3473、4187 的生长抑制更加明显,OD 值下降极显著(P<0.01),其余13 株菌的OD 值变化不明显,说明在添加15 mg/L 的亚硒酸钠后菌株的生长没有受到明显的影响,具有良好的硒耐受性,本研究中菌株硒耐受性的测试结果与韦梦婷等人[11]的研究结果相似。

图1 菌株硒耐受性筛选
对硒耐受性良好的菌株培养液上清中的硒含量进行测定,并计算各菌株的富硒率,结果如表2 所示。由表可知,在含15 mg/L 的亚硒酸钠的培养基中菌株的富硒性能差别明显,菌株1610 的富硒率最高为81.1%,菌株3888、815、3379 的富硒率在70.00%~80.00%,菌株823、1636、2538、3708、4246 的富硒率在60.00%~70.00%,菌 株4394、4446、3788、3828 的 富 硒 率 在50.00%以下,其中菌株3828 的富硒率最低为27.87%。韦梦婷等人[11]的研究中指出,经过优化后部分乳酸菌菌株的富硒率提高至70%以上,且菌株的富硒率最高可达到81.80%,与本文研究筛选结果较为一致,因此我们筛选富硒率70%以上的菌株,分别为菌株1610、3888、815、3379 进行发酵性能的评价,以便获得兼具优良富硒性能和发酵性能的菌株。

表2 耐受菌株的硒富集情况
2.3 富硒菌株的发酵性能
菌株的产酸速率、后酸稳定性以及产生乙醛、双乙酰的量是评价其发酵性能的重要指标。由图2 可知,菌株3888 和3379 的产酸速率适中,但pH 值达到4.5 左右后继续深度发酵,至发酵终点时,pH 值分别下降至3.49 和3.70;菌株815 的产酸延迟期较长,从4.5 h 左右才开始产酸,pH 值到达4.5 之后的发酵程度也比较深,到终点时pH 值低至3.68;菌株1610 整体的产酸速率适中,发酵5 h 后pH 值达到4.52,之后缓慢产酸至发酵终点,pH 值为4.20,后酸比较平稳。
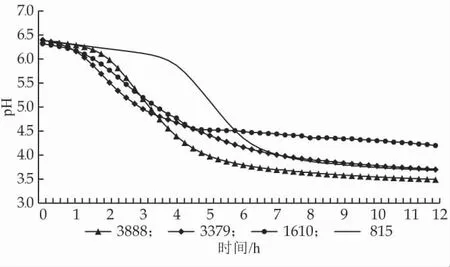
图2 富硒菌株发酵乳产酸曲线
由表3 结果可知,以单菌株发酵获得发酵乳中乙醛和双乙酰的含量各有不同,结合风味评价描述发现,当乙醛含量较高时,发酵乳呈现典型发酵乳香气,当双乙酰含量较高时,发酵乳的乳脂风味突出。菌株815 的乙醛产量最高,但双乙酰含量较低,因此缺乏乳脂香气;菌株1610 的双乙酰产量最高,呈现出浓郁的乳脂风味。一般认为,乙醛由保加利亚乳杆菌发酵产生,双乙酰由嗜热链球菌产生,且当酸奶中乙醛含量较低时,双乙酰占主导地位,形成具有独特奶香味的发酵乳[15-16],本研究中的菌株1610 为一株嗜热链球菌,菌株815 为一株德氏乳杆菌保加利亚亚种,其发酵产生的特征风味物质以及呈现出的风味符合这一特点。
综合分析各菌株产酸特性和特征风味物质含量发现,菌株3379 的产酸速率较慢,且风味欠佳,不适合酸奶发酵,其余3 株发酵性能良好,其中菌株1610的产酸速率适中,后酸化稳定,且能够形成较高含量的乙醛和双乙酰,呈现出乳脂香气浓郁的发酵乳风味,发酵性能最优。
2.4 不同浓度亚硒酸钠对发酵乳感官品质和硒转化的影响
有研究指出,亚硒酸钠的浓度会对发酵乳的品质,如颜色、味道产生影响,也会影响菌株对硒的转化[17]。乳酸菌自身在亚硒酸钠环境中具有解毒作用,可将富集的硒一部分转化成有机硒,而另外一部分可以被还原成零价态的单质硒,单质硒在溶液中呈红色[7]。本研究中,不同浓度亚硒酸钠对发酵乳的颜色和味道影响不明显,添加量为最高200 μg/L 时,发酵乳均呈现乳白色,颜色没有变化,也没有金属味道产生,说明实验中各浓度的亚硒酸钠没有对菌株形成毒性,硒的转化为生理性富集,绝大部分以有机硒形式存在。另一方面,不同浓度的亚硒酸钠对发酵过程硒转化率影响较大,且各菌株的变化趋势较为一致,如图3 所示。当浓度为50 μg/L 时,转化率较低,随后逐渐升高,当浓度增加至125 μg/L 以后,转化率趋于稳定。其中菌株3888 整体硒转化水平较低,原因可能是由于该菌的产酸速率较快,发酵时间比另外两株菌少0.75 h 造成的,Alzate 等人[18]的研究中也发现了相似的结果,乳酸菌发酵12 h 时,硒转化率为89±1%,发酵24 h 时增加至94±1%。综合考虑法规要求、硒转化率和有机硒生成量,确定150 μg/L 为亚硒酸钠的最优浓度。

图3 不同浓度亚硒酸钠对发酵乳中菌株硒转化的影响
2.5 富硒发酵乳抗氧化活性的研究
2.5.1 羟自由基清除能力
羟自由基能够降解DNA、损伤细胞膜和多糖化合物,是导致脂质过氧化和人体细胞损伤的最主要的自由基之一。在本研究中,如图4 所示,3 种乳样品都有一定的羟自由基清除能力,其中富硒发酵乳的清除能力最强,显著高于无机硒乳和无硒发酵乳(P<0.05)。3 株乳酸菌相比,菌株1610 制备的富硒发酵乳清除能力最强,清除率为45.69±3.61%,分别是无机硒乳和无机硒发酵乳的2.99 倍和2.49 倍,分析原因可能是由于菌株1610 在乳中的硒转化率较高,发酵乳中有更多的有机硒产生。Penas 等人[19]在制作德国泡菜时,在发酵前加入0.3 mg 亚硒酸钠,发酵后发现泡菜的抗氧化活性因为有机硒的生产而显著提高,为对照组的1.75 倍。

图4 富硒发酵乳羟自由基清除能力
2.5.2 DPPH 自由基清除能力
清除DPPH 自由基能力被广泛应用于抗氧化能力评价中,本研究中如图5 所示,经过乳酸菌富硒的发酵乳的DPPH 自由基清除能力最强,显著高于无机硒乳和无硒发酵乳(P<0.05),3 株乳酸菌制备的富硒发酵乳的DPPH 自由基清除率为1610(47.15±3.20%)>815(34.64±1.44%)>3888(30.90±2.97%)。发酵乳通常具有一定抗氧化活性,但一般活性较低,乳酸菌是有机硒的良好载体,在乳原料中添加适量无机硒,经过特定菌株发酵转化后,使得发酵乳的抗氧化活性显著提高,形成协同效果。

图5 富硒发酵乳DPPH 自由基清除能力
2.5.3 超氧阴离子自由基清除能力
超氧阴离子自由基是生物体代谢过程中产生的一种自由基,多种乳酸菌被报道过其发酵液、菌上清和菌体均有超氧阴离子自由基清除的能力[20]。本研究发现,富硒后的发酵乳超氧阴离子的清除能力最强,显著高于无机硒乳和无硒发酵乳(P<0.05),3 株乳酸菌制备的富硒发酵乳的超氧阴离子自由基清除能力为1610(70.20±3.32%)>3888(64.35±3.35%)>3888(60.72±4.18%)。超氧阴离子的清除主要通过超氧化物歧化酶进行,有研究报道,采用含有机硒的饲料饲喂仔兔后,兔血清中的SOD 酶显著升高,说明有机硒可以促进SOD 酶的生产,从而提高超氧阴离子的清除能力[21]。本研究中富硒发酵乳超氧阴离子清除能力的增强可能也是通过有机硒的生成,从而促进了SOD 酶的活性。
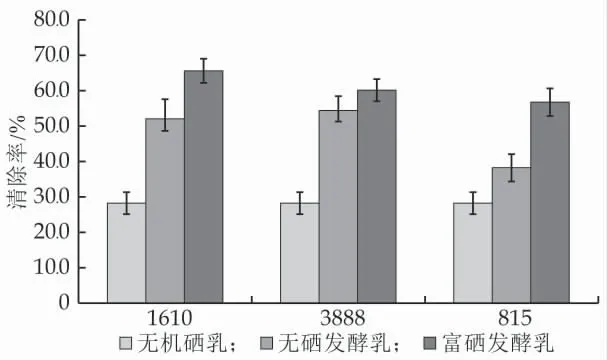
图6 富硒发酵乳超氧阴离子自由基清除能力
3 结 论
本研究从32 株乳酸菌中筛选得到了3 株硒转化能力强且发酵性能优良的菌株,分别是嗜热链球菌1610、乳酸乳球菌3888 和得到乳杆菌乳亚种815。当培养基中添加15 mg/L 的亚硒酸钠时,1610 的富硒率为81.11±2.07%,3888 的富硒率为78.47±3.10%,815的富硒率为71.20±3.47%。以3 种菌株为发酵菌种制备富硒发酵乳,亚硒酸钠最适添加量为150 μg/L,富硒率最高可达到88.39±10.61%,且发酵乳颜色呈现乳白色和典型发酵乳香气,没有红色和金属味,感官品质良好。与无机硒乳和无硒发酵乳相比,3 株菌制备的富硒发酵乳的羟自由基、DPPH 自由基和超氧阴离子自由基的清除能力显著升高,说明经过含有有机硒的发酵乳具有更好的抗氧化活性。
乳酸菌是有机硒良好的载体,利用特定乳酸菌菌株能够将无机硒转化成有机硒的特性,赋予发酵乳双重的功能特性,具有良好的市场空间。本研究发现筛选获得的富硒菌株可在发酵乳时对无机硒进行快速高效的转化,当底物浓度合适时,绝大部分以有机硒形态存在,且显著提高了发酵乳的抗氧化活性。后期研究将进一步分析发酵乳中有机硒的形态以及有机硒与抗氧化活性之间的联系,为富硒功能性发酵乳制品的开发提供支撑。

