骨髓间充质干细胞对大鼠缺血性脑卒中炎症反应中小胶质细胞的分子调控机制
柏秀娟,李一凡,时霄冰,姜磊,孙博,尚延昌,吴卫平*
(中国人民解放军总医院第二医学中心:1神经内科,2国家老年疾病临床医学研究中心,北京100853)
近些年患缺血性脑卒中的人群越来越多,缺血性脑卒中除了可以引起局部脑组织的缺血性坏死,同时也启动了局部组织非特异性炎症,这种非特异性炎症反应加重了脑组织缺血局部的坏死[1]。缺血性脑卒中发生后,针对其炎症反应应答的首要细胞为小胶质细胞,早期主要是M2型反应,持续时间短,随后M1型反应占主导地位[2,3]。这些M1型细胞为抗炎型小胶质细胞,可以释放如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等有害因子,从而加重脑组织神经元的坏死,而M2型细胞抗炎型小胶质细胞,主要发挥脑保护作用,所以M2型向M1型细胞极化加重了神经元损伤,降低了神经修复[4-8]。很多研究发现体外间充质干细胞(mesenchymal stem cell,MSC)可以调控小胶质细胞的这种表型转化,前期我们的研究已经证实了移植骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)可以使大鼠脑卒中缺血区的M1型细胞向M2型转化[9]。
据文献报道,趋化因子CX3C配体1(ligand 1 of CX3C,CX3CL1)可能参与了调控MSC对小胶质细胞表型的转化,它具有调节细胞分化和迁移、促进神经损伤的修复等作用[10,11]。在中枢神经系统,趋化因子CX3C受体1(recepor 1 of CX3C,CX3CR1)主要在小胶质细胞表达,其配体CX3CL1主要在神经元表达,CX3CL1-CX3CR1相结合的途径在维持小胶质细胞的功能方面发挥着重要作用[12]。那么脑缺血时MSC能否通过分泌CX3CL1来调控M1型和M2型小胶质细胞在缺血区的分布,从而调节和控制缺血后的炎症反应。我们前期已成功构建和包装了CX3CL1的干扰慢病毒,并顺利将其转染至BMSC细胞,高效抑制了BMSC的CX3CL1基因的表达[13]。本研究在构建大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型的基础上,移植BMSC及被CX3CL1干扰慢病毒感染的BMSC,进一步阐明BMSC是否通过分泌CX3CL1逆转抗炎型、促炎型小胶质细胞在脑组织的分布,初步探讨BMSC体内调控小胶质细胞表型转化的机制。
1 材料与方法
1.1 实验动物与试剂
选择SD大鼠30只,3周龄,购买于重庆医科大学实验动物中心;2,3,5-氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)购于Sigama公司;TritonX-100购于上海生工;一抗Iba抗体和TNF-α抗体及CD206抗体(兔来源)、二抗Alexa Fluor FITC抗体和CY3抗体(抗兔)均购于英国Abcam公司;免疫荧光一抗稀释液、免疫荧光二抗稀释液均购自北京碧云天公司。
1.2 大鼠MCAO模型的构建及分组方法
参照改良的Zea Longa线栓法构建SD大鼠的MCAO模型。沿着大鼠颈部正中进行切口,分离出右侧颈总动脉大约1.0~1.5 cm,可见颈外动脉、颈内动脉与颈总动脉呈“Y字形”。结扎颈总动脉及颈外动脉的近心端,并在颈内动脉内埋线,用动脉夹暂时夹闭颈内动脉。在颈总动脉近心端的结扎处剪一“V”形切口,用眼科镊夹持住栓线由颈总动脉进入到颈内动脉,到达动脉夹时,将埋线稍微拉紧,用以防止渗血,然后松开动脉夹,继续插入栓线,当栓线黑色标记处到达Y字形分叉口时,表明栓线已进入大脑中动脉且不能继续前行。栓线插入完毕后,将预留的结扎线拉紧固定。90 min过后,在SD大鼠颈部打开一个小口,用眼科镊夹住栓线的固定处,然后将栓线拔出约1 cm,通过其他血管如翼鄂动脉和对侧的血液进入右侧大脑中动脉从而实现血流的再灌注。大鼠于造模24 h后,参照Zea Longa 5级神经功能缺损评分法对大鼠进行神经功能评分(图1)。将神经功能评分在0和4分的大鼠剔除,选择评分在1~3分的大鼠作为实验对象。

图1 MCAO模型神经功能评分
本研究共纳入大鼠30只,MCAO模型构建使用大鼠29只,做TTC染色使用大鼠1只。MCAO模型构建剔除大鼠9只;纳入模型大鼠20只,其中2只做TTC染色;将剩余模型大鼠18只随机分为2组,每组9只。对照组为模型大鼠注射BMSC,实验组为模型大鼠注射CX3CL1干扰慢病毒感染的BMSC[13]。
1.3 TTC染色
随机取2只模型大鼠和1只正常大鼠均麻醉,迅速取出大脑,置于-80 ℃冰箱中冷冻5 min左右。一般沿着大脑的冠状位进行切片,厚度2 mm。将切片置于1%TTC中,于37 ℃的水浴箱内孵育15 min左右。将染色完成的切片取出,然后进行固定。拍照检测梗死体积大小。
1.4 侧脑室定位注射BMSC
1.4.1 侧脑室注射BMSC 实验鼠称重并麻醉,头部备皮后固定于脑立体定位仪,沿中线切开头皮,剥离筋膜,标记前囟,高速颅骨钻于右侧脑室注射部位正上方钻穿颅骨,插入微量注射器,注射速度0.5 μl/min,注射剂量5 μl/只(含细胞105个),注射完成后涂抹骨蜡,完成脑定位注射。
1.4.2 取材 在干细胞注射1、3、7 d后取材,每组每个时间点3只大鼠。实验鼠称重并麻醉,开胸腹暴露肝脏和心脏,注射针插入左心室并剪开右心耳,快速灌注生理盐水至肝脏变白,待右心耳流出澄清液体后换用4%多聚甲醛固定液,先快速再缓慢灌注至大鼠肝脏变硬肢体僵直,断头取脑,脑组织固定,4 ℃保存用于免疫荧光检测。
1.5 免疫荧光检测
1.5.1 制作切片 冠状位取样,取样后用磷酸盐缓冲溶液(phosphate buffer solution,PBS)清洗,4%多聚甲醛固定。首先是组织石蜡制作,主要经过脱水、透明、透蜡、包埋、切片及烤片;然后石蜡切片脱蜡复水;最后热抗原修复,下接免疫荧光染色步骤。
1.5.2 免疫荧光染色 在切片组织上滴加0.5% TritonX-100,室温打孔60 min,PBS浸洗3次。然后滴加山羊血清,室温封闭60 min。每张切片滴加稀释好的一抗Iba(比例为1∶100),4 ℃孵育过夜。室温下复温30 min,然后滴加足量稀释好的荧光二抗cy3(比例为1∶800),37 ℃孵育60 min。滴加稀释好的一抗TNF-α(比例为1∶400)、CD206(比例为1∶200),37 ℃孵育60 min。然后滴加稀释好的足量荧光二抗FITC(比例为1∶800),37 ℃孵育60 min。最后进行细胞核染色,用含抗荧光淬灭剂的封片液进行封片,在激光扫描共聚焦显微镜下计数双染细胞数并采集图像。每个样本3个切片,每张切片随机选择5个视野,在激光扫描共聚焦显微(400×)下计数每个视野双染重合阳性的细胞数(Iba+CD206+、Iba+TNF-α+),并采集部分图像。
1.6 统计学处理
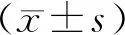
2 结 果
2.1 TTC染色结果
TTC染色结果可见2只MCAO模型大鼠均存在大脑中动脉供血区的梗死病灶,1只正常大鼠大脑未见梗死病灶,梗死病灶为苍白色,正常组织为红色(图2)。

图2 TTC染色结果
2.2 免疫荧光染色结果
2.2.1 Iba+CD206+免疫荧光染色结果 与实验组相比,对照组在3个时间点缺血区抗炎型小胶质细胞(Iba+CD206+)的数量明显增加(均P<0.05;表1)。干细胞注射后1、3、7 d后的Iba+CD206+双染阳性的细胞,详见图3。
图3 Iba+CD206+免疫荧光图片
2.2.2 Iba+TNF-α+免疫荧光染色结果 在第3天和第7天促炎型小胶质细胞(Iba+TNF-α+)的数量明显减少(均P<0.05;表1)。干细胞注射后1、3、7 d后的Iba+ TNF-α+双染阳性的细胞,详见图4。
表1 Iba+CD206+/Iba+TNF-α+双染阳性细胞数比较

图4 Iba+TNF-α+免疫荧光图片
3 讨 论
缺血性脑卒中是导致人类残疾、死亡的重要疾病之一。合理减轻脑梗死后的炎症反应,可改善脑组织的继发性损伤,在脑梗死的治疗中起着比较关键的作用。在正常情况下,小胶质细胞在脑组织中都是静息状态[14],缺血性脑血管病发生后小胶质细胞迅速活化增殖,成为中枢神经系统损伤应答的主要效应器,活化后的小胶质细胞在脑组织损伤修复中发挥重要作用[15]。因此,在脑组织中小胶质细胞的类型转化已成为缺血性脑血管病治疗的潜在靶点,探寻可调控小胶质细胞有效的干预措施将为缺血性脑卒中的治疗带来新的希望。
近年来,干细胞的特殊修复作用让其获得了研究者们的青睐,医学领域已经开展了诸多围绕着干细胞的研究课题。有研究报道,BMSC可以缓解心血管疾病的症状,保护器官的功能并修复受损的组织[16,17]。已有研究证实MSC可以改善脑卒中动物的神经功能,主要集中在神经再生及修复方面,但MSC能否调控卒中后炎症反应鲜有报道。近年很多研究结果表明MSC对小胶质细胞的激活、增殖及功能均可产生一定的影响,然而具体作用机制还不是很明确。据文献报道,CX3CL1可能参与了MSC对小胶质细胞的调控,CX3CL1-CX3CR1信号途径对维持小胶质细胞的功能发挥重要作用,此信号途径激活后小胶质细胞主要表现为神经保护型,而破坏此途径后小胶质细胞表现为神经毒性[18,19]。
因此,我们在构建大鼠MCAO模型的基础上移植BMSC及被CX3CL1慢病毒感染的BMSC,进一步阐明BMSC是否通过分泌CX3CL1来完成这种逆转作用。本实验成功建立了SD大鼠大脑中动脉栓塞模型,然后将其分为2组,对照组为MCAO模型注射BMSC组,实验组为MCAO模型注射CX3CL1慢病毒感染的BMSC组,每组处理3个时间点(干细胞注射后1、3、7 d)。每张切片均进行抗Iba和抗CD206/TNF-α双重免疫荧光染色,然后在光扫描共聚焦显微镜下计数双染重合阳性的细胞数并采集图像。最后对这2组模型不同时间点双染阳性的细胞数进行统计分析,我们发现BMSC移植使梗死区抗炎型小胶质细胞(CD206阳性)明显增加,促炎型小胶质细胞(TNF-α阳性)明显减少,移植被CX3CL1慢病毒感染的BMSC就没有这种逆转作用。
综上,本实验结果表明移植BMSC可能通过释放CX3CL1来完成小胶质细胞的逆转,使脑组织缺血区的促炎型小胶质细胞向抗炎型小胶质细胞转变,这可为缺血性脑卒中后干细胞的治疗提供基础理论依据。

