滇橄榄叶羟基酪醇对CS2 致小鼠睾丸组织损伤的保护作用
李 楠,李瑞婷,赵兴文,邓丽红,蒲 慧,姜 燕,
(1.大理大学公共卫生学院,云南大理 671000;2.大理农林职业技术学院工程学院,云南大理 671000)
人类的生育能力,特别是精子的质量和数量已发生显著的改变,男性不育和生殖系统发育异常明显增加[1-2],与人群接触工业环境中的化学物质密切相关[3-4]。二硫化碳(carbon disulfide,CS2)广泛应用于农药生产、纺织业和玻璃纸制造业等[5-6],长期职业条件下接触,CS2可经呼吸道和皮肤进入人体,对心血管系统、神经系统以及生殖系统产生不良影响[7]。造成生殖损伤的主要机制为对线粒体造成氧化损伤[8-9]。当机体处于氧化应激状态时,活性氧生成量大于机体清除能力,导致机体脂质过氧化水平升高,干扰细胞生长和细胞周期进程,并诱导细胞凋亡[10-12],从而使精子数量减少、质量下降,生育能力受损。
滇橄榄(Phyllanthus emblicaLinn),又名余甘子,云南省分布广泛。滇橄榄叶是滇橄榄的废弃物和副产物,含有多种生物活性物质,其中羟基酪醇(hydroxytyrosol,HT)是以酯类形式存在的天然多酚化合物,具有抗炎抑菌、防止动脉粥样硬化、抗癌、抗氧化和抑制血小板凝集等作用[13-15]。在黄酮、多酚和橄榄苦苷等多种抗氧化活性成分中,羟基酪醇具有更高的抗氧化能力,其对氧化应激所致疾病具有防治作用[16-18]。研究表明,对比剂肾病(contrast-induced nephropathy, CIN)发生时活性氧产生增多,存在氧化应激反应,HT 可以减轻氧化应激对CIN 的损伤,发挥肾脏保护作用[19]。张璐璐[20]研究发现,HT 通过抑制下丘脑-垂体-肾上腺轴亢进、减轻海马氧化应激、抑制神经炎症、提升海马神经营养因子水平和恢复线粒体功能,缓解了轻度应激诱导的小鼠抑郁样行为。但其在睾丸组织氧化损伤方面的研究鲜有报道。
因此,本实验旨在研究滇橄榄叶羟基酪醇(hydroxytyrosol fromPhyllanthus emblicaLinn leaves,PHT)对CS2诱导小鼠睾丸组织氧化损伤的保护作用,为其在CS2对男(雄)性生殖系统损伤的保护机制研究提供理论依据。
1 材料与方法
1.1 材料与仪器
清洁级昆明种小鼠40 只(体重18±2 g) 购自湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2019-0004];滇橄榄叶 云南树翡翠农林科技有限公司提供;二硫化碳 分析纯,上海四试赫维化工有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)试剂盒 南京建成生物工程研究所;伊红染色液、4%多聚甲醛、BCA 蛋白定量检测试剂盒、Bax、Bcl-2、Caspase-3抗体、辣根过氧化物酶(HRP)山羊抗鼠二抗 武汉赛维尔生物科技有限公司。
MDF-382E(N)超低温冰箱 日本SANYO 公司;CK40 光学显微镜 日本Olympus 公司;Multiskan酶标仪 芬兰雷勃公司;XB120A 电子分析天平 瑞士Precisa 公司;GS-15R 低温高速离心机 美国Beckman 公司;Agilent 1290 高效液相色谱仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 滇橄榄叶羟基酪醇纯化物的制备 滇橄榄叶采摘于云南宾川有机滇橄榄基地。40 ℃鼓风干燥、粉碎,过60 目筛得滇橄榄叶粉末。准确称取5 g 滇橄榄叶粉末,以1:15 g/mL 的料液比加入0.1 mol/L的NaOH 溶液,在80 ℃下,提取60 min,获得PHT粗提物。将粗提液加入DA-201 大孔树脂,采用静态吸附脱附法对PHT 粗提物进行分离纯化[21],得到PHT 纯化物(此后简称PHT)。
采用HPLC 外标法测定PHT 的含量,实验条件:色谱柱为C18柱(250 mm×4.6 mm,5 μm),柱温为25 ℃,以乙腈(0.2%冰乙酸)-水(10:90,V/V)为流动相,上样量为5 μL,流速为0.8 mL/min,紫外吸收波长为280 nm。经HPLC 检测,PHT 粗提物的提取率为0.72%,纯化后,PHT 纯度为79.31%。
1.2.2 动物分组及给药 将经过适应性饲养的小鼠按体重随机分为5 组,包括对照组、CS2染毒组和PHT 高(450 mg/kg)、中(150 mg/kg)、低(50 mg/kg)剂量组(给药剂量根据提取物纯度及预实验确定),每组8 只。将从滇橄榄叶中提取的纯化后的PHT 以蒸馏水分别配制成4.5、1.5、0.5 mg/mL 3 种浓度的溶液作为高、中、低剂量组的干预物质。灌胃前称小鼠体重,每只小鼠的灌胃容量为10 mL/kg。PHT 干预组每日9 时进行灌胃,对照组和染毒组蒸馏水灌胃。同时,染毒组和PHT 各剂量干预组采用静式吸入式染毒,在灌胃当天14~16 时染毒2 h,每周染毒5 d,灌胃及染毒时间共持续4 周。实验小鼠的使用严格遵守大理大学动物保护和使用委员会规章制度。
1.2.3 睾丸脏器系数的计算 4 周后,对小鼠体重进行称量和记录。随后将其处死,并立即取出小鼠睾丸称重,记录睾丸重量。睾丸脏器系数的计算如式(1)所示。
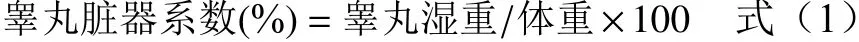
1.2.4 精子质量分析
1.2.4.1 精子计数 在1 mL 生理盐水中剪碎附睾,混匀制成精子悬液。悬液放置于60 ℃水浴箱中孵育10 min 使精子死亡,取精子悬液充池于血细胞计数板的计数池内,按红细胞计数法计数中央大方格内5 个中方格内精子数,计算出每毫升精液中的精子数。

1.2.4.2 精子活动率 精子悬液制作方法同上,于37 ℃水浴箱中静置10 min,待精子自由流出。在室温条件下,取一滴精子悬液充填血细胞计数板,光学显微镜下镜检,连续计数200 个精子中活动精子数,计算精子活动率。
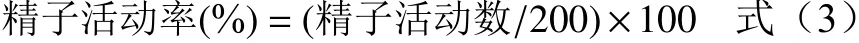
1.2.4.3 精子畸形率 于干净玻片上取1 滴精子滤液推片,放置于室温自然干燥,甲醇固定、干燥,然后用2%伊红染色1~2 h,流水冲洗染液、室温自然晾干玻片,高倍显微镜下计数1000 条精子中的畸形精子数,计算精子畸形率。

1.2.5 病理组织切片观察 用手术刀片将经过4%多聚甲醛固定的睾丸组织修成0.5 mm×0.5 mm×0.5 mm 的组织块,经常规组织石蜡包埋、切片、脱蜡后,采用HE 染色法制片,观察睾丸的病理组织学变化。
1.2.6 睾丸组织氧化应激指标检测 取出-80 ℃冻存睾丸组织,加入9 倍预冷生理盐水,置于冰上进行匀浆,充分研磨,制备10%组织匀浆。低温离心机3000 r/min 离心10 min,弃沉淀,留上清液进行各项指标测定。按照试剂盒说明检测MDA、SOD 和GSH-Px 等指标。
1.2.7 睾丸组织中凋亡相关因子蛋白的表达情况Western blot 实验参照常规方法[22]进行,组织块用预冷的PBS 洗涤2~3 次,加入10 倍组织体积的裂解液进行匀浆;将匀浆完成的匀浆管取出,放置冰上裂解30 min,每隔5 min 震荡一次确保组织完全裂解;12000 r/min,4 ℃,离心10 min,收集上清,即为总蛋白溶液,采用BCA 试剂盒测蛋白浓度。进行电泳、转膜、封闭等步骤后,加入一抗Caspase-3(1:1000 稀释)、Bax(1:2500 稀释)、Bcl-2(1:2500 稀释)、内参β-actin(1:2000 稀释),4 ℃冰箱孵育过夜;次日用TBST 洗膜3 次,每次5 min,然后加入HRP-IgG(1:2000 稀释),反应1 h 后重复上述洗膜过程,凝胶成像系统曝光并保存图片后定量分析,以目的蛋白与β-actin 灰度值的比值表示目的蛋白的相对表达量。
1.3 数据处理
2 结果与分析
2.1 睾丸脏器指数
由表1 可知,CS2染毒组睾丸脏器系数相对于对照组下降极显著(P<0.01),说明在CS2的毒性作用下,小鼠睾丸发生了病变性萎缩;PHT 高、中剂量组对小鼠睾丸表现出了保护作用,极显著提高了小鼠睾丸脏器系数(P<0.01);且PHT 高剂量组小鼠睾丸质量及睾丸脏器系数水平接近对照组,即组间已不存在统计学差异(P>0.05)。说明PHT 对CS2致小鼠睾丸损伤的保护作用呈现剂量依赖性。
表1 PHT 对CS2 染毒小鼠睾丸及其脏器系数的影响(n=8, ±S)Table 1 Effects of PHT on testis and organ coefficient of mice exposed to CS2 (n=8, ±S)
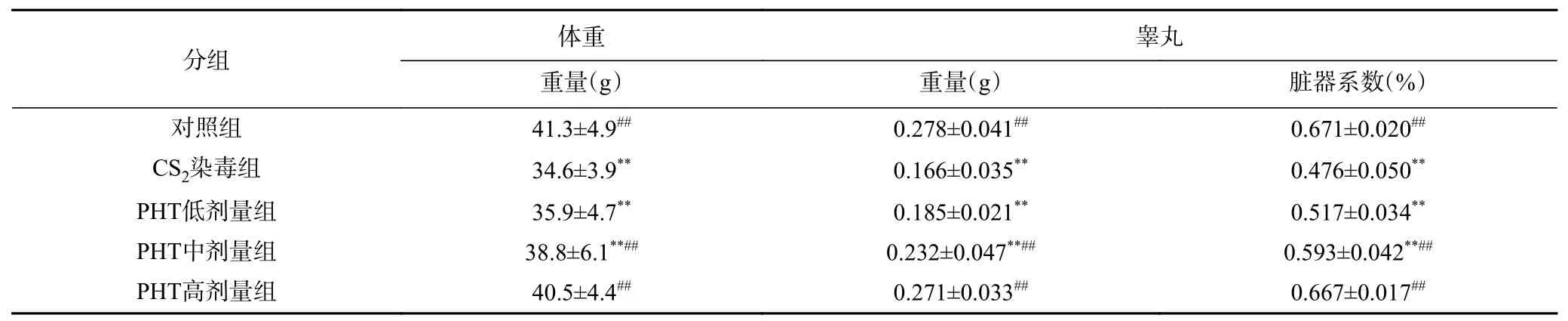
表1 PHT 对CS2 染毒小鼠睾丸及其脏器系数的影响(n=8, ±S)Table 1 Effects of PHT on testis and organ coefficient of mice exposed to CS2 (n=8, ±S)
注:*表示与对照组相比P<0.05,**表示与对照组相比P<0.01;#表示与CS2染毒组相比P<0.05,##表示与CS2染毒组相比P<0.01;表2~表4同。
?
2.2 精子质量检测
由表2 可知,染毒组与对照组相比,精子数量减少,精子活动率降低,而精子畸形率升高,三者变化表现为极显著(P<0.01)。经过PHT 干预后,各剂量组与染毒组相比,精子数量和精子活动率得到了极显著的改善(P<0.01),精子畸形率下降极为显著(P<0.01),即PHT 可以有效缓解CS2所致的精子损伤,提高精子质量。而且,与对照组相比,PHT 高剂量组的精子畸形率未表现出差异(P>0.05),说明在PHT高剂量的保护作用下,显著降低了精子的致畸率。
表2 PHT 对CS2 染毒小鼠精子质量的影响(n=8, ±S)Table 2 Effects of PHT on sperm quality of mice exposed to CS2 (n=8, ±S)

表2 PHT 对CS2 染毒小鼠精子质量的影响(n=8, ±S)Table 2 Effects of PHT on sperm quality of mice exposed to CS2 (n=8, ±S)
?
2.3 睾丸组织病理切片
通过小鼠睾丸组织HE 染色观察PHT 对CS2造成的睾丸损伤的影响,结果如图1。由图1(A)可知,对照组小鼠睾丸生精上皮厚,曲细精管呈圆形或椭圆形,结构完整饱满,管内支持细胞及各级生精细胞排列规则,可见各个发育阶段细胞,腔内可见成熟精子。由图1(B)可知,在CS2的毒性作用下,睾丸曲细精管萎缩扭曲成不规则形状,生精上皮变薄,生精细胞数量及管腔内精子细胞数量明显少于正常对照组。各级生精细胞排列紊乱,部分管腔可见大量生精细胞脱落,说明CS2对雄性动物表现出了明显的生殖毒性。由图1(C、D、E)可知,在PHT 保护作用下,曲细精管的变形程度减轻,管腔内精子细胞数量明显高于染毒组,且各级生精细胞排列较为规则,官腔内可见成熟精子。说明该剂量下,小鼠睾丸组织形态得到了一定的保护。图1(E)中管腔内精子细胞数量基本正常。说明高剂量PHT 对CS2所造成的生殖毒性具有逆转作用,使小鼠的睾丸组织形态趋近于空白对照组。在PHT 的抗氧化能力的保护下,睾丸组织的质量得到明显改善。
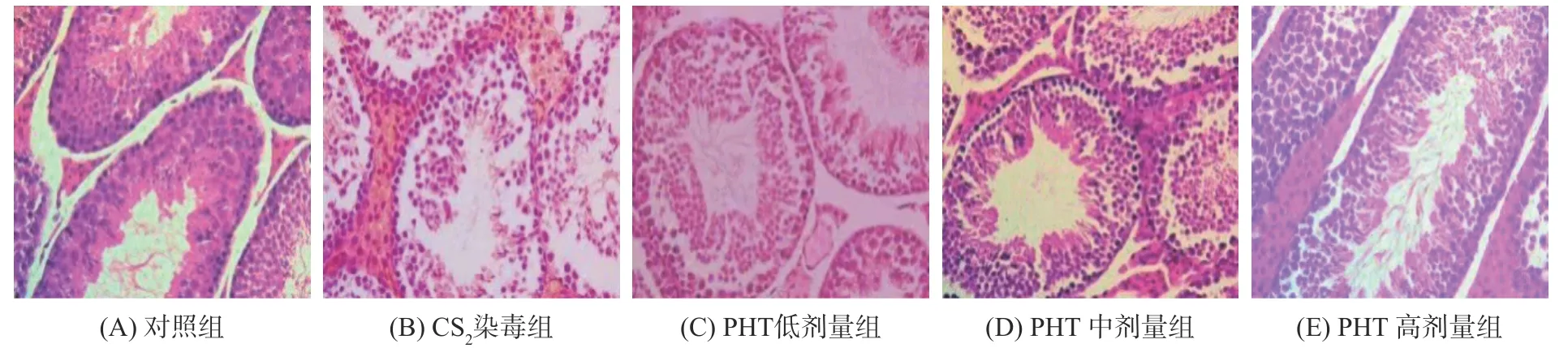
图1 睾丸组织病理切片(200 倍)Fig.1 Pathological section of testis(200×)
2.4 PHT 对小鼠睾丸组织氧化应激指标的影响
结果如表3 所示,与对照组比,CS2组小鼠睾丸组织MDA 含量增加,SOD、GSH-Px 活性极显著降低(P<0.01);与CS2染毒组比,PHT 高、中剂量组小鼠睾丸组织中MDA 含量有所下降,SOD 活性和GSHPx 活性极显著升高(P<0.01),低剂量组中MDA 含量和SOD 活性变化与其他两个剂量组保持一致(P<0.01),GSH-Px 活性差异虽不是极显著(0.01<P<0.05),但各剂量组均表现出抑制氧化损伤的效果;当PHT 干预剂量为450 mg/kg 时,MDA 含量与对照组比,已无统计学差异(P>0.05),说明PHT 具有较好的抗氧化能力,对CS2所致的氧化损伤有一定的拮抗作用。
表3 PHT 对小鼠睾丸组织氧化应激指标的影响(n=8, ±S)Table 3 Effects of PHT on oxidative stress in testis of mice (n=8, ±S)
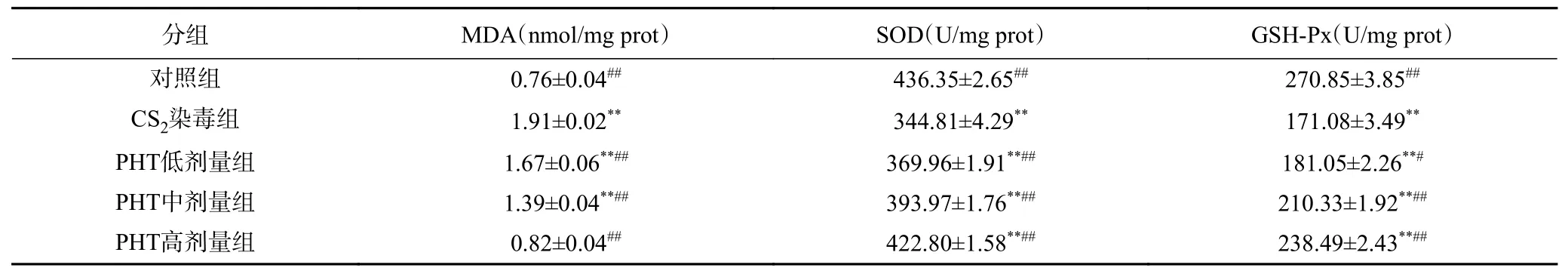
表3 PHT 对小鼠睾丸组织氧化应激指标的影响(n=8, ±S)Table 3 Effects of PHT on oxidative stress in testis of mice (n=8, ±S)
?
2.5 小鼠睾丸组织中凋亡相关因子蛋白的表达情况
PHT 对CS2染毒小鼠睾丸组织中凋亡相关因子蛋白相对表达水平的影响见表4,其凝胶电泳图见图2。与对照组相比,CS2染毒组和PHT 中、低剂量组睾丸组织中Bax 和Caspase-3 表达极显著升高(P<0.01),Bcl-2 表达极显著降低(P<0.01),PHT 高剂量组的Bax、Bcl-2(P<0.05)和Caspase-3(P<0.01)的表达量与对照组也同样存在差异,这三种蛋白相对表达水平差异均有统计学意义;与CS2染毒组相比,中、高剂量干预组睾丸组织中Bax 和Caspase-3 表达极显著降低,Bcl-2 表达极显著升高(P<0.01),且呈现出剂量依赖关系。说明PHT 可以有效降低促细胞凋亡因子(Bax 和Caspase-3)的表达,同时可以升高抑制细胞凋亡因子(Bcl-2)的表达,即PHT 能够对睾丸组织表现出保护作用。
表4 小鼠睾丸组织中凋亡相关因子蛋白相对表达水平(n=8, ±S)Table 4 Relative expression level of apoptosis-related factor protein in mouse testis (n=8, ±S)
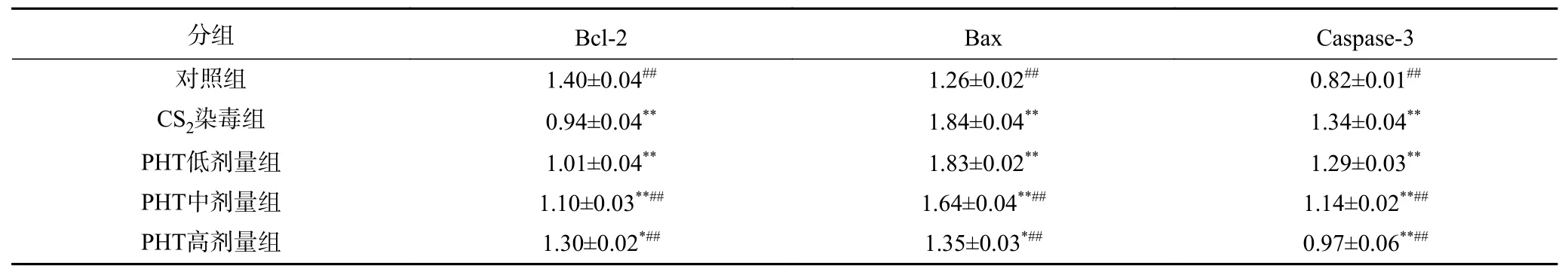
表4 小鼠睾丸组织中凋亡相关因子蛋白相对表达水平(n=8, ±S)Table 4 Relative expression level of apoptosis-related factor protein in mouse testis (n=8, ±S)
?
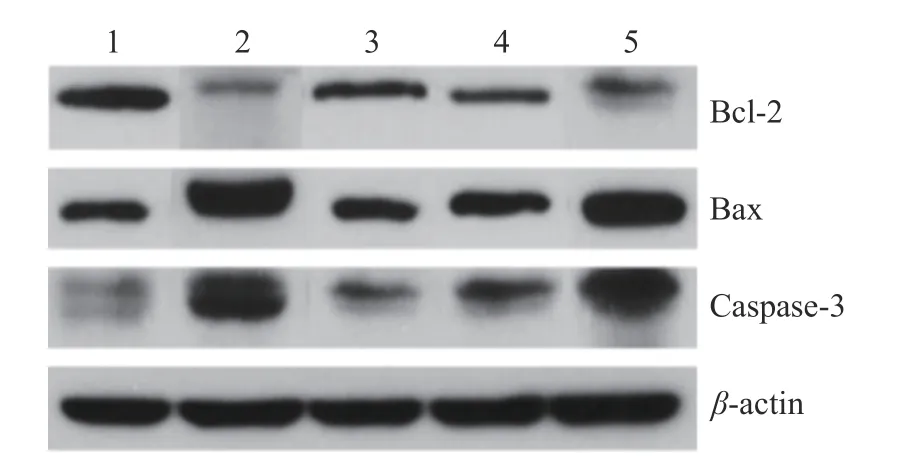
图2 小鼠睾丸组织中凋亡相关因子蛋白表达的凝胶电泳图Fig.2 Gel electrophoresis of apoptosis-related factor protein expression in mouse testis
3 讨论与结论
大量的人群流行病学研究和动物实验研究表明,生产生活中接触到的一些化学物质会造成男(雄)性生殖系统损伤和男(雄)性生殖功能异常[23]。当机体长时间接触到CS2时,会对睾丸组织产生慢性毒性,造成睾丸组织氧化损伤,降低精子质量,增加男性不育的发生率。近年来,氧化应激损伤逐渐受到学者们的关注[24-25]。王姝婷[26]研究发现CS2暴露导致的氧化应激和DNA 损伤可能会引起孕鼠子宫和胚胎的细胞自噬水平异常,进而导致胚胎植入障碍。王为等[11]研究发现,CS2作用于大鼠睾丸组织时发生氧化应激产生大量自由基,而体内抗氧化系统能力减弱无法全部清除,自由基对组织直接造成毒性作用。
羟基酪醇具有显著的抗氧化功能[27],其总抗氧化能力相较于黄酮[28]和其他多酚类化合物[29]表现出明显优势,这为其在氧化应激导致的损伤中发挥保护作用提供了理论依据。本实验表明,经CS2染毒的小鼠睾丸脏器系数和精子质量明显降低,通过PHT 干预后,可以拮抗CS2染毒所致的小鼠精子数量和活动率降低,减少小鼠精子畸形率的增加,缓解小鼠睾丸组织的损伤程度,并且具有剂量依赖性。此外,本研究结果显示,CS2染毒组中MDA 含量升高,SOD 和GSH-Px 活性下降,睾丸组织表现出氧化损伤,采用不同剂量的PHT 拮抗CS2后,睾丸组织MDA含量下降,SOD 和GSH-Px 活力升高,提示PHT 可以在体内发挥较好的抗氧化作用。
CS2可以通过氧化损伤,导致睾丸清除自由基能力下降、脂质过氧化产物大量堆积,使睾丸组织发生氧化损伤,进一步激活促细胞凋亡因子表达。Bcl-2 蛋白是Bcl-2 原癌基因的编码产物,是细胞存活促进因子。Bax 是Bcl-2 基因家族中细胞凋亡促进基因,Bax 的过度表达可拮抗Bcl-2 的保护效应而使细胞趋于死亡,而Caspase-3 是细胞凋亡过程中最主要的终末剪切酶[30]。CS2染毒后,Bax 和Caspase-3 的表达量升高,Bcl-2 的表达量降低。Bax、Bcl-2 主要在线粒体外膜附近区域发挥功效,Bax 蛋白可以使线粒体膜上形成孔道,促进细胞色素C 的释放,当细胞受到凋亡信号的作用后,使Caspase-3 的表达升高,而Bcl-2 蛋白的高表达可以阻止这一过程[31]。在PHT 的干预下,促进细胞凋亡因子Bax 和Caspase-3 的表达量下降,促进细胞存活因子Bcl-2 的表达量升高,与CS2染毒组比,中、高剂量组差异有统计学意义(P<0.01),提示PHT 可以显著拮抗CS2所致的氧化应激,抑制细胞凋亡的发生。
综上所述,当长期低剂量的接触脂溶性的CS2时,会促使机体产生过量的MDA,减弱抗氧化酶活性,进一步加重氧化损伤,使Bcl-2 和Bax 表达失衡,最终激活Caspase-3 因子,导致细胞发生凋亡。而PHT 具有较强的体外抗氧化活性,其对自由基的清除能力和总抗氧化能力较为突出。将其作用于CS2染毒的动物实验后,同样表现出较为理想的保护作用。PHT 保护CS2所致的小鼠生殖损伤的作用机制可能与PHT 对抗CS2氧化损伤有关,该研究为缓解机体氧化损伤提供了新的选择,也为预防慢性CS2中毒提供了一种可能。

