凝血酶生成检测的应用现状与发展
武艺(Wu Yi),鲁翌(Lu Yi),叶絮(Ye Xu),刘烁(Liu Shuo)
(1.国家血液病临床医学研究中心,唐仲英医学研究院,苏州大学,苏州215123;2.武汉塞力斯生物技术有限公司,武汉430040;3.广州医科大学第二附属医院血液科,广州510260;1. National Clinical Research Center for Hematologic Diseases,Cyrus Tang Medical Institute,Soochow University Suzhou 215123,China.;2.Wuhan Thalys Biotechnology Co.,Ltd.,Wuhan 430040;3.Department of Hematology,Second Affiliated Hospital of Guangzhou Medical University,Guangzhou 510260)
在基础与临床研究中,我们主要依赖于凝血基础试验(basic tests of coagulation)、凝血酶原时间(prothrombin time,PT)和活化部分促凝血酶原激酶时间(activated partial thromboplastin time,APTT)评价凝血功能。凝血酶生成实验(thrombin generation assay,TGA)的问世将凝血功能检测提高到新的台阶。但是,最初TGA的检测方法既费力又耗时,需要单独采样,尤其是没有考虑凝血酶-抗凝血酶复合物对凝血酶的灭活,因此无法准确地反映凝血酶生成的动态变化和整体情况。校准的自动凝血酶生成图(calibrated automated thrombogram,CAT)系综合抗凝血酶复合物的客观因素,且具备对多个样品同时快速且连续的测量,大大提高TGA的准确性、效率和可重复性。因此,基于CAT的TGA检测逐渐成为凝血检测的主流方法。与传统的凝血实验相比,TGA有以下几个优点[1-3]。首先,PT和APTT的测量依赖于纤维蛋白原的浓度和活性[4],但是,TGA不受纤维蛋白原的影响,即使在纤维蛋白网络形成后仍然能够检测到凝血酶的生成。其次,在PT和APTT中仅5%的凝血酶发挥作用形成血凝块,这意味着95%生成的凝血酶检测不到。而且,TGA测定曲线反映了凝血全过程的多个参数,包括滞后时间、凝血酶生成速度、凝血酶生成峰值和内源性凝血酶生成潜力,其中最重要的参数是内源性凝血酶生成潜力,即生成凝血酶的净量,但是PT和APTT仅提供凝血完成的终点时间值。
基于TGA检测的优势,其在临床中的应用日益广泛。例如,监测服用抗凝剂和抗血小板药物的患者、评估接受旁路药物或替代疗法的血友病患者的出血风险、筛查遗传性或获得性血栓性和出血性疾病等。与传统的凝血实验相比,虽然TGA适合于全面的止血与血栓倾向的评估,但是为了更可靠地评价凝血的特定途径和阶段,以及更精确地评估整个凝血过程,该方法仍然需要进一步优化,包括其临床检测的标准化。
1 实验方法
1993年Hemker等报道了TGA的基本原理,他们使用显色底物甲基丙二酰-甲基苯丙酰-精氨酰-pNA(SQ 68)[5],建立了连续凝血酶生成检测。2003年该方法升级为CAT[6]。在过去的二十年中,在该方法的基础上,改进出三种商业化的TGA自动检测方法:Technoclone公司Technothrombin和Diagnostics Stago公司拥有Thrombobinoscope,两者均使用荧光底物,Behring公司凝血系统(BCS)使用显色底物。荧光检测比显色法特异性更高,不受血浆样品中纤维蛋白及其它化学物理参数的影响。这三个系统的共同点是:
(1)检测样品的制备方法相同,应用柠檬酸钠抗凝,制备乏血小板血浆(platelet poor plasma,PPP);
(2)均使用低浓度或高浓度磷脂化重组组织因子(tissue factor,TF)启动凝血反应;
(3)以底物裂解作为检测对象,连续监测凝血酶的生成。
但是,这三种系统在样品设置、检测底物、测量过程和标准校准品等方面存在以下不同:
(1)样品设置。尽管这三种方法均使用TF启动凝血,但是BCS系统还需要纤维蛋白抑制剂和配方不公开的缓冲液保持测定体系的稳定性。显色测定的缺陷之一是仅能测定PPP样本。
(2)检测底物。BCS系统的显色底物为H-β-Ala-Gly-Arg-pNA-pNA,凝血酶对其裂解产生发色基团。荧光检测使用Z-Gly-Gly-Arg-AMC(ZGGRAMC)底物,凝血酶将其裂解后释放出AMC(7-氨基-4-甲基香豆素),产生荧光信号,通过荧光强度的相对变化的动态曲线(dx/dt),确定内源性凝血酶生成潜力(endogenous thrombin potential,ETP)、最大凝血酶生成量(曲线下面积,area under curve,AUC)、滞后时间(凝血酶产生所需时间)、达到峰值时间(达到凝血酶生成速率最大值所需的时间)和速度指数(凝血酶生成速率)。
(3)测量过程。荧光法测定需要50到120分钟,显色测定法更快,平均需要20分钟。
(4)校准品。Technothrombin校准品是不同稀释度的人凝血酶。Thrombinoscope使用α-2-巨球蛋白(α2M)-凝血酶复合物,TGA不受血浆因素的影响,但是样品中α2M浓度或结构的变化可能会影响读数。BCS系统需使用专有的校准品。
应用Technoclone TGA体系,我们发现TGA主要参数,包括延时(tLag)、峰时(tPeak)、峰值(Peak)、曲线下面积(AUC)均与PT-INR和APTT显著相关(0.61≤r≤0.79)。而且,多元回归分析显示,tLag与tPeak(r=0.91)之间及Peak与AUC(r=0.95)之间高度相关,TGA各参数与常规凝血测试(PT-INR和APTT)显著相关[7]。
2 应用TGA对内源性和外源性凝血系统活化的特异性评价
TG是外源性凝血系统和内源性凝血系统活化的最终产物。外源性凝血系统是血管壁受损后出血管外壁TF暴露于血液,与FVII结合,激活凝血级联反应(图1)。内源性凝血系统(或接触活化途径,contact pathway)是在血管壁完整情况下,凝血因子XII(FXII)、前激肽释放酶(prekallikrein,PK)和高分子量激肽原(high-molecular-weight kininogen,HK)与活化表面结合并形成复合物,激活凝血反应。最初TGA主要用于评估TF激活外源性凝血系统,不适于检测内源性凝血系统活化。为了克服这一缺陷,我们开发了能够评估内源性凝血系统的新的TGA检测方法[8](图1)。内源性凝血系统的主要成分FXII(又称Hageman因子)是FXIIa的酶原。FXII通过Arg353-Val354肽键的裂解形成双链FXIIa而被激活。FXII的激活存在两种主要形式。FXII与带负电荷表面结合,发生构象变化而被活化(自身激活)[8]。另外,激肽释放酶(kallikrein,Kal)裂解FXII使其活化(异源激活)。我们最近发现FXII在凋亡细胞介导的促凝活性中发挥关键作用[8]。利用Technoclone公司TGA仪器,我们开发了评估细胞膜表面磷脂酰丝氨酸(phosphatidylserine,PS)活化内源性凝血系统的检测方法[8],发现凋亡细胞在无TF的情况下显著增强凝血酶生成,后者被膜联蛋白V(annexin V,AxV)显著抑制[8],提示FXII、PK和HK在PS阴离子表面形成复合物而被活化。抑制性抗FXII抗体(C6B7)降低凋亡细胞介导的凝血酶生成,而抗TF抗体无抑制作用。而且,在FXII缺陷血浆中凋亡细胞不能诱导TG,而添加纯化FXII恢复其功能。为了确定PS在凝血酶生成中的作用,我们使用了PS脂质体包被珠(图1),发现PS脂质体同样诱导TG,C6B7抗体显著降低PS诱导的TG[8]。因此,TGA以PS脂质体作为激动剂,可用于评估内源性凝血途径的特异性激活(图1)。过去的研究表明,FXII被各种生物或人工阴离子表面激活,如高岭土、鞣花酸、核苷酸、硫酸盐、糖胺聚糖、错误折叠的蛋白质聚集体、聚磷酸盐和胶原蛋白等。FXII介导凋亡细胞促凝功能的发现为凋亡细胞相关的病理学研究提供了新的见解[9]。
鉴于TGA检测内源性凝血系统活性的敏感性,我们进一步尝试如何在去除内源性凝血系统的影响下,特异地反映外源性凝血系统介导的TG。TF是止血最关键的起动蛋白[10],通常处于非活性(加密)状态[11]。最近的研究表明,蛋白二硫键异构酶(protein disulfide isomerase,PDI)通过氧化二硫键的形成,激活TF[12],但是缺乏直接证据表明PDI通过调控TF增强凝血功能。因此,我们使用TGA判定PDI在TF介导凝血中的作用[13]。首先,我们应用 Technoclone TGA体系发现,脂多糖(lipopolysaccharides,LPS)显著上调外周血单核细胞(peripheral blood mononuclear cell,PBMC)表达TF及凝血酶生成[13]。加入抑制性抗TF抗体4501抑制凝血酶生成,表明PBMC凝血酶生成依赖于TF[13]。用重组野生型PDI预孵育PBMC显著提高凝血酶生成,PDI抑制剂PACMA31降低PBMC的凝血酶生成。此外,与野生型细胞相比,PDI缺陷小鼠骨髓单核细胞介导凝血酶生成降低[13]。上述应用TGA的结果(图1)为PDI调控TF促进外源性凝血系统的关键作用提供了直接证据。此外,我们还发现内皮细胞微粒(microparticles,MPs)增加了凝血酶生成峰并缩短了达峰时间[14]。MP膜表面TF表达和PS暴露均参与微粒的促凝活性[15]。由上可见,基于FVII缺陷和FXI缺陷血浆的TGA检测可以具体评价PS和TF在凝血酶生成中的特异性贡献(图1)。
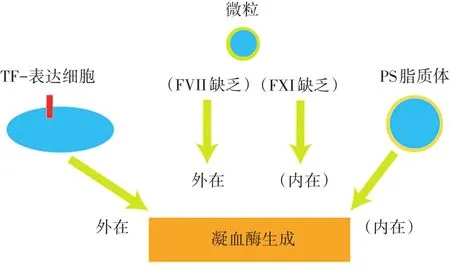
图1 TGA分析不同凝血途径
3 TGA检测在临床应用的现状
3.1 抗凝药物的效果评价 由上述可见,TGA检测不但可以评价血浆整体的凝血活性,而且能够分别检测两条凝血系统的活化水平,并兼具优良的敏感性与特异性,与常规凝血实验相比,TGA检测在评估抗凝药物疗效方面具有优势,在临床应用中越来越广泛。直接口服抗凝剂(如利伐沙班和达比加群等)引起出血,尤其是存在肾损害患者。有研究应用TGA和血栓弹力图(TEG),对接受达比加群(非瓣膜性心房颤动)和利伐沙班(髋关节或膝关节置换术后预防深静脉血栓形成)患者进行了评估[16],发现达比加群显著增加TEG动态参数和TGA的延迟时间,并降低TGA和ETP的峰高。利伐沙班对TEG无影响,但会增加TGA的延迟时间,降低TGA和ETP的峰高。这些结果说明TGA更有助于监测出血效应和设计预防策略。此外,TGA检测有助于评估止血剂(如凝血酶原复合物浓缩物和重组活化FVIIa)逆转异常的凝血酶生成[17]。另一研究发现,阿哌沙班减少房颤患者凝血酶生成,故有助于预防中风[18]。
RASTEN多中心随机3期临床试验研究了新确诊小细胞肺癌(SCLC)患者接受依诺肝素治疗的生存效果[19],通过总TF和TGA评估全身凝血功能,发现TG峰值的升高与总生存期降低显著相关(OS;P=0.03),尤其是重症患者。这项研究表明TG峰值具有评估患者生存和对低分子肝素治疗反应的价值。
3.2 深静脉血栓(DVT)的监测 为了评价TGA在预测静脉血栓栓塞(VTE)危险因素和复发的能力,有前瞻性研究对914名首次VTE患者进行了平均47个月的随访[20]。11%患者出现VTE复发,其凝血酶生成量高于未复发患者(P<0.001)。凝血酶生成小于400nM的患者4年后复发的概率为6.5%(95%CI,4.0%-8.9%),而凝血酶生成大于400nM的患者4年后复发的概率为20.0%(95%CI,14.9%-25.1%)(P<0.001),这些结果说明TGA反映癌症的促凝水平。维也纳癌症和血栓研究(CATS)前瞻观察性队列研究,使用TGA评估新诊断癌症患者或缓解后疾病进展的患者发生血栓形成的风险[21],发现凝血酶峰值升高(定义为凝血酶值≥611nM)患者发生VTE的风险增加,风险比为2.1(95%CI,1.3~3.3;P=0.002)。另一项肺腺癌患者前瞻性研究应用TGA确定,凝血酶生成平均速率指数(mean rate index,MRI)可以作为VTE的危险因素[22]。这些研究表明,TGA在评估癌症凝血系统的活化状态和相关血栓形成的临床风险中具有价值。
3.3 造血系统恶性肿瘤 止血并发症常见于恶性血液病患者。Damien Gheldof等使用TGA研究新诊断白血病患者的细胞外囊泡(EV)对凝血酶生成的影响,评估EV相关的促凝活性(EV-PCA)作为患者血栓并发症的生物标志物[23]。他们发现EV-PCA具有止血并发症(如DIC或血栓形成)标志物的预测价值。另一项对23名接受L-天冬酰胺治疗的急性淋巴细胞白血病患者的研究发现,诱导期的内源性凝血酶生成和凝血酶峰值水平显着高于再诱导期(P<0.001)[24]。Nielson等通过TGA检测发现多发性骨髓瘤患者存在高凝状态,可能是由于较高的TF和促凝磷脂(PPL)活性所致[25]。此外,慢性粒单核细胞白血病患者间充质基质细胞衍生EV比健康供体MSCs产生的凝血酶能力更强[26]。
3.4 血栓形成倾向筛查 TGA在临床筛查血栓性危险因素中也有潜力,特别是因子V Leiden或凝血酶原G20210A突变患者和蛋白S缺乏症患者[27]。当TGA滞后时间相差1.5分钟时可排除因子V Leiden的影响;当凝血酶峰值浓度<426 nmol/L[28]时,可排除凝血酶原G20210A影响。当APC诱导的内源性凝血酶潜力抑制百分比>63%时,可以排除蛋白S缺乏症的影响[28]。此外,在蛋白S缺乏症患者血浆中,凝血酶峰和TGA速度显著升高[29]。
原发性血小板增多症(essential thrombocythemia,ET)和真性红细胞增多症(polycythemia vera,PV)患者血栓并发症的发生率显著增加,尤其是在JAK2V617F阳性患者。与对照组相比,ET和PV患者TG显著升高,而且JAK2V617F阳性患者TG值更高[30]。镰状细胞贫血病(sickle cell disease,SCD)是促血栓形成疾病。Whelihan等发现SCD患者全血TG显著升高,而血浆凝血酶生成却减少[31],全血中表达PS红细胞对SCD的TG具有显著贡献。抗磷脂综合征(APS)患者凝血酶生成增加,表明TGA可用于APS的血栓倾向监测[32]。肝硬化患者的ST-Genesia测定显示高凝状态[33]。
3.5 心血管疾病和贫血性中风 有研究表明血浆TG水平与症状性动脉粥样硬化疾病之间的关联[34]。存在颈动脉斑块[35]或内膜中层厚度增加[36,37]患者TG增加。急性心肌梗死患者TG升高,且至少持续6个月[38]。在老年人中,TG升高与中风发病有关,但与心肌梗死无关[39]。Olson等发现内源性凝血系统依赖性TG是导致缺血性脑卒中的危险因素之一[40],而且凝血因子XII的单核苷酸多态性(SNP)在TG中具有重要性。相反地,Balogun等发现乏血小板血浆TG不适合于检测急性缺血性脑卒中的高凝状态[41]。另一项研究也没有发现ST段抬高型心肌梗死与TG的内源性凝血酶潜力的相关性[42]。因此,虽然“凝血酶越多,血栓形成风险越大”的概念已在VTE研究中得到证实,但凝血酶在动脉粥样硬化血栓形成中的作用尚不明确[43]。可能的原因是与VTE不同,诱发血栓形成的动脉粥样硬化病理变化发生在血管壁组织,而TGA难以检测到动脉壁成分的变化。
4 目前TGA应用存在的问题与未来优化方向
综上所述,与其它凝血检测技术相比,TGA在许多临床疾病研究和评估方面更有应用价值和前景。但是,目前的TGA检测系统仍然存在技术难点和局限性,这些问题的解决将推动TGA在临床实验更广泛的应用和优化,具体有待解决的关键问题如下:
4.1 标准化 虽然这三种商业化TGA检测方法均可以检测患者样本凝血酶的连续生成,但是每种方法在底物、样品制备及处理数据数学公式的不同,导致三者的测量结果之间发生显著差异。因为这三种方法各有优缺点,没有优劣之分,均有待优化之处,因此,迫切需要建立在临床研究中能够可靠地检测、预测和监测凝血障碍的标准化TGA方法,这对于全球多中心临床研究和药物开发临床实验尤其必要。目前,研究者根据个人经验和偏好、实验室要求或与已建立的光谱仪或荧光计的兼容性来选择合适的方法。TGA现在和未来临床适用性取决于控制/标准化变量、检测结果与临床病情的相关性,以及对凝血酶相关的疾病进展机制的认识。如果这些问题能够得到解决,TGA将在临床上得到更广泛和可靠的应用。
4.2 全血样本测量 循环血液中TG涉及血细胞,如血小板和白细胞(尤其是单核细胞和中性粒细胞),但是目前TGA仅使用乏血小板血浆或富血小板血浆样本,因为制备过程耗时,所以无法快速诊断。理想的TGA检测技术是能够采用全血样本[44],这样便能直接可靠地反映体内凝血状态,并建立标准化患者和对照者的血液采集和样本制备。
4.3 触发剂 由于缺乏针对TGA测量条件的标准化触发试剂,例如触发剂的类型和浓度,或者是否使用接触活化抑制剂等,因此很难比较不同临床实验室的数据。目前正在进行几项研究,力图对导致变异的主要原因(如触发剂的来源和浓度)进行标准化,这些研究将有助于减少分析内和分析间的误差,以及不同实验室之间的检测差异。
4.4 样品容器反应杯 通过应用凝血因子缺陷的人和小鼠的血浆,我们发现样品反应杯可以激活血浆接触系统(负责内源性凝血途径的启动)诱导的凝血酶生成。因此我们需要优化样品容器反应杯的材料,并考虑使用接触系统抑制剂,以降低材料所致的凝血系统活化。因为TGA是一个开放的检测系统,所以可以将抗体、蛋白质、酶和多肽等引入分析系统以优化测量条件。
4.5 内皮细胞的源性成分 内皮细胞在体内起着预防凝血的重要作用。未来的TGA技术改进可以考虑在反应中加入内皮细胞的源性成分或使用内皮细胞包被的样品试管,这一改进有望提升血栓形成的整体评估的价值。
4.6 温度 多项研究表明,导致天数间或室间结果变异的主要原因之一是血浆样品的温度,包括制备乏血小板血浆的离心温度、TG仪器测量的温度[45]。温度的标准化将有助于减少检测的变异。
TGA的标准化和准确性是其在临床应用的必要条件。目前国际血栓与止血学会-科学和标准化委员会(ISTH-SSC)正在制定TGA标准化的指南和建议,尽量减少实验室之间的差异,规范触发剂的使用标准化,例如不同来源的磷脂、不同品牌的组织因子等。同时,制造商还需要帮助研究人员制定更精确的临床样本检测程序。
5 结 论
TGA已成为最可靠的凝血活化测量方法。它可以评估不同内源性和外源性凝血途径诱导的凝血酶生成。由于其广泛的临床应用,目前迫切需要一种能够可靠地检测、预测和监测凝血功能障碍的全球性标准化检测方法,以达到更精确地反映体内凝血状态。
作者贡献声明武艺、鲁翌、叶絮、刘烁撰写文章;武艺负责整体设计和校正
利益冲突所有作者均声明不存在利益冲突
缩略表
凝血酶生成实验,TGA;校准的自动血栓形成图,CAT;血栓弹力图,TEG;凝血酶原时间,PT;活化部分促凝血酶原激酶时间,APTT;贫血小板血浆,PPP;富血小板血浆,PRP;组织因子,TF;因子XII,FXII;前激肽释放酶,PK;高分子量激肽原,HK;镰状细胞贫血病,SCD;静脉血栓栓塞症,VTE。

