《血管性血友病因子多聚体组装和WP小体储存的结构机制》解读*
梁茜(Liang Qian),王学锋(Wang Xue-feng)
(上海交通大学医学院附属瑞金医院检验科,上海200025;Department of Laboratory Medicine,Ruijin Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200025,China)
【编者按】本文于2022年6月发表于《Blood》杂志,发表后引起业内广泛关注,在Blood Podcast(Episode 22 Season 3,https://ashpublications.org/blood/pages/blood_podcast)和《JTH》杂志What The Neighbors Say栏目(J Thromb Haemost,2022,20:1036)重点介绍。本文文章题录为:Zeng JW,Shu ZM,Liang Q,Zhang J,Wu WM,Wang XF,Zhou AW. Structural basis of Von Willebrand Factor multimerization and tubular storage,Blood,2022 Jun 2;139(22):3314-3324.该研究首次通过单颗粒冷冻电镜技术获得了高分辨率的由VWF N端结构域(D1D2D’D3结构域)形成的管状多聚体结构,揭示了VWF多聚体组装和Weibel-Palade小体储存的结构机制。该理论不仅解开了VWF多聚体组装和储存机制的谜团,也为2A型血管性血友病(VWD)患者基因治疗新策略奠定了理论基础。经通信作者许可,再次通过佳文解读的方式来阐述这一发现。
1 研究背景
血管性血友病因子(von Willebrand factor,VWF)由内皮细胞及巨核细胞合成,可介导血小板粘附于受损内皮下暴露的胶原,也是凝血因子Ⅷ的保护性载体。VWF多聚体是血循环中分子量最大的蛋白成分,只有高分子量VWF多聚体才具备生物学功能[1-3]。VWF多聚体组装障碍可导致2A型血管性血友病(von Willebrand disease,VWD)[4]。VWF蛋白由2813个氨基酸组成,其结构域以D1-D2-D’-D3-A1-A2-A3-D4-C1-C2-C3-C4-C5-C6-CK顺序排列,包括22个氨基酸组成的信号肽、741个氨基酸组成的前肽(D1-D2结构域)以及2050个氨基酸组成的成熟VWF蛋白(D’-CK结构域)。VWF单体在内质网中(中性环境)通过CK结构域的分子间二硫键形成“尾尾相连”的二聚体,随后该二聚体在高尔基体内(弱酸性环境)以D3结构域分子间二硫键进一步形成“头头相连”的多聚体[5-7]。一部分VWF多聚体能够以基础分泌的形式直接分泌进入血浆,另一部分则堆积成有序的管状结构且进一步压缩组装成超大分子量VWF多聚体储存于Weibel-Palade小体(WP小体)中,以调节性胞吐的形式分泌进入血循环中。
虽然VWF前肽(D1D2结构域)会在VWF蛋白分泌入血浆后与VWF多聚体分离,但是其对于胞内VWF多聚体组装及WP小体储存均至关重要。前肽区域突变或缺失均可导致VWF多聚体组装及WP小体储存障碍[8-9]。此外,体外研究表明,VWF前肽与成熟VWF蛋白分别在两个单独的质粒上表达也可以促进VWF多聚体组装,提示VWF前肽无需与成熟VWF蛋白在物理上相连也可发挥作用[8]。但是,VWF前肽参与VWF多聚体组装及WP小体储存过程的具体作用机制以及VWF多聚体组装与WP小体形成之间的关联尚未完全阐明。
近几年,冷冻电镜和图像处理技术飞速发展,为我们“看清”生物大分子结构和作用方式提供了强有力的手段。上海交通大学医学院附属瑞金医院王学锋课题组从事出血病和血栓病的基础与临床研究已60余年,累积了丰富的VWD临床病例资料,为科学研究提供了精确的切入点和强有力的支撑。借助上海交通大学医学院周爱武和清华大学曾建伟课题组在结构生物学研究领域的实验技术平台,共同解析了高分辨率的由VWF N端结构域(D1D2D’D3结构域)形成的管状多聚体结构,阐明了VWF多聚体组装和WP小体储存的结构机制。该工作不仅提高了我们对VWF多聚体组装机制的认识,也为因VWF前肽突变导致的2A型VWD患者基因治疗提供了新策略。
2 研究概述
2.1 研究路线
作者借助先进的单颗粒冷冻电镜技术,通过高分辨率结构解析,阐明了VWF前肽在VWF多聚体组装和WP小体形成过程的作用机制。作者对不同条件下(包括不同pH、加入或不加入CaCl2、不同反应温度和反应时间)反应后的VWF D1D2二聚体和D1D2-D’D3二聚体复合物进行负染,并对质量合格的样品进行冷冻样品的制备。本研究解析的所有蛋白结构均为弱酸性条件下形成(20mM MES pH6.0、100 mM NaCl、10 mM CaCl2),VWF前肽与D’D3二聚体形成管状结构的反应条件为pH6.0、10 mM CaCl2、4℃反应8分钟至过夜。利用Talos Arctica 200 kV电子显微镜确认冷冻样品质量,并通过Titan Krios G3i 300 kV冷冻透射电镜进行数据收集。经多轮的2D分类、3D分类和优化,获得高分辨率的VWF管状多聚体结构。此外,作者还通过一系列生化实验和结构分析阐明并验证了VWF前肽突变的分子致病机制。
2.1.1 冷冻电镜解析的VWF分子头部片段(D1D2D’D3结构域)形成的管状结构
经冷冻电镜结构解析,VWF管状结构由多个重复单元组成,图1B、1F和1G分别是一个、两个和八个重复单元结构示意图。两个重复单元之间通过D2:D2相互作用界面相连。每个重复单元包括一个“甜甜圈样”D1D2二聚体和一个D’D3二聚体(图1B-E)。每个D1D2单体呈拱形,D1和D2结构域之间由D1结构域的TIL-1和E1模块衔接(“摇篮”结构),两个D1D2分子通过D1:D2间相互作用形成二聚体。两个D’D3分子分别嵌入“摇篮”结构并面对面摆放,形成两对分子间二硫键(Cys1097-Cys1097’和Cys1142-Cys1142’)而组装成多聚体。两个重复单元之间通过D2:D2作用界面相连。每个重复单元以右手螺旋方式沿纵轴旋转86.8°、上升29.4 Å堆积形成“圆筒刷子样”管状结构。VWF前肽组成管状结构的内层,D’D3组成管状结构的外层。该管状结构的内径为11 nm,外径为28 nm(图2)。
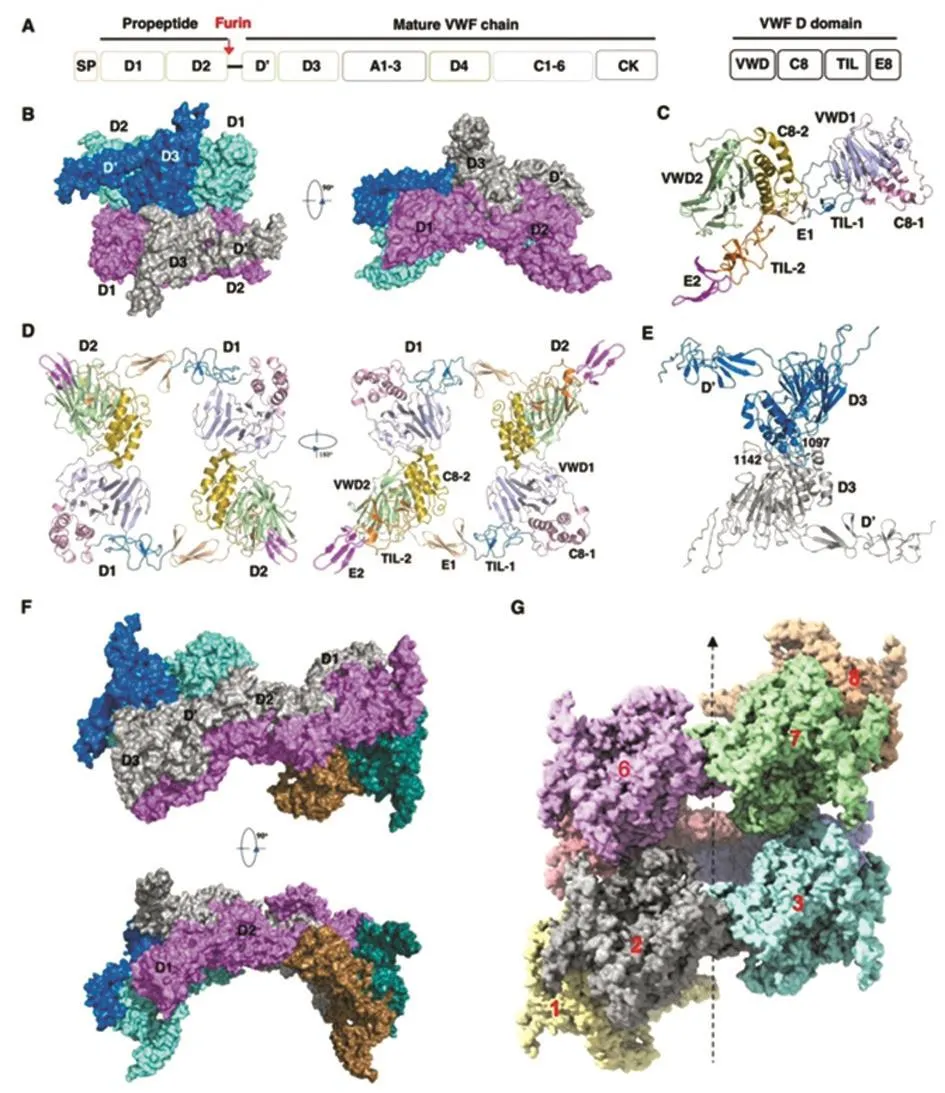
图1 冷冻电镜解析的VWF管状结构重复单元

图2 VWF蛋白形成的管状结构组装模型
2.1.2 VWF管状结构中VWF分子间相互作用界面分析
参与VWF分子管状结构形成的相互作用界面主要有5个(图3),包括:①D2:D2结合面,主要有His460参与;②D1D2:D’D3结合面,D’结构域主要通过His831与D2结构域中Glu543相互作用;③D1:D2结合面,主要有His395参与;④D3:D3结合面,主要有Cys1097和Cys1142参与,形成分子间二硫键;⑤D1:D1结合面,VWF分子间纵向相互作用力,主要由D1结构域的His288与Glu333间相互作用介导。
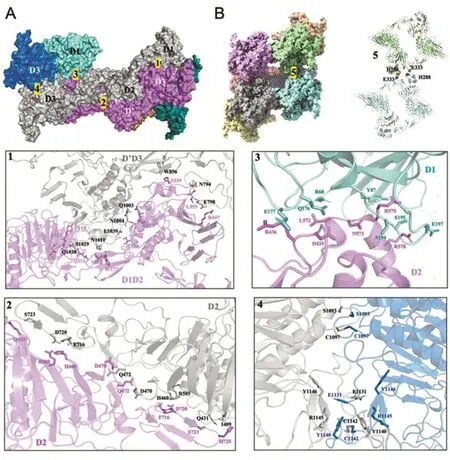
图3 VWF管状结构相互作用界面分析
2.1.3 弱酸性环境下VWF前肽二聚体结构
VWF分子头部片段(D1D2D’D3结构域)形成的管状结构解析明确了VWF分子间相互作用的最终状态,但其具体的步骤仍不得而知。比如,VWF前肽分子间D1:D2相互作用和D2:D2相互作用是孰先孰后仍不明了(图4A)。为了进一步明确VWF管状结构形成的始动环节,作者进一步解析了弱酸性环境下VWF前肽(D1D2结构域)二聚体的冷冻电镜结构(图4B)。结果显示,VWF前肽二聚体为分子间D2:D2相互作用形成的“飞梭状”结构,提示该结构是弱酸性条件下VWF前肽结构变换的第一步。由于组氨酸对pH变化比较敏感,中性条件下不带电,在酸性环境中会发生质子化带正电,可能是诱导VWF前肽在酸性环境下相互作用的重要因素。作者对VWF分子管状结构形成过程参与分子间/分子内相互作用的所有组氨酸进行了详细分析,结果表明,在D1:D2和D1D2:D’D3相互作用界面无组氨酸参与,D2结构域VWD2模块内His460质子化后可与另一个D2分子E2模块的Asp720和Phe716形成分子间盐桥,稳定分子间D2:D2相互作用(图4E);同时,D2结构域VWD2模块的His395质子化后可与C8-2模块的Asp611形成分子内盐桥,稳定D2结构域的内部堆积作用(图4CD)。此外,在D1:D1纵向相互作用中,His288质子化后可与另一个分子D1结构域的Glu333发生离子相互作用,稳定VWF管状结构在纵向上的堆积。
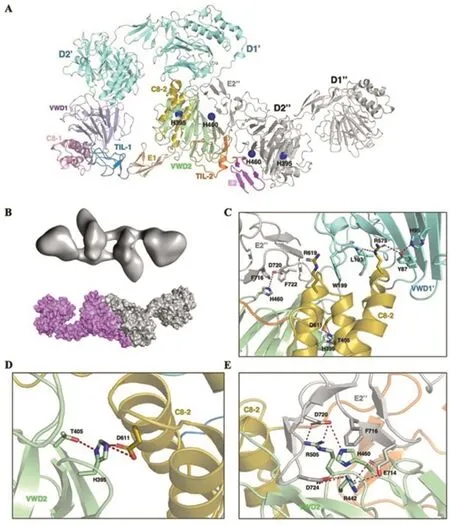
图4 弱酸性环境诱导的VWF前肽同源二聚体结构
2.1.4 VWF前肽在VWF多聚体组装和WP小体形成过程的模板机制
基于弱酸性条件下VWF前肽二聚体结构以及VWF分子头部片段(D1D2D’D3结构域)形成的管状结构,作者提出了VWF前肽在VWF多聚体组装和WP小体储存过程的模板机制(图5)。当VWF二聚体由内质网进入高尔基体后,细胞器内环境由中性变为弱酸性,VWF前肽组氨酸发生质子化带正电,VWF二聚体头部因分子间D2:D2相互作用形成闭合的VWF前体二聚体(Step i)。随后,VWF前肽二聚体可作为模板招募两个D’D3分子分别嵌入“摇篮”结构内形成相互缠绕的D1D2D’D3二聚体(最小重复单元)(Step ii)。此重复单元借助前肽分子间D1:D2相互作用使D1D2D’D3二聚体以右手螺旋方式紧密排列堆积形成管状结构(Step iii)。与此同时,D1D2D’D3二聚体的有序堆积使不同D1D2D’D3二聚体上的D3结构域在空间上彼此靠近并形成分子间二硫键,最终组装成管状多聚体(Step iv)。因此,无论是VWF多聚体组装还是WP小体形成,均由弱酸性环境下VWF前肽二聚体形成所启动,VWF前肽二聚体不仅为D3结构域分子间二硫键形成(多聚体组装)创造了条件,同时也促进了VWF分子有序堆积并形成管状结构而储存。
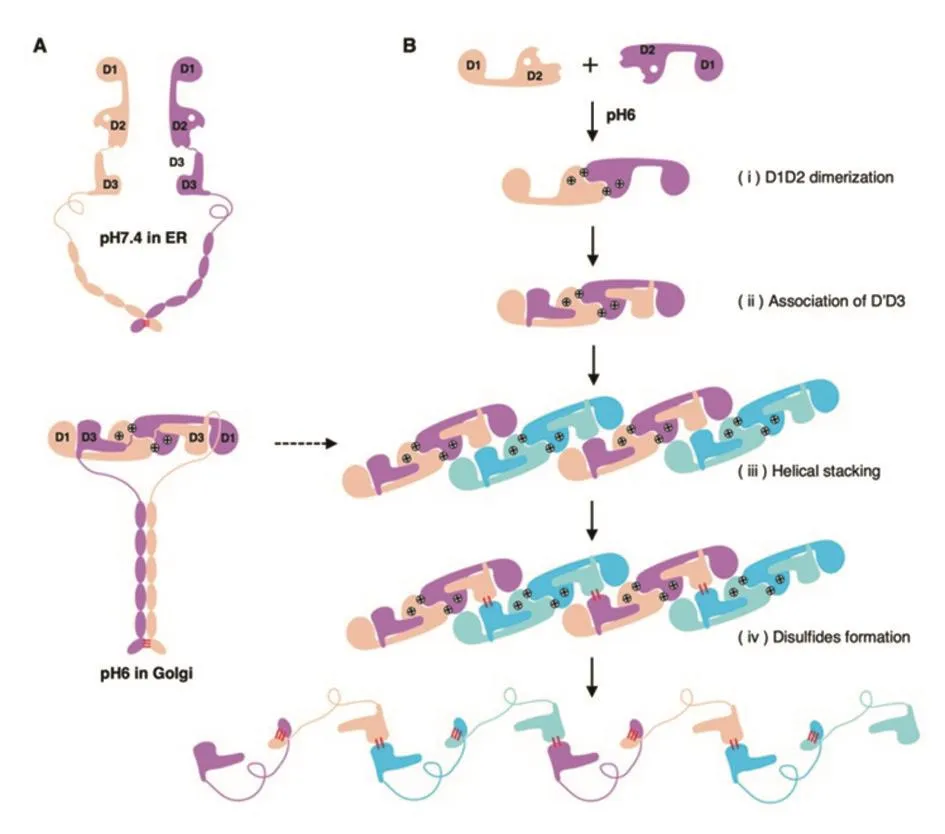
图5 VWF前肽在VWF多聚体组装和WP小体形成过程的模板机制
2.1.5 临床上VWF前肽突变导致2A型VWD的分子致病机制
VWF前肽突变可因VWF多聚体组装障碍而导致2A型VWD。从蛋白结构分析,临床数据库中已报道的2A型VWD致病突变通过破坏分子内部堆积作用和/或分子间相互作用界面影响VWF多聚体组装的不同步骤,最终导致血浆中高分子量VWF多聚体选择性减少。比如,D1结构域Tyr87Ser突变可能通过影响与另一分子D2结构域的Arg575位点相互作用而影响Step iii[10];瑞金医院先前报道的VWF 8号外显子缺失突变(因剪切位点突变c.875-5T>G导致的8号外显子跳跃)则由于缺失了大部分D1结构域的TIL1模块,影响了D’D3结构域的嵌入(Step ii)[11]。体外生化实验也进一步证实了Tyr87Ser突变型VWF前肽与D’D3结合能力与野生型无显著差异,而8号外显子缺失突变型VWF前肽与D’D3结构域的结合能力显著减弱。该团队提出的VWF前肽在VWF多聚体组装和WP小体形成过程的模板机制可为VWF前肽突变导致2A型VWD的致病机制提供合理的解释。同时,临床患者的突变也反向证实了该理论的准确性。
2.2 研究意义
本研究证实了VWF分子由中性环境的内质网进入弱酸性环境的高尔基体后,VWF前肽相当于一个对pH变化极其敏感的开关,通过形成同源二聚体为VWF多聚体组装及WP小体储存提供模板,启动并促进管状结构形成和VWF多聚化。基于本研究对弱酸性环境下高分辨率的VWF前肽二聚体以及VWF管状结构冷冻电镜结构解析,揭示了VWF前肽在VWF多聚体组装和WP小体储存过程的模板机制。依赖于VWF前肽分子间相互作用的重复单元的有序堆积不以D3结构域分子间二硫键形成(VWF多聚体组装)为前提;相反,重复单元的有序堆积为D3结构域分子间二硫键形成和VWF进一步多聚化创造了条件。本研究显著提高了我们对VWF多聚体组装和WP小体储存机制的认知。
基因治疗是治愈遗传性疾病的唯一手段。目前,国际上有少量研究报道通过病毒载体转导野生型全长VWF基因可提升VWF敲除小鼠的血浆VWF水平,但治疗效果极为有限[12-15]。全长VWF基因长达8 kb以上,病毒载体的容量限制是影响VWD基因治疗效果的主要障碍之一[16-18]。基于之前已报道的VWF前肽无需与成熟VWF蛋白在物理上相连也可以促进VWF多聚体组装和本研究阐明的VWF前肽在多聚体组装和WP小体形成过程的模板机制,提示外源性导入野生型前肽或许可与体内突变的VWF前肽竞争,替换突变的VWF前肽,为体内异常的VWF分子多聚体组装提供正确的模板,从而纠正VWF突变体的多聚体组装障碍。该设想在既往研究的细胞实验中(VWF前肽437-442位氨基酸缺失突变,破坏D2:D2相互作用)已初步得到证实[19]。VWF前肽全长2.3 kb,完全满足腺相关病毒包装条件,可参照血友病A基因治疗的方法,通过特异性启动子使VWF前肽在内皮细胞中长期特异表达而纠正VWF前肽突变相关2A型VWD患者的多聚体组装障碍,为2A型VWD患者基因治疗带来曙光。
作者贡献声明梁茜负责撰写文章;王学锋负责修改文章语言并监督此项目
利益冲突所有作者均声明不存在利益冲突

