雨生红球藻蛋白酶解产物的制备和抗氧化活性评价
何宛诗,许 瑾,曹 庸,王忠铭,刘晓娟,
(1.中国科学院广州能源研究所,广东省新能源和可再生能源研究开发与应用重点实验室,广东广州 510640;2.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642)
雨生红球藻()是一种单细胞绿藻,被认为是继螺旋藻、小球藻之后的又一高经济价值微藻,2010 年被国家卫生和计划生育委员会批准为新食品原料,富含虾青素、多糖、蛋白质、维生素和微量元素等营养成分。为解决全球对“超级抗氧化剂”虾青素的庞大需求,国内外许多微藻企业为量产虾青素规模化养殖雨生红球藻,绿A 微藻养殖基地年产雨生红球藻粉可达10 吨以上,中国已成为世界雨生红球藻虾青素市场的产能大国。然而,提取完虾青素后产生了大量的工业藻渣,大多作为动物饲料或被直接丢弃,造成环境污染和资源浪费。作为微藻资源,雨生红球藻渣中营养成分丰富,其中蛋白质含量为20.8%~22.2%。截止目前,藻渣蛋白的加工性质已有相关研究,但蛋白质及蛋白质相关产品的功能活性研究仍有待进一步完善。
微藻具有健康效益,螺旋藻、小球藻等被称为“潜在的益生元”,因此微藻作为新型膳食补充剂的研究受到广泛关注。微藻中蛋白含量丰富,如小球藻和斜生栅藻分别含有51%~58%和50%~56%蛋白质,是一类潜在的、可利用的可再生蛋白资源。微藻蛋白的研究主要分为两个方向:其一是探究蛋白质本身的结构组成和功能性质等;其二是研究蛋白酶解物及多肽的生理活性。研究表明,微藻蛋白酶解物显示多种生理功能,如抗氧化、抗高血压、抗炎活性等,经纯化的微藻多肽还具有较强的抗癌和抗菌等活性,有成为功能性食品、营养品或药物的潜力,研究前景广阔。Norzagaray 等对杜氏盐藻等三种绿藻藻渣进行蛋白酶解,酶解物的抗氧化活性显著高于藻渣,对ABTS 和DPPH 自由基有较高的清除能力,且其对弹性蛋白酶的抑制作用暗示了其抗衰老的潜能。不同蛋白酶作用下的小球藻多肽在体外显示较强的DPPH、羟自由基清除能力和还原力,并能降低Bel7402 人肝癌细胞的ROS 水平,增强秀丽隐杆线虫抗HO的作用以及老龄小鼠血清中抗氧化酶的活力。
目前雨生红球藻的研究关注点主要停留在虾青素,对其蛋白酶解物的探究有限。有研究表明,不同蛋白酶作用下雨生红球藻酶解物的抗氧化能力不同,疏水性、含硫和芳香族氨基酸的含量、随机线圈、-折叠的占比均比原蛋白要高,这些在组成和结构上的特点很可能与其强抗氧化能力相关。因此,本研究以雨生红球藻渣为原料,通过单因素实验、响应面优化开发制备抗氧化酶解物,以体外抗氧化活性和氨基酸组成予以评价,可为雨生红球藻渣的高值化利用及后续研究提供参考价值,使藻渣“变废为宝”,提高经济价值,为藻源天然抗氧化剂的开发提供新途径。
1 材料与方法
1.1 材料与仪器
雨生红球藻渣 荆州天然虾青素有限公司提供;碱性蛋白酶(200000 U/g)、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,98%) 上海源叶生物科技有限公司;木瓜蛋白酶(≥1000000 U/g) 上海蓝季科技发展有限公司;胰蛋白酶(250000 U/g) 北京拜尔迪生物技术有限公司;胃蛋白酶(≥500000 U/g)Sigma-aldrich 上海贸易有限公司;邻苯二甲醛(OPA,98%)、二硫苏糖醇(DTT,≥98%)、L-亮氨酸(99%) 上海易恩化学技术有限公司;四硼酸钠(≥99.5%)、十二烷基硫酸钠(SDS,92.5-100.5%) 天津市大茂化学试剂厂;总抗氧化能力(T-AOC)FRAP法试剂盒 苏州格锐思生物科技有限公司;七水合硫酸铁(FeSO·7HO)标准品 南京建成科技有限公司;其他试剂均为分析纯。
AL104 天平 梅特勒-托利多公司;PB-10 pH计 赛多利斯科学仪器(北京)有限公司;HSJ-2A 磁力水浴锅 常州澳华仪器有限公司;Avanti J-E 落地式高速大容量离心机 美国贝克曼库尔特有限公司;ALPHA 2-4 LDplus 冷冻干燥机 国Marin Christ公司;多功能酶标仪 PerkinElmer EnSpire; rapid N exceed 杜马斯快速定氮分析仪 德国Elementar 公司;855-4507 磺酸型阳离子树脂分离柱 日本日立公司;L-8900 全自动氨基酸分析仪 日本日立公司。
1.2 实验方法
1.2.1 雨生红球藻渣蛋白的酶解工艺 蛋白提取参考Zhu 等、邱月的方法,并稍作修改。取5.0 g的雨生红球藻渣按料液比1:20 溶解于0.05 mol/L磷酸缓冲液中,加碱调节pH 至11.5,在56 ℃下水浴加热30 min,期间保持搅拌状态。4000 r/min 离心15 min 后,将上清液pH 调至4.2,在4 ℃下静置过夜。8000×g 离心15 min 后弃上清,将蛋白溶液pH 调至中性,冷冻干燥后获得雨生红球藻蛋白。用蒸馏水复溶藻蛋白,将pH 调至所用蛋白酶的最适pH,加入一定量的蛋白酶进行酶解反应。酶解结束后,将酶解物于沸水中加热10 min 灭酶活,冰浴15 min 后离心(6000 r/min,20 min),除去沉淀物后获得蛋白酶解液。
1.2.2 蛋白酶筛选 将雨生红球藻蛋白用蒸馏水配制为底物浓度5%的蛋白溶液,以碱性蛋白酶、木瓜蛋白酶、胰蛋白酶和胃蛋白酶为水解用酶,将pH 调至四种酶的最适pH,加入0.3%(w:w)的酶,并于最适温度中酶解1 h。酶解上清液用于测定各蛋白酶解物的ABTS 清除率和水解度,筛选最优水解酶。各蛋白酶最适水解条件见表1。
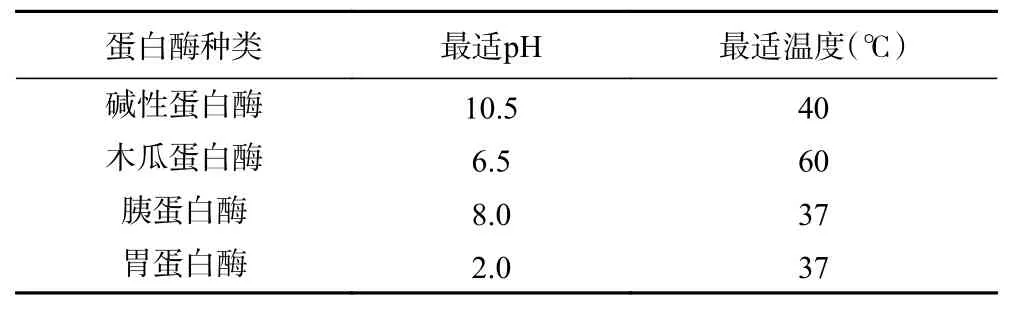
表1 不同蛋白酶的最适反应条件Table 1 The optimum reaction conditions of different proteases
1.2.3 单因素实验 以底物浓度、加酶量、温度、pH、时间作为实验因素,按下述描述分别进行酶解单因素实验。酶解结束后,将酶解物于沸水中加热10 min 灭酶活,冰浴15 min 后离心(6000 r/min,20 min),上清液用于分析各因素对酶解物的ABTS自由基清除率和水解度的影响。
1.2.3.1 底物浓度对酶解物的影响 将雨生红球藻蛋白用蒸馏水配制成底物浓度为1%、3%、5%、7%、9%的蛋白溶液,将pH 调至10.5,加入0.3%(w:w)的酶,在40 ℃下酶解3 h。
1.2.3.2 加酶量对酶解物的影响 将雨生红球藻蛋白用蒸馏水配制成底物浓度为5%的蛋白溶液,将pH 调至10.5,分别加入0.1%、0.3%、0.5%、0.7%、1.0%(w:w)的酶,在40 ℃下酶解3 h。
1.2.3.3 温度对酶解物的影响 将雨生红球藻蛋白用蒸馏水配制成底物浓度为5%的蛋白溶液,将pH调至10.5,加入0.3%(w:w)的酶,在30、35、40、45、50 ℃下酶解3 h。
1.2.3.4 pH 对酶解物的影响 将雨生红球藻蛋白用蒸馏水配制成底物浓度为5%的蛋白溶液,将pH 调至7.0、8.0、9.5、10.5、11.5,加入0.3%(w:w)的酶,在40 ℃下酶解3 h。
1.2.3.5 时间对酶解物的影响 将雨生红球藻蛋白用蒸馏水配制成底物浓度为5%的蛋白溶液,将pH 调至10.5,加入0.3%(w:w)的酶,在40 ℃下酶解1、2、3、4、5 h。
1.2.4 响应面优化试验 根据单因素实验的结果,选择温度、pH 和时间为影响因素,以ABTS 清除率为响应值,采用Design-Expert V8.0.6.1 设计三因素三水平的响应面分析试验。试验因素及水平见表2。
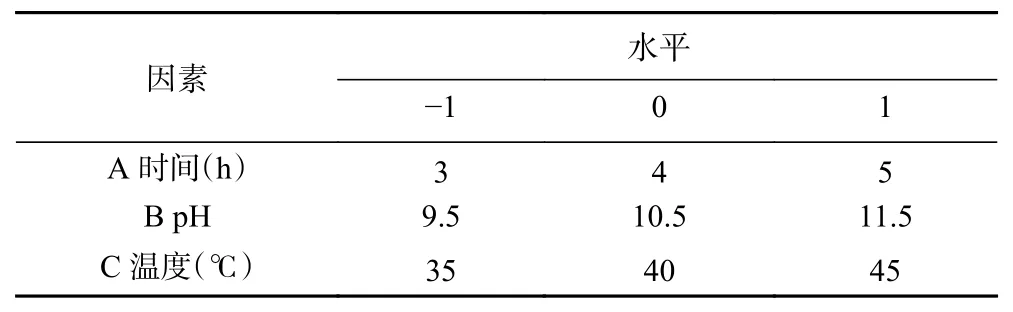
表2 响应面试验因素水平表Table 2 Factors and levels of response surface analysis
1.2.5 最优条件酶解物的抗氧化活性评价 各取10 mg 雨生红球藻蛋白与最优酶解物的冻干样,用蒸馏水溶解为10 mg/mL 的溶液,并按比例稀释成各浓度的样品溶液。通过抗氧化指标的测定,对比酶解底物与酶解产物的ABTS 自由基IC和FRAP 值。
1.2.6 水解度的测定 水解度参照Nielsen 等的OPA 法进行测定,并稍作修改。
1.2.6.1 L-亮氨酸标准曲线制作 准确称取0.10 g干燥的L-亮氨酸,用蒸馏水溶解并定容到50 mL,此时溶液的浓度为2.0 mg/mL。然后从该溶液中分别吸取0、0.2、0.4、0.6、0.8、1.0、1.2 mL,用蒸馏水定容至25 mL,制成L-亮氨酸标准溶液。
1.2.6.2 OPA 工作液的配制 将7.620 g 四硼酸钠和200 mg SDS 溶解至150 mL 蒸馏水中,将160 mg OPA 于黑暗避光处溶解至4 mL 乙醇,二者混合后加入176 mg DTT,最后用蒸馏水在棕色容量瓶定容至200 mL,制得OPA 工作液。
1.2.6.3 水解度的测定 将400 μL L-亮氨酸标准溶液加入到3 mL OPA 工作液中,室温下孵育2 min后,吸取200 μL 在96 孔酶标板并在340 nm 波长下测定吸光度。蛋白酶解物的水解度测定同上,所得吸光度对应标准曲线计算酶解物中游离氨基酸的含量(C,g/mL)。
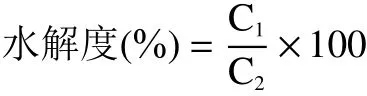
式中:C表示酶解物的游离氨基酸含量,g/mL;C表示底物的蛋白含量,由杜马斯燃烧法测定,0.1594 g/mL。
1.2.7 抗氧化活性测定
1.2.7.1 ABTS 自由基清除率测定 ABTS 自由基清除率的测定参照Norzagaray 等的方法,并稍作修改。ABTS 储备液(终浓度为7 mmol/L ABTS 和2.45 mmol/L 过硫酸钾)在室温、避光环境中静置过夜,使用前用0.01 mol/L 磷酸缓冲液(pH7.4)稀释成工作液,使其在734 nm 波长处的吸光度为0.70±0.05。测定时,将酶解物稀释160 倍,在96 孔板中加入ABTS 工作液100 μL 和样液100 μL,振荡混匀,室温避光处放置10 min 后在734 nm 处测定吸光度(A),同时以ABTS 工作液100 μL+蒸馏水100 μL为空白(A),磷酸缓冲液 100 μL+样液100 μL 为对照(A)。该法可测定样品对ABTS 自由基的清除能力,颜色越浅则代表清除能力越强。

式中:A表示空白组的吸光值;A表示酶解物的吸光值;A表示对照组的吸光值。
1.2.7.2 FRAP 能力测定 FRAP 能力测定参照总抗氧化能力试剂盒说明书进行,并稍作修改。在避光条件下,吸取TPTZ 溶液975 μL 与TPTZ 稀释液9750 μL混合后,加入检测缓冲液975 μL 均匀混合,制成FRAP工作液,使用前37 ℃预温,现配现用。在96 孔板中依次加入30 μL FeSO·7HO 标准溶液(浓度为0、0.2、0.3、0.6、0.9 和1.2 mmol/L)和170 μL FRAP 工作液,振荡混匀后在室温下避光反应10 min,于593 nm 波长处测定吸光度。样液测定同上,样品的FRAP 值以达到相同吸光度所需FeSO的浓度表示。该法可测定样品对三价铁离子的还原能力,颜色越深则代表还原能力越强。
1.2.8 抗氧化酶解物的氨基酸组成分析 按照GB 5009.124-2016 的方法,对最优酶解物进行前处理和上样测定。酸水解过程中色氨酸完全被破坏,蛋氨酸和胱氨酸部分被破坏。氨基酸组成分析采用全自动氨基酸分析仪进行,具体上样检测的条件为:色谱柱采用磺酸型阳离子树脂分离柱(4.6 mm×60 mm),进样量20 μL;检测器为钨灯检测器;流动相采用柠檬酸(锂)PF 缓冲液,流速:洗脱泵0.35 mL/min,衍生泵0.30 mL/min;反应柱温:135 ℃;检测波长通道1为570 nm,通道2 为440 nm。
1.3 数据处理
实验均采用3 次平行处理,数据均采用平均值±标准差(mean±SD)表示,采用SPSS 22.0 统计软件进行数据处理,不同处理组之间的差异用多重比较分析(LSD)、单因素方差分析(One-way analysis of variance,One-way ANOVA)进行处理,<0.05 表示差异显著。
2 结果与分析
2.1 蛋白酶筛选
蛋白酶种类对雨生红球藻蛋白酶解物的ABTS清除能力和水解度的影响如图1 所示。各酶解物的抗氧化能力顺序为:碱性蛋白酶>胰蛋白酶>木瓜蛋白酶>胃蛋白酶,各酶之间存在显著性差异(<0.05),碱性蛋白酶解物的ABTS 自由基清除率达51.58%±0.66%。且碱性蛋白酶解物中游离氨基酸含量相对最低,水解度显著低于另外三种酶解物(0.05)。
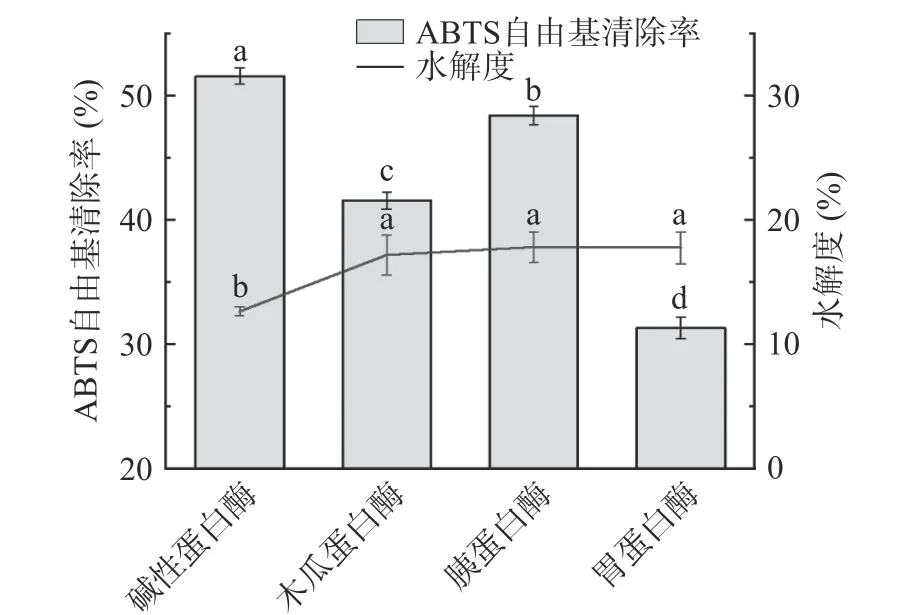
图1 不同蛋白酶对酶解物ABTS 自由基清除率和水解度的影响Fig.1 Effect of different proteases on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
碱性蛋白酶是一种具广泛选择性和特异性的内切酶,对蛋白质羧基侧的疏水性氨基酸和芳香族氨基酸具有较强的专一性,倾向于剪切Glu、Met、Leu、Tyr、Lys 和 Gln 的肽键,比其它酶更容易产生强抗氧化的疏水性多肽,而雨生红球藻中富含这些氨基酸。另外,该酶的一个重要应用就是水解植物残渣的残留蛋白质,如果皮、果核等,酶解产物的自由基清除能力显著高于胰蛋白酶、木瓜蛋白酶等,与本研究结果一致,且在较宽的pH 范围内显示出优异的蛋白质溶解性。马艳芳发现螺旋藻经过碱性蛋白酶作用的水解物DPPH 自由基清除能力优于木瓜蛋白酶、风味蛋白酶和胰蛋白酶的产物。也有学者采用含碱性蛋白酶的复合酶来水解微藻,充分发挥协同作用。
水解度是常用于体现酶解程度的指标,定义为被蛋白酶作用断裂的肽键的占比。理论上,高水解度、低分子量的肽会有更高的抗氧化活性,因为蛋白质酶解程度增加会生成许多小分子肽和游离氨基酸,伴随着可电离基团(NH和COO)增多,同时在分子结构上疏水区域逐渐暴露,这些变化都可能增加酶解物的抗氧化活性。但是,近年来越来越多学者发现,水解度并不是决定酶解物抗氧化活性的主要因素,它与自由基清除率并非简单的线性关系,不存在明显的相关关系。酶解反应实质上是抗氧化肽不断形成和分解的过程,过度水解可能会破坏肽链中原本能发挥功能活性的区域。酶解物的综合活性还与肽链特殊空间结构、氨基酸序列等多种因素有关,水解度仅是判断产物抗氧化能力的辅助指标。综合考虑后选择碱性蛋白酶作为实验用酶。
2.2 单因素实验
2.2.1 底物浓度对酶解物ABTS 自由基清除率和水解度的影响 不同底物浓度对雨生红球藻蛋白酶解物的ABTS 自由基清除能力和水解度的影响如图2所示。在抗氧化活性方面,酶解物的ABTS 清除能力随底物浓度增加而增加,9%浓度的清除能力显著高于其他组别(0.05),清除率达84.67%±0.85%。在酶解程度方面,各浓度的水解度无显著差异(>0.05)。酶解物底物浓度在合适范围内(0%~10%)增加,底物与酶结合的位点随之增多,产生更多抗氧化能力强的物质,浓度过大会抑制产物的活性,研究显示在制备鹿血酶解物和螺旋藻肽时,分别在底物浓度9%和10%的水平下抗氧化能力达到峰值。因此选择底物浓度9%的水平进行响应面优化试验。

图2 底物浓度对酶解物ABTS 自由基清除率和水解度的影响Fig.2 Effect of substrate concentrations on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.2 加酶量对酶解物ABTS 自由基清除率和水解度的影响 不同加酶量对雨生红球藻蛋白酶解物的ABTS 自由基清除能力和水解度的影响如图3 所示。在抗氧化活性方面,加酶量在0.7%之前,酶解物ABTS自由基清除能力随加酶量加大而增强,0.7%加酶量的酶解效果最佳,清除率达72.56%±1.02%,之后则开始减弱;水解度也呈现出相似的趋势,在同一点达到最大值。随加酶量增大,自由基清除率和水解度反而减弱的原因可能是,产物与酶在酶过量时会形成复合物,阻碍底物与酶的结合,从而抑制了酶解作用。从经济成本和环境保护的角度综合考虑,应选择用量少、抗氧化效果最高的水平进行实验,因此响应面优化试验选择加酶量0.7%水平。
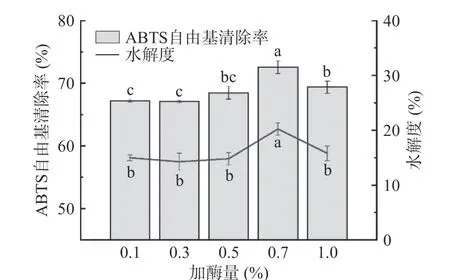
图3 加酶量对酶解物ABTS 自由基清除率和水解度的影响Fig.3 Effect of dosage of proteases on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.3 温度对酶解物ABTS 自由基清除率和水解度的影响 不同温度对雨生红球藻蛋白酶解物的ABTS自由基清除能力和水解度的影响如图4 所示。当温度达到45 ℃前,ABTS 自由基清除率随温度增加而呈现先升高后减弱的趋势,在40 ℃达到最大值,清除率达67.12%±0.22%,温度大于45 ℃后清除率回升。过高温下产物抗氧化能力回升的结果也曾出现在其它研究中,具体原因还未查明,可能是该温度可激活另一个抗氧化酶切位点。当温度大于30 ℃时,酶解物水解度与30 ℃相比显著降低(0.05),且随着温度的增加水解度无显著变化(0.05)。原因可能是在多因素的影响下,酶的最适温度较表1有所降低,30 ℃之后蛋白酶活性开始减弱,催化速率变小。因此选择温度35~45 ℃水平进行响应面优化试验。

图4 酶解温度对酶解物ABTS 自由基清除率和水解度的影响Fig.4 Effect of temperature on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.4 pH 对酶解物ABTS 自由基清除率和水解度的影响 不同pH 对雨生红球藻蛋白酶解物的ABTS自由基清除能力和水解度的影响如图5 所示。pH调至大于8 时,酶解物的ABTS 自由基清除率随着pH 的升高而增加,pH 为11.5 的酶解效果最佳,清除率达69.88%±0.22%。各pH 条件下酶解物的水解度无显著差异(>0.05)。反应体系的pH对酶活力、酶分子和底物分子的状态等有很大影响,一般而言碱性蛋白酶在中等碱性环境下很稳定,多数微藻抗氧化肽的酶解条件为pH7~9。鹰嘴豆多肽的研究很接近上述结果,表示该酶也能在强碱环境下(pH10~12)发挥效果,猜测这与碱溶酸沉法提取蛋白的pH 与酶解最适pH 相同是有关的。有研究表明碱性蛋白酶解物在pH12 时溶解度仍然很高,不会影响进一步应用,因此在该pH 范围内酶解蛋白是可行的,综合考虑后选择pH9.5~11.5 进行响应面优化试验。
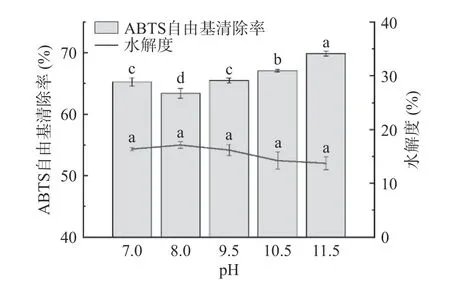
图5 pH 对酶解物ABTS 自由基清除率和水解度的影响Fig.5 Effect of pH on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.2.5 时间对酶解物ABTS 自由基清除率和水解度的影响 不同时间对雨生红球藻蛋白酶解物的ABTS 自由基清除能力和水解度的影响如图6 所示。4 h 前,酶解物ABTS 自由基清除能力随时间增长而增加,在4 h 达到顶峰,清除率达78.14%±0.74%,之后则开始减弱。1、3 h 的水解度显著低于其它三个时间点(0.05)。4 h 后酶解物抗氧化活性降低的原因可能是长时间酶解使部分强抗氧化肽被水解成肽链更短、抗氧化更弱的短肽。因此选择时间3~5 h 水平进行响应面优化试验。
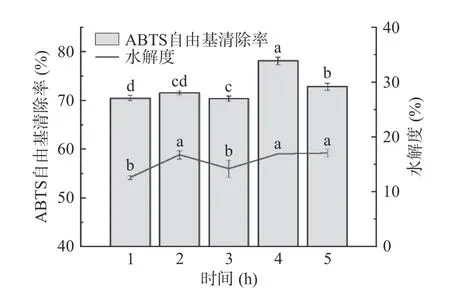
图6 时间对酶解物ABTS 自由基清除率和水解度的影响Fig.6 Effect of time on the ABTS free radical scavenging rate and degree of hydrolysis of hydrolysates
2.3 响应面优化试验
2.3.1 响应面试验结果 选择对ABTS 自由基清除率影响效果较大的3 个因素酶解时间(A)、酶解pH(B)和酶解温度(C)进行响应面试验,得到的试验方案、结果和方差分析见表3、表4。模型项的0.01,失拟项的>0.05,说明模型拟合成功,方程拟合度高。回归模型的决定系数()为0.9395,说明ABTS 自由基清除率的实测值比预测值拟合较好;调整决定系数()为0.8616,表明该模型能解释86.16%的响应值变化。根据值,各因素对雨生红球藻蛋白酶解物抗氧化活性的影响顺序为pH>温度>时间。
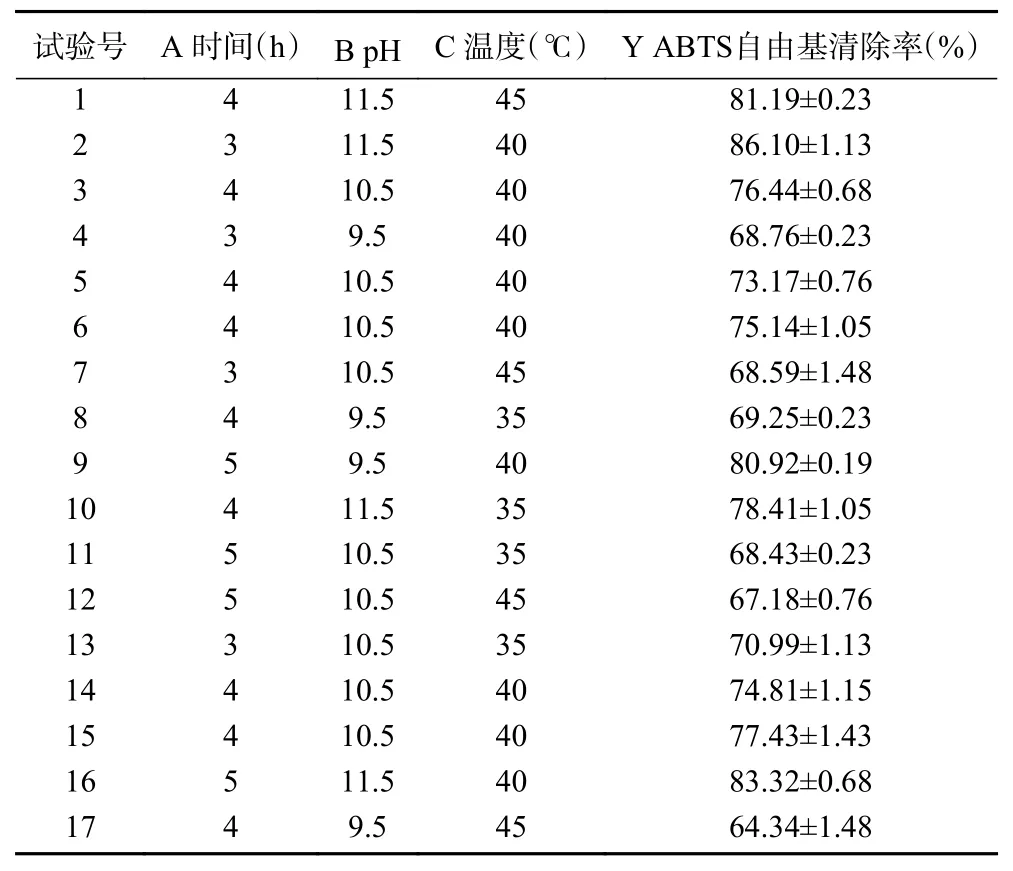
表3 响应面优化实验设计及结果Table 3 Experiment design with results for response surface analysis
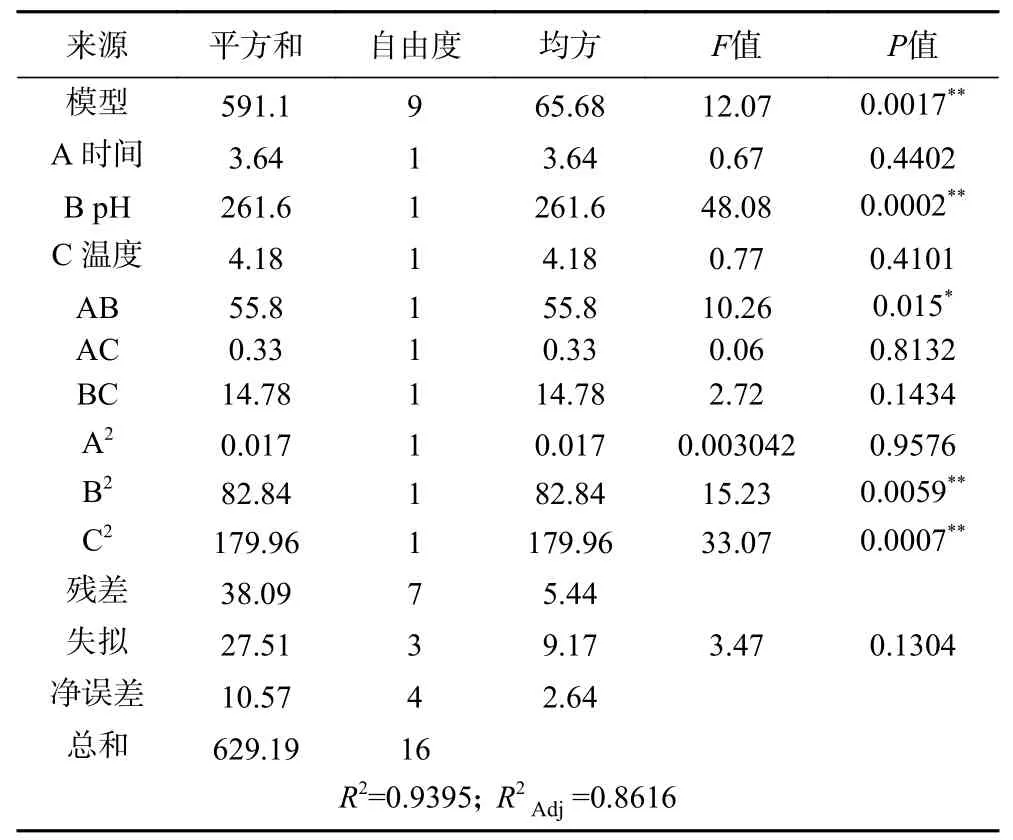
表4 回归方程的方差分析Table 4 Analysis of variance (ANOVA) of regression equation
响应面回归方程为:Y=75.40+0.67A+5.72B-0.72C-3.74AB+0.29AC+1.92BC-0.063A+4.44B-6.54C
图7(a)响应面显示,pH 越大、时间越小,清除率越高;沿pH 方向的响应面坡度较时间方向陡峭,说明pH 对清除率的影响更大。图7(b)响应面曲面较均匀,坡度陡峭度中等,最高值对应的点在接近中心的位置;沿温度方向的响应面坡度较时间方向轴陡峭,说明温度对清除率的影响更大。图7(c)响应面曲面向上延伸,在温度方向接近中心的位置、pH 方向最大值处取到清除率最大值。根据坡度陡峭度判断各因素对清除率的影响程度,为pH>温度>时间,与方差分析结果一致。

图7 两因素之间交互作用对ABTS 自由基清除率影响的响应面图Fig.7 Response surface diagram of interaction between two factors on ABTS free radical scavenging rate
2.3.2 验证试验 根据系统给出的最优条件为温度40.4 ℃、pH11.5、时间3 h。为了验证模型的可靠性且考虑到实际可操作性,采用温度40 ℃、pH11.5、时间3 h 进行验证实验,所得酶解物的实际清除率为86.02%±5.69%,与软件预测值88.58%相近,说明通过响应面法优化得到的回归模型方程及最佳条件可靠。
2.4 最优酶解物的抗氧化活性及组成
2.4.1 最优酶解物的体外抗氧化活性 如图8 所示,随着物质浓度的增加,最优酶解物的ABTS 自由基清除能力逐步增强,并在1000 μg/mL 时达到75.53%±0.25%,此后清除率随浓度递增的速度开始减缓。如图9 所示,最优酶解物的FRAP 值随着物质浓度的增加越来越大,在9000 μg/mL 时达到最大值76.20±8.53 μmol/L FeSO·7HO,此后还原能力基本不变。
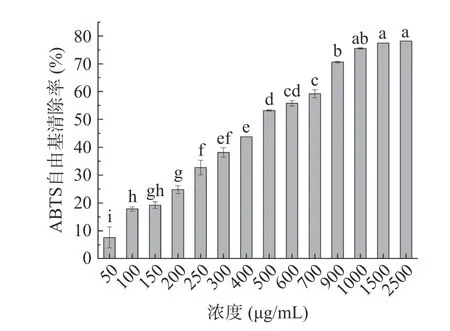
图8 最优酶解物的ABTS 自由基清除率Fig.8 ABTS free radical scavenging rate of optimal hydrolysate
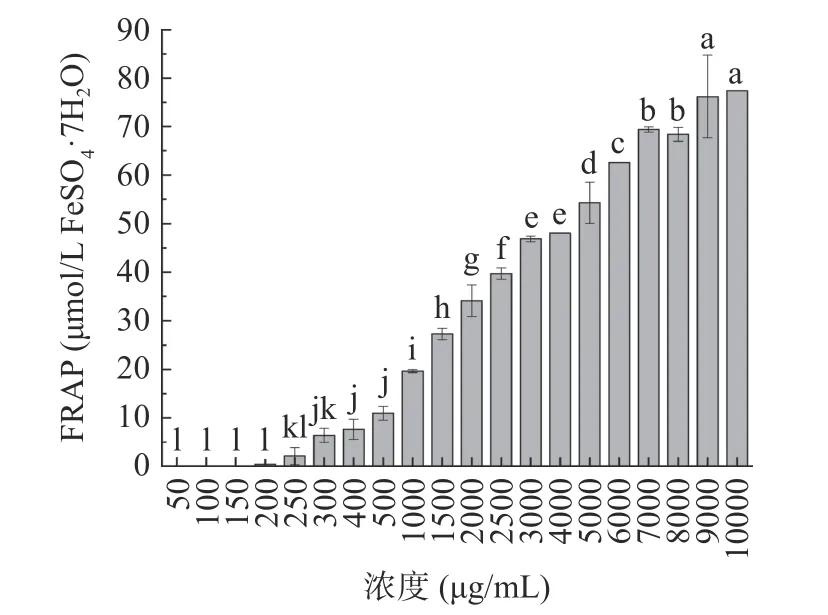
图9 最优酶解物的FRAP 能力Fig.9 FRAP of optimal hydrolysate
经过酶解后,雨生红球藻酶解物比蛋白显示更强的体外抗氧化活性,结果如表5 所示。酶解物的ABTS 自由基清除率的IC值为481.574 μg/mL,极显著低于藻蛋白(0.01);对比发现,其IC值优于舌状蜈蚣藻蛋白酶解物(880 μg/mL)和紫菜渣饼酶解物(1010 μg/mL)。为评价不同物质的亚铁离子还原能力,对比每克原料的FRAP 值:雨生红球藻酶解物的FRAP 为19.641 μmol FeSO·7HO/g(浓度为1000 μg/mL),极显著高于藻蛋白(0.01),高于蓝鲨皮肤抗氧化肽的FRAP 数值(9.23 μmol FeSO·7HO/g)。由此可见,该酶解物具有较强的抗氧化作用,且活性具备剂量效应关系,浓度与活性呈正相关关系。
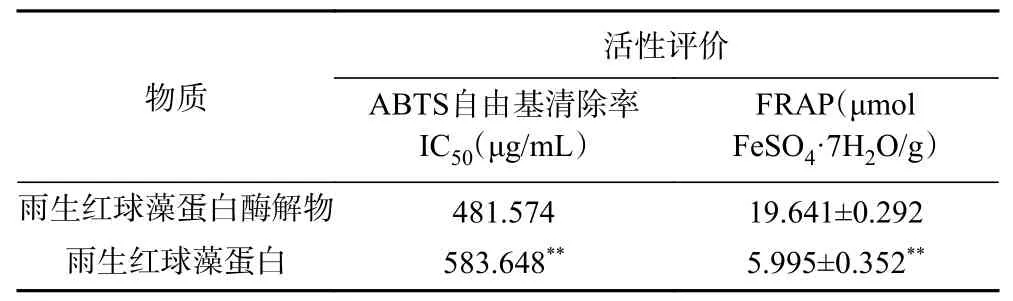
表5 雨生红球藻蛋白酶解物的抗氧化活性评价Table 5 Antioxidant activity of Haematococcus pluvialis hydrolysate
2.4.2 最优酶解物的氨基酸组成 如表6、表7 所示,最优酶解物中氨基酸种类丰富,含17 种氨基酸,必需氨基酸有7 种,分别是Lys、Phe、Met、Thr、Ile、Leu 和Val,必需氨基酸占总氨基酸的含量达到34.44%,与FAO/WHO 提出的EAA/TAA 为40%接近,且优于链带藻蛋QL96 蛋白质。酶解物中含量最高的是Glu(16.41%)和Asp(12.33%),这两种氨基酸是中枢神经系统重要的兴奋性神经递质,也是哺乳动物肠细胞ATP 的主要来源,可通过脱羧基或转氨基等作用转化为其他营养物质,在机体内发挥健康效应,且有研究表明Glu 和Asp 的含量与抗氧化能力呈正相关关系。由此可知雨生红球藻蛋白酶解物的营养价值较高。
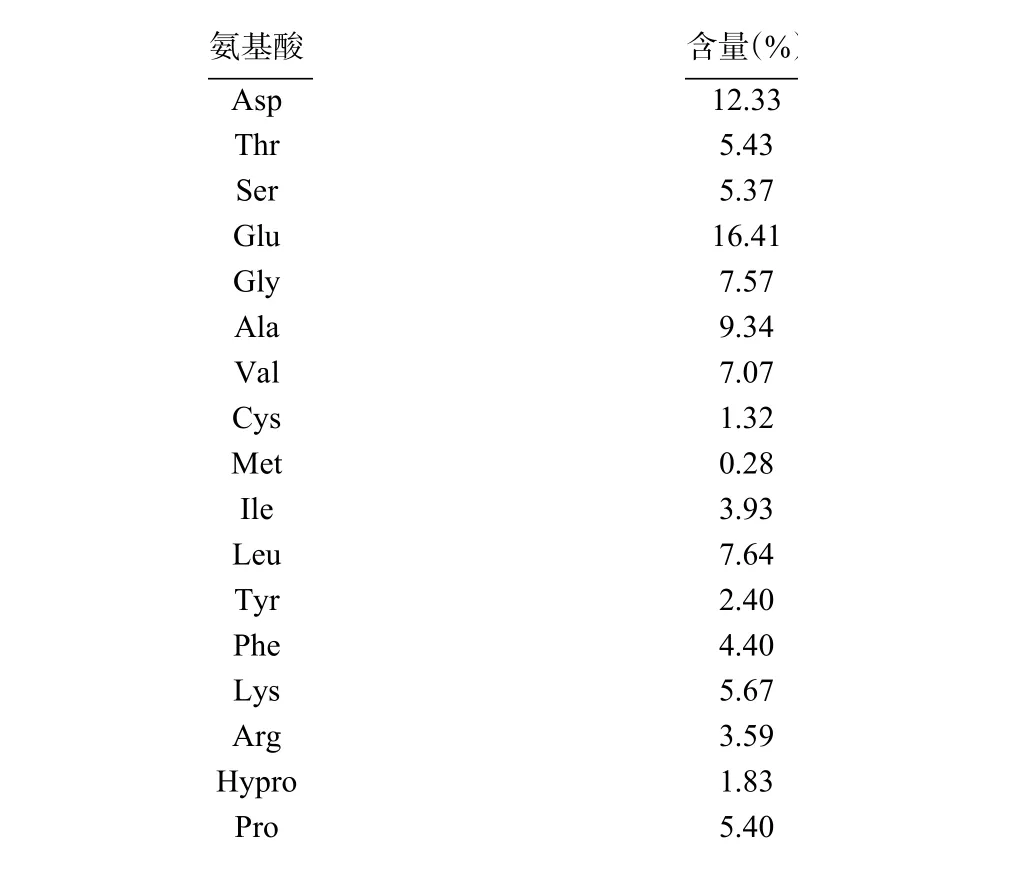
表6 雨生红球藻蛋白酶解物的氨基酸组成Table 6 Amino acid content of Haematococcus pluvialis hydrolysate

表7 不同类型氨基酸与总氨基酸含量比例Table 7 Ratio of different types of amino acids to total amino acids
按氨基酸类型分析,雨生红球藻蛋白酶解物的酸性氨基酸、碱性氨基酸、芳香族氨基酸、脂肪族氨基酸和极性氨基酸的含量比例为4:1:1:11:3,接近Pavlicevic 等归纳得出的海洋源抗氧化生物活性肽的结构组成,这说明该蛋白酶解物中很大可能存在强抗氧化的藻源多肽。疏水性氨基酸的含量高达38.07%,分别是Phe、Val、Leu、Ile、Ala、Pro 和Met,这些氨基酸有助于促进疏水性较强的肽段的形成,可通过多种途径增强物质清除自由基的能力,如促进酶解物在脂质-水界面处的溶解,使其更易于进入疏水性的靶器官,或作为供氢体发挥功效,也可充分利用其与金属离子螯合(如Fe和Cu)的性质。酸性氨基酸(Glu 和Asp)和碱性氨基酸(Lys 和Arg)在抗氧化中也起着重要作用,其所带电荷直接决定酶解物对金属离子的螯合能力,含量分别为28.75%和9.26%。以上三类与抗氧化高度相关的氨基酸占总氨基酸含量的76.08%,较好地解释了该酶解物的抗氧化活性。
此外,芳香族、脂肪族和极性氨基酸也可提供相应的自由基消除能力。芳香族氨基酸既可以利用自身存在的咪唑环供氢和捕捉自由基,也可能利用和其他氨基酸的作用来增强疏水性能力,以提高物质的抗氧化功能,其消除自由基的能力约是脂肪族氨基酸的二倍以上。脂肪族氨基酸能增强基于肽的依布硒啉类似物的谷胱甘肽过氧化物酶活性,但其对抗氧化酶解物的作用机理还有待证实。极性氨基酸可螯合金属离子以发挥抗氧化作用,还能与非极性氨基酸相互协同来增强自由基清除能力。综上所述,雨生红球藻蛋白酶解物可作为天然抗氧化剂的一种来源,营养价值高,有可观的健康效应。
3 结论
本研究利用单因素实验和响应面优化试验,通过抗氧化指标进行测定筛选,制备了具较强抗氧化活性的雨生红球藻蛋白酶解物。最终确定的最佳酶解条件为:以碱性蛋白酶为实验用酶,底物浓度为9%(w:v),加酶量为0.7%(w:w),酶解温度40 ℃,pH11.5,酶解时间为3 h。用最优方案制备的酶解物的ABTS自由基清除率IC值为481.574 μg/mL,亚铁离子还原能力为19.641 μmol FeSO·7HO/g(1000 μg/mL),抗氧化活性极显著高于藻渣蛋白(<0.01)。该酶解物的氨基酸种类丰富,必需氨基酸含量达34.4%,且内含较多疏水性氨基酸,营养价值较高。本研究为雨生红球藻渣的综合利用及后续研究提供了理论基础,为进一步分离纯化雨生红球藻抗氧化肽提供了参考价值,为藻源天然抗氧化剂的开发提供新途径。

