南瓜皮多糖铬的制备与体外消化的分析
张 雯,张禧庆,董淑君,王 丹,马 越, ,郑振佳
(1.北京市农林科学院农产品加工与食品营养研究所,果蔬农产品保鲜与加工北京市重点实验室,农业农村部蔬菜采后处理重点实验室,北京 100097;2.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东泰安 271018;3.山东杰诺检测服务有限公司,山东烟台 265200)
南瓜广泛种植于世界各地,具有降血糖、抗氧化、抗肿瘤等作用,深加工过程会产生大量南瓜皮副产物,大量丢弃造成了资源浪费和环境污染。南瓜皮富含多糖,从南瓜皮中提取多糖,可以促进南瓜资源的综合利用,提高其工业附加值。目前关于南瓜多糖的研究大多集中于提取工艺优化、结构解析及生物活性评价等方面,有关南瓜多糖与金属离子螯合的研究较少。
三价铬离子是葡萄糖耐量因子的重要组成,可以加速葡萄糖在体内的利用,具有降血糖作用。但该形式会影响铬的吸收利用,研究表明与有机物复合后的铬更易被吸收,因此开发一种具有生物活性的新型有机铬产品具有重要意义。多糖结构中含有羟基、羧基等基团,可以与三价铬离子以配位键结合,形成多糖铬复合物,能够更好地被人体利用。多糖金属离子复合物既保持了天然多糖的生物活性,又可发挥金属元素的生理作用。目前已报道的可与铬进行复合的多糖有黄芪多糖、灰树花多糖、灵芝多糖、苦瓜多糖、桦褐孔菌多糖和海藻多糖等,这些研究多集中于多糖铬的螯合工艺及降血糖、降血脂等生物活性的分析,但有关铬与南瓜多糖螯合产物的制备和消化过程中的生物接受率的研究较少。
本研究从南瓜皮中提取南瓜皮多糖,采用单因素法和响应面法确定南瓜皮多糖与三价铬离子的最佳螯合工艺,并研究南瓜皮多糖铬的体外消化特性,为南瓜皮多糖铬的高效制备与新型补铬产品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
爱碧斯南瓜皮 山东省烟台市莱阳市孟宇食品有限公司提供;氯化铬 分析纯,天津市凯通化学试剂有限公司;三价铬标准溶液(1000 μg/mL) 北京北方伟业计量技术研究院;无水乙醇、氢氧化钠 分析纯,天津市科密欧化学试剂有限公司;盐酸 优级纯,天津市科密欧化学试剂有限公司;硝酸 UP 级,苏州晶瑞化学股份有限公司;人工胃液、人工肠液福州飞净生物科技有限公司;透析袋 怡康科贸生物试剂耗材实验有限公司。
电感耦合等离子体质谱7800(ICP-MS-7800)美国安捷伦公司;Multiwave PRO 微波消解仪 奥利地安东帕公司;FD-304 冷冻干燥机 济南骏德仪器有限公司;DKZ-2B 电热恒温振荡水槽 上海一恒科技仪器有限公司;SECURA224-ICN 型电子天平赛多利斯科学仪器有限公司;S210 pH 计 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 南瓜皮多糖的制备 称取新鲜南瓜皮1 kg,切碎,加入去离子水6 L,水提90 min,过滤后收集滤液,重复提取一次;合并滤液,浓缩,加入4 倍体积的无水乙醇进行醇沉,收集沉淀并复溶,Sevag 法除蛋白后醇沉,冷冻干燥得南瓜皮多糖。苯酚-硫酸法测得南瓜皮多糖含量为77.79%。
1.2.2 南瓜皮多糖铬复合物的制备 称取一定质量的南瓜皮多糖溶于200 mL 去离子水中,与一定浓度的氯化铬溶液等体积混合,调节混合液pH,在一定温度下反应一段时间。反应完毕后,加入4 倍体积的无水乙醇,醇沉,离心10 min,沉淀复溶后透析48 h,冷冻干燥得南瓜皮多糖铬。
1.2.3 单因素试验
1.2.3.1 铬与多糖质量比对螯合率的影响 将不同质量比(0.01:1,0.05:1,0.1:1,0.2:1,0.5:1,1:1)的南瓜皮多糖与铬混合液调整反应pH 为7,在70 ℃振荡120 min,加入4 倍体积的无水乙醇,醇沉,使用电感耦合等离子体质谱仪测定上清液中铬离子含量,计算螯合率,考察铬与多糖质量比对螯合率的影响。
1.2.3.2 反应温度对螯合率的影响 固定铬与多糖质量比为0.2:1,反应pH 为7,将混合液在不同温度(50、60、70、80、90 ℃)下振荡120 min,醇沉后测定上清液中铬离子含量,相关步骤按照“1.2.3.1”操作,考察反应温度对螯合率的影响。
1.2.3.3 反应pH 对螯合率的影响 固定铬与多糖质量比为0.2:1,调节不同pH(6、7、8、9、10)后将混合液在70 ℃振荡120 min,醇沉后测定上清液中铬离子含量,相关步骤按照“1.2.3.1”操作,考察反应pH 对螯合率的影响。
1.2.3.4 反应时间对螯合率的影响 固定铬与多糖质量比为0.2:1,反应pH 为7,将混合液在70 ℃分别振荡不同时间(60、90、120、150、180、210 min),醇沉后测定上清液中铬离子含量,相关步骤按照“1.2.3.1”操作,考察反应时间对螯合率的影响。
1.2.4 响应面优化试验 以单因素结果为基础,选择对南瓜皮多糖铬螯合率影响显著的铬与多糖质量比、反应温度和反应pH 进行三因素三水平的响应面试验,以螯合率为响应值,因素水平表见表1。

表1 响应面设计因素及水平Table 1 Response surface analysis factor and level coding table
1.2.5 螯合率的计算

1.2.6 铬含量的计算
1.2.6.1 铬标曲的绘制 利用三价铬标准溶液配制浓度分别为0.1、0.2、0.4、0.6、0.8、1.0 μg/mL 的铬溶液。电感耦合等离子体质谱仪测定,仪器操作条件参考GB 5009.268-2016。以铬元素浓度(X,μg/mL)为横坐标,响应信号值(Y)为纵坐标,绘制标准曲线。测得标准曲线方程为Y=32.1232X+0.0063,=0.9998。
1.2.6.2 铬含量的测定 称取南瓜皮多糖铬0.02 g,加7 mL 浓硝酸浸泡过夜,微波消解,分别于120 ℃消解3 min,180 ℃消解10 min,爬升时间5 min,赶酸1 h,冷却后转移到50 mL 容量瓶中,去离子水定容,稀释50 倍后用电感耦合等离子体质谱仪测定。
1.2.7 体外消化试验 参考文献[19-20]并稍作修改,对南瓜皮多糖铬和氯化铬进行体外模拟消化试验。向5 mg/mL 的南瓜皮多糖铬和铬溶液中添加1 mol/L 的盐酸溶液调节pH 至2,加入等体积模拟胃液,混匀后在37 ℃的水浴分别振荡反应0、30、60、90、120、150、180、210、240 min,在95 ℃沸水浴中灭酶处理10 min,在4 ℃条件下保存备用。
取模拟胃液消化120 min 后的南瓜皮多糖铬和氯化铬溶液,冷却至室温后加入1 mol/L 的NaOH调节pH 至7,将等体积模拟肠液混入均匀,转入透析袋中,在37 ℃的恒温水浴震荡器中分别反应1、2、4、6、8 h 后,反应后在95 ℃沸水浴中灭酶处理10 min,在4 ℃条件下保存备用。
1.2.7.1 铬离子溶解率的测定 向消化后的溶液中加入4 倍体积的无水乙醇醇沉,5000 r/min 离心10 min后取上清液,测定铬离子含量,按照下列公式计算:
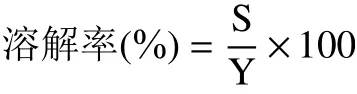
式中:S 表示上清液中铬离子的浓度,μg/mL;Y 表示样品中铬离子的浓度,μg/mL。
1.2.7.2 透析率的测定 将消化后的溶液取样,采用电感耦合等离子体质谱仪测定铬离子含量,按照下列公式计算:
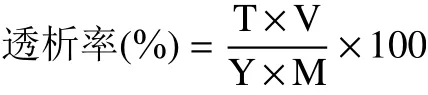
式中:T 表示透析液铬离子的浓度,μg/mL;V 表示透析液体积,mL;Y 表示样品中铬离子的含量,μg/g;M 表示样品的质量,g。
1.3 数据处理
实验平行三次,结果用平均值±标准差表示;利用Design Expert 8.0.6 软件中的Box-Bohnken 法优化试验方案并处理数据,采用SPSS 26.0 软件对数据进行差异性显著分析(Duncan 法,n=3,<0.05);采用Origin 2019 软件绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 铬与多糖质量比对螯合率的影响 由图1 可知,随着铬与多糖质量比的增大,螯合率呈现先升高后下降的趋势。当质量比为0.05:1 时,螯合率达到最大值为92.22%。当质量比大于0.05:1 时,螯合率降低,这种变化可能是因为南瓜皮多糖分子中的结合位点暴露减少,导致螯合率不高,故选择铬与多糖质量比为0.05:1 为最佳。

图1 铬与多糖质量比对螯合率的影响Fig.1 Effects of the mass fraction between chromium and polysaccharide on the chelation rate of PPP-Cr(III) complex
2.1.2 反应温度对螯合率的影响 由图2 可知,反应温度在50~60 ℃时螯合率呈递增的趋势,当温度为60 ℃时,螯合率达到最高,为77.33%。随着温度的继续升高,螯合率下降,这可能是因为温度会影响分子之间的碰撞频率,当温度过高时,多糖分子与铬离子运动过快,解析速率高于结合速率。因此,温度选择60 ℃为最佳。
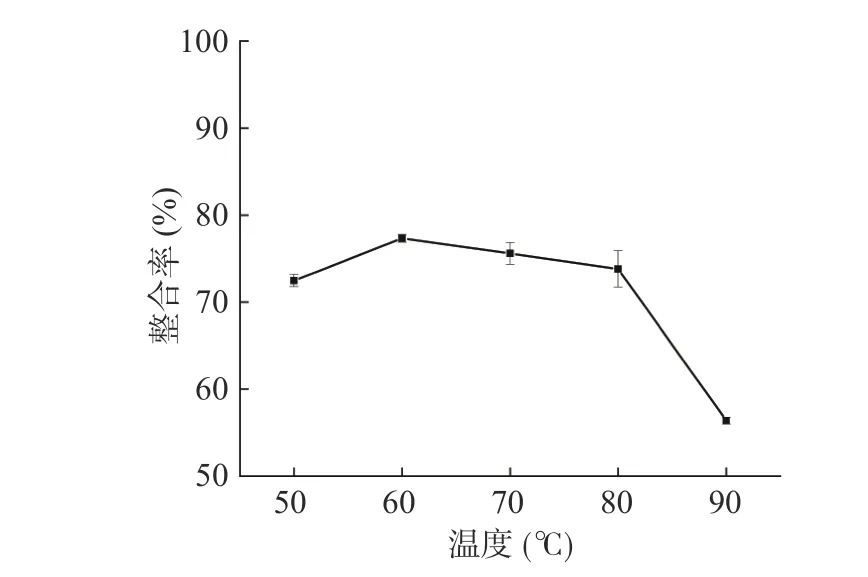
图2 反应温度对螯合率的影响Fig.2 Effects of the reaction temperature on the chelation rate of PPP-Cr(III) complex
2.1.3 反应pH 对螯合率的影响 由图3 可知,随着pH 的增大,螯合率呈现先升高后下降的趋势。当pH 小于7 时,螯合率随pH 的增大而增加,在pH 为7 时螯合率达到最大值;随着pH 继续增大,南瓜皮多糖与铬离子的螯合率下降,这可能是因为酸性条件下H与铬离子竞争在多糖上的结合位点;碱性条件下,部分铬离子因碱性环境溶解度下降,导致螯合率下降。因此,选择pH 为7 为最佳。
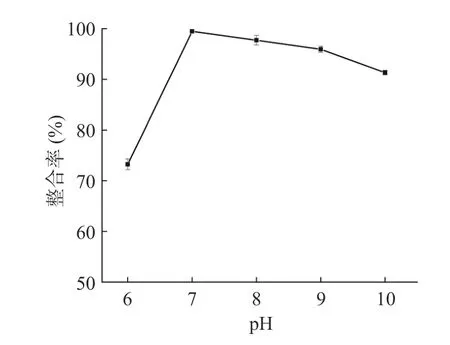
图3 反应pH 对螯合率的影响Fig.3 Effects of the reaction pH on the chelation rate of PPPCr(III) complex
2.1.4 反应时间对螯合率的影响 由图4 可知,反应时间在60~180 min 以内时,南瓜皮多糖铬的螯合率趋于平稳状态,随着时间的延长,螯合率保持在71%左右,可发现时间对螯合率的影响较小,因此可将反应时间作为次要考虑因素,不作为响应面优化的参数。

图4 反应时间对螯合率的影响Fig.4 Effects of the reaction time on the chelation rate of PPP-Cr(III) complex
2.2 响应面优化试验
2.2.1 响应面试验结果 在单因素试验的结果上,选择铬与多糖质量比、反应温度、反应pH 进行三因素三水平响应面优化试验,试验设计及结果见表2,回归方程方差分析见表3。由表3 可知,模型<0.01,表明模型极显著,失拟项=0.3123>0.05,表明不显著,=0.9233,=0.8247,表明模型的拟合效果较好。以南瓜皮多糖铬的螯合率(%)为响应值,运用Design-Expert 8.0.6 软件对试验结果进行回归拟合,得到的回归方程为:Y=96.17+10.65A+4.97B+2.62C-8.21AB-5.54AC-4.62BC-9.15A-4.69B-3.36C。根据回归方程及方差分析可知,影响螯合率的主次顺序为铬与多糖质量比>反应温度>反应pH,此外,一次项A 及二次项A对螯合率的影响极显著,一次项B及交互项AB 对螯合率的影响显著。一次项C、交互项AC、BC 及二次项B、C对螯合作用影响不显著。

表2 响应面试验设计及结果Table 2 Experimental design and results for response surface

表3 回归方程方差分析Table 3 Analysis of variance of regression equations
2.2.2 三维响应面图和二维等高线图分析 铬与多糖质量比和反应温度、铬与多糖质量比和反应pH、反应温度和反应pH 的交互作用的响应面图和等高线图分别如图5 所示。在铬与多糖质量比和反应温度的交互作用中,铬与多糖质量比方向的响应面更陡峭,等高线更加密集,而在反应温度方向的响应面较为平缓,等高线较为稀疏,表明铬与多糖质量比对螯合率的影响更显著。在铬与多糖质量比和反应pH的交互作用中,铬与多糖质量比方向的响应面更陡峭,等高线更加密集,而在反应pH 方向的响应面较为平缓,等高线较为稀疏,表明铬与多糖质量比对螯合率的影响更显著。在反应温度和反应pH 的交互作用中,反应温度方向的响应面更陡峭,等高线更加密集,而在反应pH 方向的响应面较为平缓,等高线较为稀疏,表明反应温度对螯合率的影响更显著。

图5 各因素交互作用的响应曲面和等高线图Fig.5 The response surface plots and contour plots of the interaction of various factors
2.2.3 优化工艺验证试验 通过模型预测得到南瓜皮多糖铬复合物的最佳合成条件为:铬与多糖质量比0.08:1,温度60.94 ℃,pH6.84,南瓜皮多糖铬复合物的理论最大螯合率为99.33%。考虑实际情况,将条件调整为铬与多糖质量比0.08:1,温度60 ℃,pH6.8,在此条件下,南瓜皮多糖铬复合物螯合率为99.23%±0.12%,与模型预测值相近,相差0.10%。可选用该模型。
2.3 南瓜皮多糖铬和氯化铬的体外消化特性
2.3.1 南瓜皮多糖铬和氯化铬在模拟胃液中的消化情况 南瓜皮多糖铬和氯化铬在胃液中的铬离子溶解率如图6 所示。从图6 中可以看出,氯化铬在胃液中的溶解率较高,在30~150 min 内,溶解率先下降后上升,150 min 时溶解率达到最大值39.92%,随着反应的进行溶解率呈现先下降后上升再下降的趋势,推测前期铬离子会与胃液中的胃蛋白酶结合使所得铬离子溶解率较低,后期在酸性环境下解离速度大于结合速度,导致胃液中浓度上升。南瓜皮多糖铬的铬离子溶解率随时间的增加而增大,但远小于氯化铬中铬离子的溶解率,这可能是因为南瓜皮多糖铬对胃液具有抗消化性,因此解析程度较弱,缓释性较好。
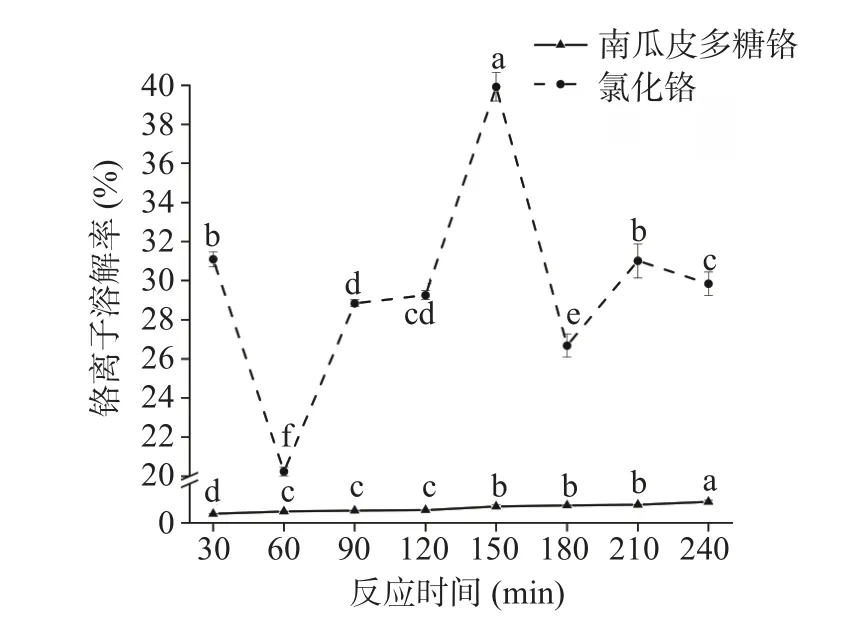
图6 铬离子溶解率在胃液中随反应时间的变化Fig.6 Variation of solubility of chromium ions in gastric juice with digestion time
2.3.2 南瓜皮多糖铬和氯化铬在模拟肠液中的消化与吸收情况 南瓜皮多糖铬和氯化铬在肠液中的消化情况见图7。在1~6 h 内,随着反应时间的增加,氯化铬的铬离子溶解率显著下降(<0.05),当反应结束时溶解率为0.9%,主要是因为在弱碱性环境下铬离子生成铬沉淀,导致溶解率降低。南瓜皮多糖铬的铬离子在肠液中的溶解率低于胃液,溶解率低于氯化铬,含量趋势为先上升后保持稳定,南瓜皮多糖铬在碱性环境下溶解率不高,但因为糖的保护作用没有引起铬离子含量下降。

图7 铬离子溶解率在肠液中随反应时间的变化Fig.7 Changes of chromium ions solubility in intestinal fluid with digestion time
南瓜皮多糖铬和氯化铬在肠液中的透析率随反应时间的变化见图8。南瓜皮多糖铬的透析率在0.2%~1.0%之间且随时间的延长而增加,这与Garcia等发现饮食中铬的透析率在0.4%~1.6%之间的结果接近。南瓜皮多糖铬的透析率大于氯化铬在肠液中的透析率,原因推测为多糖及其消化产物与铬离子结合,具有一定的保护作用,提高了铬离子的透过率。结果表明,南瓜皮多糖铬的生物接受率高于氯化铬,与Disilvestro 等发现吡啶甲酸铬比氯化铬利用率更高的结果类似。

图8 铬离子透析率在肠液中随反应时间的变化Fig.8 Changes of chromium ions dialysis rate in intestinal fluid with digestion time
3 结论
本研究建立了南瓜皮多糖铬复合物制备工艺,考察了铬与多糖质量比、温度、pH 和时间对南瓜皮多糖铬螯合率的影响。根据单因素和响应面试验,确定了对螯合率影响顺序依次是质量比、温度、pH,最佳工艺条件为铬与多糖质量比0.08:1,温度60 ℃,pH6.8,螯合率为99.23%±0.12%,优化后的工艺可用于南瓜皮多糖铬的制备。体外消化模拟试验表明,南瓜皮多糖铬在胃肠液中的溶解率低于氯化铬,在胃液酸性环境中具有一定缓释效果,在肠液中的透析率高于氯化铬,因此南瓜皮多糖铬具有较高的生物接受率。本研究为新型补铬产品的开发和南瓜皮的综合利用提供参考。

