青风藤配伍制附子对RA模型大鼠骨破坏的干预作用及机制Δ
韩远山,易刚强,李鑫,欧阳琳,蔡嘉洛,邹蔓姝(.湖南中医药大学第一附属医院科研部,长沙 40007;.湖南中医药大学药学院,长沙 4008)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以慢性、对称性关节炎和骨破坏为临床表现的人体自身免疫性疾病[1]。目前,RA的治疗药物主要包括糖皮质激素、肿瘤坏死因子抑制剂和非甾体抗炎药等[2]。这些药物虽能迅速消除关节红肿热痛症状,缓解关节炎症,但存在副作用多、成本高、骨破坏病情难以改善等问题;近年来兴起的生物制剂虽有一定疗效,但也存在靶器官特异性较低、长期疗效缺乏足够的循证证据等不足[3]。基于化学药品和生物制剂治疗RA的上述毒副作用以及局限性,寻找有效的RA治疗中药近年来也越来越受到人们的重视。
RA属于中医“痹症”范畴,一般按照“顽痹”“尪痹”进行辨证施治[4]。古今中医皆认为痹症病机为本虚者脏气内虚,引起寒凝气滞、血瘀,最终导致痰浊瘀血、痹阻经络[5]。痹症的治则治法可以简要概括为6个字:祛风、除湿、散寒[6]。临床常用中药青风藤和制附子治疗RA,其主要作用机制包括下调炎症因子表达水平、抑制核因子κB配位体受体活化剂分泌以及抑制骨破坏等[7-8]。
本研究以牛Ⅱ型胶原复制RA大鼠模型,通过检测RA模型大鼠的一般情况、体质量、足肿胀度、关节炎症指数(arthritis index,AI)评分、踝关节骨质变化情况、血清中炎症因子及趋化因子水平、踝关节病理学情况和踝关节滑膜组织中核因子的表达情况,探讨青风藤配伍制附子抗RA骨破坏的作用及机制。
1 材料
1.1 主要仪器
本研究所用主要仪器有Quantum GX2型小动物CT机[珀金埃尔默仪器(上海)有限公司],T10 basic型匀浆机(德国IKA公司),KH-Q330/350型切片机、KL型组织脱水机、KH-BL1型组织包埋机(湖北孝感阔海医疗科技有限公司),VIB50型制冰机(广州科勒尔制冷设备有限公司)等。
1.2 主要药物与试剂
青风藤(批号1512150652)、制附子(批号170650411)均购于康美药业股份有限公司;吲哚美辛肠溶片(国药准字H14020771,批号F171003,规格25 mg/片)购于云鹏医药集团有限公司;牛Ⅱ型胶原(批号180382)、不完全弗氏佐剂(批号SLBW2506)均购于西格玛奥德里奇(上海)贸易有限公司;白细胞介素3(interleukin-3,IL-3)、IL-25、IL-31、核因子κB受体激活蛋白(receptor activator of nuclear factor-κB,RANK)、核因子κB受体激活蛋白配体(receptor activator of nuclear factor-κB ligand,RANKL)、护骨因子(osteoprotegerin,OPG)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号 分 别 为 E-EL-H0100c、E-EL-R2394c、E-EL-H5469c、SN368、SEKM-0138、20190121)均购于上海晶天生物科技有限公司;兔抗鼠RANK、RANKL、OPG多克隆抗体(批号分别为ab182158、ab9957、ab73400)均购于英国Abcam公司;辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号BA1032)购于武汉博士德生物工程有限公司;二甲苯等试剂均购于国药集团化学试剂有限公司。
1.3 实验动物
40只SPF级雌性SD大鼠(体质量150~170 g)由湖南斯莱克景达实验动物有限公司提供,动物合格证号为11400700346315,动物生产许可证号为SCXK(湘)2019-0004。大鼠适应性喂养5 d后进行分组实验。
2 方法
2.1 药物的制备
2.1.1 造模药物 将2.0 mg/mL的牛Ⅱ型胶原与等量不完全弗氏佐剂混合,于4℃条件下,采用匀浆机搅拌均匀至完全乳化(完全乳化标志为乳化剂滴至水中不扩散),即得牛Ⅱ型胶原质量浓度为1.0 mg/mL的混合乳剂。
2.1.2 青风藤配伍制附子水提液 将青风藤和制附子以4∶5的质量比投料(质量比依据前期研究结果设置),总量为180 g,加水回流提取2次,第1次加10倍量水,提取2 h,滤过;第2次加8倍量水,提取1.5 h,滤过;合并2次滤液,减压浓缩至相应质量浓度(青风藤质量浓度为5.4 g/mL,制附子质量浓度为6.75 g/mL),备用。
2.1.3 吲哚美辛水溶液 将吲哚美辛肠溶片用研钵碾碎后,加蒸馏水配制成质量浓度为1.35 mg/mL的吲哚美辛水溶液。
2.2 动物的分组、造模与给药
根据体质量将大鼠随机分为4组,空白组、模型组、阳性对照组、青风藤配伍制附子组,每组10只。根据预实验的结果确定造模方式、给药剂量及给药方式。除空白组外,其余各组大鼠于尾根部正面皮下注射“2.1.1”项下混合乳剂200 μL进行初次免疫(第0天,以下均从实验开始计时间);7 d后,于尾根部背面皮下再次注射混合乳剂200 μL,加强免疫(第7天)。空白组大鼠在相同时间点,于同部位注射等体积生理盐水。各组大鼠于加强免疫当天(第7天)开始灌胃给药(给药体积为10 mL/kg)。阳性对照组给予吲哚美辛水溶液(剂量为0.013 5 g/kg),青风藤配伍制附子组给予青风藤配伍制附子水提液(青风藤剂量为1.08 g/kg,制附子剂量为1.35 g/kg),每天给药1次,第30天给药结束;空白组和模型组则在相同时间给予等体积蒸馏水。
2.3 RA模型评价相关指标检测
2.3.1 一般情况观察与体质量测量 每天观察大鼠的一般情况变化,包括精神状态、皮毛色泽和活动状态等。于关节开始出现炎症肿胀后每3天用电子天平称定体质量,记录各组大鼠体质量变化情况,至第30天。
2.3.2 足肿胀度测量 在大鼠右后足踝关节部位用苦味酸进行永久性标记。于关节开始出现炎症肿胀后每3天使用游标卡尺在标记部位测量其足跖肿胀厚度,每只重复测量3次,取平均值,至第30天。
2.3.3 AI评分 由3名以上研究者于第12天开始每3天根据关节肿胀度、关节颜色及关节活动情况评价大鼠全身关节病变程度。采用4分制对足爪炎症进行评分,AI评分标准:0分,无红肿;1分,踝关节或跗骨关节出现红斑或轻微肿胀;2分,踝关节到跗骨关节出现红斑和轻微肿胀;3分,踝关节到跖骨关节出现红斑和中度肿胀;4分,踝关节到趾骨关节全部足爪肿胀[9]。累计四肢关节的得分为每只大鼠的AI评分,最高为16分。
2.4 踝关节骨质检测
采用小动物CT机进行检测。第30天,每组随机挑选3只大鼠,将大鼠处死后取右后足踝关节,将标本平行固定于小动物CT机的样本杯中。设置扫描角度为360°,分辨率为10 μm,电压为80 kV,电流为500 μA,扫描时间为4 min。通过专用CT分析软件对所得图像进行三维图片重建,分析骨侵蚀程度、滑膜增生情况和组织破坏情况。
2.5 血清中炎症因子及趋化因子水平检测
采用ELISA法进行检测。第30天,将大鼠麻醉后,取腹主动脉血,经抗凝处理后,以4 000 r/min离心10 min,分离血清,使用相应ELISA试剂盒测定大鼠血清中炎症因子(IL-31、IL-25、IL-3)和趋化因子(RANKL、RANK、OPG)水平。具体操作严格按说明书步骤进行。
2.6 踝关节病理学观察
采用HE染色法进行检测。处死大鼠后,取后足踝关节,用4%多聚甲醛固定,脱钙,常规石蜡包埋,切片,经HE染色后,于显微镜下观察后足踝关节滑膜的形态结构、滑膜增生、炎性浸润等情况。
2.7 踝关节滑膜组织中趋化因子表达情况检测
采用免疫组织化学法进行检测。取“2.6”项下已制好的踝关节切片,依次放入二甲苯和无水乙醇中进行脱蜡;用一抗(RANKL、RANK、OPG)、二抗稀释液孵育后显色;切片置入苏木素染液中3~5 min,用自来水洗,分化液分化,再用自来水洗,返蓝液返蓝,流水冲洗,脱水,中性树胶封片。显微镜下拍片,观察RANKL、RANK、OPG的表达情况(以光密度值衡量)。
2.8 统计学分析
3 结果
3.1 各组大鼠一般情况和体质量变化
除空白组外,各组大鼠均于第9~12天关节出现炎症肿胀。第12~30天,与空白组比较,模型组大鼠精神状态虚弱,活动力下降明显,毛发失去光泽,体质量显著降低(P<0.05或P<0.01);与模型组比较,阳性对照组和青风藤配伍制附子组大鼠一般情况均有所改善,体质量显著升高(P<0.05或P<0.01)。体质量结果见表1。
表1 各组大鼠体质量的测定结果(±s,n=10,g)

表1 各组大鼠体质量的测定结果(±s,n=10,g)
a:与空白组比较,P<0.05;b:与空白组比较,P<0.01;c:与模型组比较,P<0.05;d:与模型组比较,P<0.01
组别空白组模型组阳性对照组青风藤配伍制附子组第30天221.48±7.09 86.63±3.46b 208.71±8.61d 183.31±2.81d第9天61.47±6.50 54.73±1.85 58.63±2.75 57.33±1.74第12天87.34±1.97 59.74±3.40a 80.98±3.48c 74.41±1.24c第15天109.39±6.28 51.55±3.88a 96.49±3.06c 90.35±4.31c第18天132.28±6.73 52.91±3.02b 115.50±4.17d 105.03±5.09d第21天156.25±8.38 54.95±3.04b 139.27±7.05d 121.19±3.49d第24天177.51±7.24 60.17±2.80b 159.39±7.66d 139.98±4.40d第27天199.70±6.47 70.58±3.04b 183.27±7.74d 161.21±2.62d
3.2 青风藤配伍制附子对RA模型大鼠足肿胀度的影响
第12~30天,与空白组相比,模型组大鼠足肿胀度显著增加(P<0.01);与模型组比较,阳性对照组和青风藤配伍制附子组大鼠足肿胀度显著降低(P<0.01)。结果见表2。
表2 各组大鼠足肿胀度的检测结果(±s,n=10,mm)

表2 各组大鼠足肿胀度的检测结果(±s,n=10,mm)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.01
组别空白组模型组阳性对照组青风藤配伍制附子组第30天0.49±0.03 4.03±0.11a 1.26±0.04b 1.63±0.09b第9天0.24±0.03 0.28±0.03 0.26±0.02 0.24±0.03第12天0.31±0.03 3.35±0.15a 0.96±0.04b 1.10±0.06b第15天0.35±0.03 3.89±0.12a 1.04±0.04b 1.24±0.06b第18天0.38±0.03 4.55±0.17a 1.10±0.04b 1.36±0.07b第21天0.41±0.03 4.70±0.16a 1.15±0.04b 1.45±0.07b第24天0.44±0.03 4.45±0.17a 1.18±0.03b 1.53±0.09b第27天0.46±0.03 4.25±0.14a 1.23±0.04b 1.58±0.09b
3.3 青风藤配伍制附子对RA模型大鼠AI评分的影响
第12~30天,与空白组比较,模型组大鼠AI评分显著升高(P<0.01);与模型组比较,阳性对照组和青风藤配伍制附子组大鼠AI评分显著降低(P<0.01)。结果见表3。
表3 各组大鼠AI评分的结果(±s,n=10,分)

表3 各组大鼠AI评分的结果(±s,n=10,分)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.01
组别空白组模型组阳性对照组青风藤配伍制附子组第30天0 6.88±0.84a 0.88±0.34b 1.13±0.35b第12天0 3.50±0.53a 0.75±0.46b 1.50±0.54b第15天0 6.38±0.74a 1.13±0.64b 1.75±0.71b第18天0 8.12±0.64a 1.25±0.46b 2.25±0.46b第21天0 10.25±0.70a 1.00±0.54b 2.38±0.52b第24天0 9.38±0.74a 0.88±0.35b 2.25±0.46b第27天0 8.00±0.93a 0.88±0.35b 1.38±0.52b
3.4 青风藤配伍制附子对RA模型大鼠踝关节骨质的影响
空白组大鼠后足踝关节表面光滑、结构清晰,无任何完整性破坏和不规则隆起。模型组大鼠后足踝关节表面粗糙,组织破坏明显,滑膜增生和骨侵蚀严重;阳性对照组和青风藤配伍制附子组大鼠后足踝关节组织破坏程度和滑膜增生较模型组明显减轻,骨侵蚀与骨破坏程度明显下降。结果见图1。

图1 各组大鼠后足踝关节CT三维重建图
3.5 青风藤配伍制附子对RA模型大鼠血清中炎症因子及趋化因子的影响
与空白组比较,模型组大鼠血清中IL-31、IL-25、IL-3水平均显著升高(P<0.01);与模型组比较,阳性对照组和青风藤配伍制附子组的IL-31、IL-25、IL-3水平均显著下降(P<0.05或P<0.01)。结果见图2。
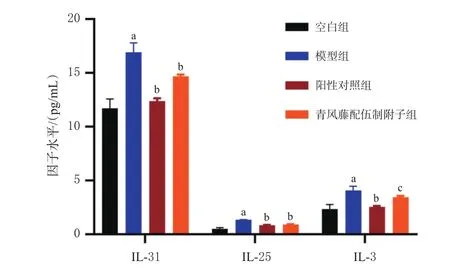
图2 各组大鼠血清中炎症因子水平的检测结果(±s,n=10)
与空白组比较,模型组大鼠血清中RANKL、RANK水平均显著升高,OPG水平显著下降(P<0.01);与模型组比较,阳性对照组和青风藤配伍制附子组大鼠血清中的RANKL、RANK水平均显著下降,OPG水平均显著升高(P<0.01或P<0.05)。结果见图3。
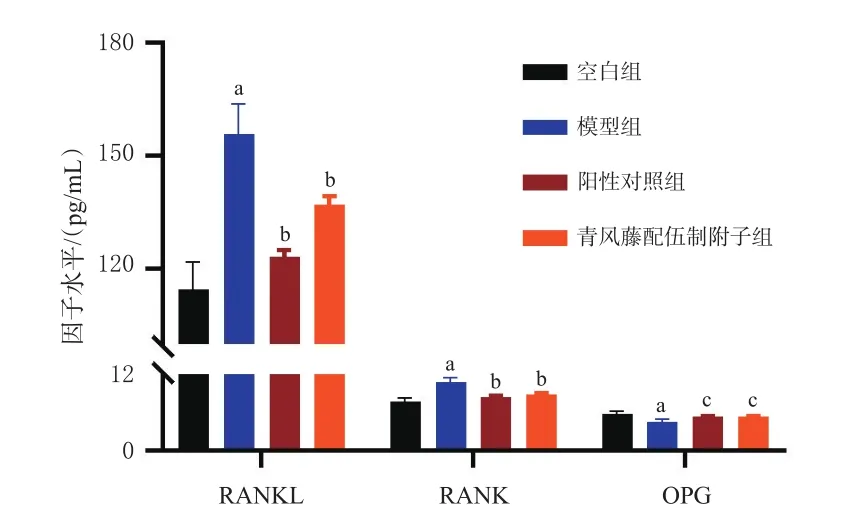
图3 各组大鼠血清中趋化因子水平的检测结果(±s,n=10)
3.6 青风藤配伍制附子对RA模型大鼠踝关节病理学的影响
显微镜下可见,空白组大鼠踝关节结构清晰,排列平整,关节腔中未见炎症细胞,软骨关节呈粉红色,骨质正常;模型组大鼠踝关节有大面积炎症细胞浸润,关节间隙狭窄,结缔组织、滑膜细胞增生,关节软骨结构破坏严重;阳性对照组大鼠踝关节组织可见少量炎症细胞,但关节结构正常;青风藤配伍制附子组大鼠踝关节腔中有少量炎症细胞零散分布,轻度增生,关节结构正常。显微图见图4。
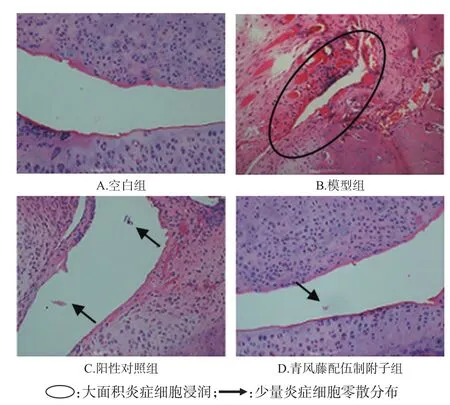
图4 各组大鼠踝关节病理学显微图(×200)
3.7 青风藤配伍制附子对RA模型大鼠踝关节滑膜组织中趋化因子表达的影响
与空白组比较,模型组大鼠后足踝关节滑膜组织中RANKL、RANK的光密度显著升高,OPG的光密度显著下降(P<0.01);与模型组比较,阳性对照组与青风藤配伍制附子中RANKL、RANK的光密度显著下降,OPG的光密度显著升高(P<0.01)。结果见图5、图6。
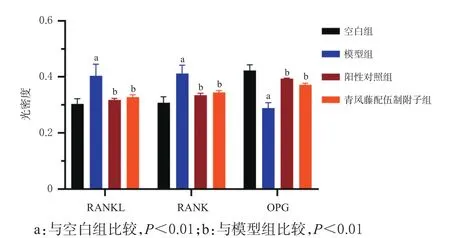
图5 各组大鼠踝关节滑膜组织中趋化因子表达的光密度检测结果(±s,n=10)
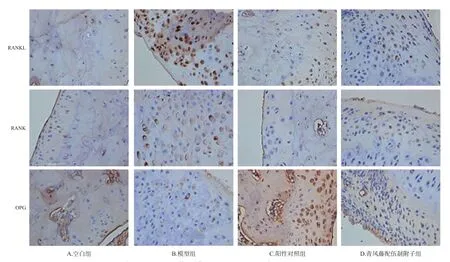
图6 各组大鼠踝关节滑膜组织中趋化因子表达的显微图(×200)
4 讨论
青风藤与制附子是中医药临床治疗RA的常用药对。青风藤味苦、辛,性平,苦以燥湿,辛以祛风,使风湿去、经络通、气血畅而痹痛止;制附子味辛、甘,性大热,辛以散邪,大热逐寒,温燥祛湿,使寒湿去、经络通、通则痛止。青风藤无制附子相配则逐寒无力,制附子无青风藤相伍则功专入肾回阳。青风藤配伍制附子“相须”为用,使祛风散寒、除湿止痛之力大大增强。现代天然药物化学和药理学研究表明,青风藤抗RA的主要药效组分是青藤碱,制附子抗RA的主要药效组分是制附子总生物碱[10-11]。有研究表明,青风藤与制附子、青藤碱与制附子总生物碱均具有抗RA和免疫调节作用[12]。
RA作为一种自身免疫性疾病,体内炎症因子失衡是其关键病理指征。在众多炎症因子中,TNF-α、IL-1β、IL-6等指标已被广泛证实在RA模型大鼠血液中显著升高[13]。本研究以非典型炎性因子(如IL-3、IL-25、IL-31)为研究对象,探讨其在RA模型大鼠体内的变化特点与规律。IL-3由机体T细胞刺激活化产生,降低IL-3的表达可阻止关节炎的发生发展[14]。IL-25主要由活化的2型辅助性T细胞(type 2 helper T cells,Th2)产生,可刺激IL-6、IL-8、粒细胞集落刺激因子等参与免疫炎症反应[15],还可直接促进IL-4、IL-9、IL-13等分泌,加重关节损伤[16]。IL-31由Th2、单核巨噬细胞等活化产生,可诱导Th17活化,间接促进IL-8、基质金属蛋白酶表达,使滑膜炎症状态持续、骨破坏加速[17]。IL-31还可直接促进TNF-α、IL-6的分泌,诱导关节炎发病[18]。以上研究证明,IL-3、IL-25、IL-31通过直接或间接途径参与了RA的进程。有研究表明,炎症因子失衡介导的RA是依赖于RANKL/RANK/OPG信号通路完成的[19]。RANKL/RANK/OPG是成骨细胞与破骨细胞之间的重要信号通路:生理条件下,破骨细胞的骨吸收与成骨细胞的骨形成通过RANKL/RANK/OPG达成动态平衡,维持正常的骨代谢;病理状态下,炎症因子的大量表达能激活RANKL/RANK/OPG通路,使破骨细胞前体细胞过度分化为破骨细胞,从而引起骨与关节软骨破坏[20]。
本研究发现,RA模型大鼠RANK与RANKL的表达较空白组显著增加,而OPG表达显著下降,RANKL与OPG间的平衡被打破,促使破骨细胞增加,造成骨损伤,这可能是RA形成的关键原因。结合模型组大鼠血清炎症因子异常增加的特点推测,造模后,与空白组相比,模型组大鼠体内炎症因子异常增加,炎症轴失衡,导致RANKL/RANK/OPG通路激活,骨代谢平衡被打破,破骨细胞增殖,最终诱导了RA的发生。青风藤配伍制附子组与模型组比较发现,青风藤配伍制附子可有效改善RA模型大鼠的精神状态、体质量及足肿胀度,明显减少滑膜关节内炎性细胞的浸润,保持关节内部结构的完整,维持破骨细胞与成骨细胞骨代谢平衡。
综上所述,青风藤配伍制附子能通过抑制炎症反应、减少炎症因子的释放,抑制RANKL/RANK/OPG通路,从而抑制破骨细胞过度增殖,恢复骨代谢平衡,进而起到保护骨关节、治疗RA的作用。

