不同晶体类型磷酸铁的制备及电化学性能的研究进展
李立平,李煜乾
(广东光华科技股份有限公司,广东 汕头 515000)
磷酸铁(FePO4)又称为正磷酸铁[1],密度为2.74g·cm-3,松装密度0.7~1.0g·cm-3,振实密度1.1~1.6g·cm-3,在自然界中以蓝铁矿的形式存在,常为带2 个结晶水的FePO4·2H2O,是一种近似白色、粉红色或淡黄色的粉末。FePO4最初主要应用在陶瓷玻璃、防锈颜料、食品添加剂等领域[2-3]。后续研究发现,其具有独特的离子交换能力、催化特性和电学性能[4-5],因此作为LiFePO4正极材料的前驱体,广泛应用在锂离子电池领域。
从晶体类型看,除无定形结构外,FePO4晶相还包括异磷铁锰矿[6]、α-石英晶型[7]、单斜[8]、正交[9]等(表1)。根据已有的文献报道,异磷铁锰矿FePO4属于亚稳态,基本只在LiFePO4的充电过程中脱Li 而生成,其结构与LiFePO4相似[10],均为正交晶系,空间点群为Pnma。α-石英晶型FePO4属于稳定结构,为三方晶系,空间群为P3121,在一定的高温条件下可实现从a 到b 的相转变,空间群转化为P622[11]。含水相的FePO4·2H2O 主要有无定形、单斜结构和正交结构,单斜和正交结构的空间群分别为P21/n 和Pbca,同样属于亚稳结构。所有亚稳态结构在高温下均可转变成α-石英结构,因此,α-石英晶型的热力学稳定,但电化学性能最不活跃。

表1 FePO4/ FePO4·2H2O 的晶胞参数和性能
迄今为止,FePO4的制备方法主要有溶胶-凝胶法、水热法、液相沉淀法、微波法等[12-14]。根据Fe元素价态的不同,FePO4的制备方法又可分为2 种:1)在酸性溶液体系中,水溶性的Fe2+盐与PO43-盐反应,经氧化形成Fe(H2PO4)3,再调节pH 至1.5~2.0,生成难溶性的FePO4;2)水溶性的Fe3+盐与H3PO4反应,经调节pH,形成FePO4沉淀。体系浓度、pH 值、反应温度、反应时间等工艺参数,均会影响FePO4的晶型和粒度,最终会影响LiFePO4正极材料的电化学性能。因此,本文简要归纳了不同晶型FePO4的制备方法和电化学性能,以期为进一步制备特定晶型和形貌的FePO4,以及电化学性能优异的LiFePO4材料的研究应用,提供基础理论和技术性指导。
1 合成方法
α-石英结构FePO4的合成方法较多,通常由无定形或结晶态的FePO4·2H2O 在高温下脱去结晶水而获得。本文主要介绍异磷铁锰矿、无定形、单斜和正交晶型的制备方法。
1.1 异磷铁锰矿FePO4
基于橄榄石型的LiFePO4具有较强的结构稳定性,经化学/电化学原位氧化并选择性脱Li,可得到正交晶系的异磷铁锰矿FePO4[15-24]。该晶型属于亚稳结构,无法用Fe 盐和P 盐直接制备得到。Burba 等人在惰性气氛下,用含Br2的乙腈溶液浸出LiFePO4,实现Li 的部分或完全脱去,从而得到异磷铁锰矿。Marx 等人先采用水热法制备得到LiFePO4(OH)粉末,再将LiFePO4(OH)浸泡在Li+的HNO3溶液中(H+/Li+≈4),控制体系温度为60℃,反应7d后得到FePO4。Zhang等人将化学计量过量0.05倍的Na2S2O8与废旧LiFePO4正极粉发生原位氧化还原反应,得到相应的Li2SO4与FePO4,XRD 谱图与异磷铁锰矿的标准卡片PDF#-37-0478 一致。反应式如式(1)所示:

1.2 无定形FePO4·2H2O
无定形FePO4·2H2O 处于高能态,自由能较大,属于热力学不稳定构型,在制备过程中易受到温度、时间、体系pH 等条件的影响,并转晶为稳定构型。通常可采用均相沉淀法或快速沉淀法制备得到无定形FePO4·2H2O[25-30],反应式如式(2)或式(3)所示:
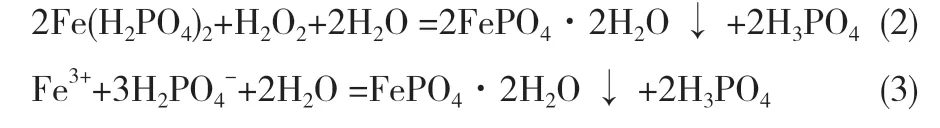
张震等人采用控制结晶法工艺,以Fe(NO3)3·9H2O和H3PO4为原料,50℃下用NH3·H2O 调节pH 值至2.0,沉淀得到无定形FePO4·2H2O。许昕等人以FeSO4·7H2O 为铁源,H3PO4为磷源,H2O2或氧气为氧化剂,采用液相氧化沉淀法制备了多种晶型的FePO4·2H2O。其中,在低温条件下可得到不定形的FePO4·2H2O。董虹分别采用正加沉淀法和反加沉淀工艺,制备了无定形FePO4·2H2O。以Fe(NO3)3·9H2O 和NaH2PO4·2H2O 为原料,高温反应5.0h,得到白色沉淀,该沉淀易溶于浓盐酸中。马毅先用1.5 mol·L-1的HNO3溶液溶解磷铁渣,再在60℃下用NH3·H2O 调整体系pH 值至2.0,沉淀得到非晶态FePO4·2H2O。
1.3 单斜晶型FePO4·2H2O[31-41]
单斜FePO4·2H2O 同样为亚稳晶型。Song 等人采用水热法制备了单斜晶型的FePO4·2H2O。反应原料FeCl2、H3PO4置于反应釜中,于145~170℃下反应,时间超过8.0h,可得到结晶度高的目标产物。张军等人以提纯后的FeSO4·7H2O 和NH4H2PO4为原料,加入过量的H2O2后析出白色沉淀,调节pH值为1~2 并引入H3PO4,90℃下陈化结晶4.0h,即得到纯相的FePO4·2H2O,产物属单斜晶系。唐涛以FeSO4·7H2O 为铁源,H3PO4为磷源,H2O2或氧气为氧化剂,在90~95℃下氧化沉淀出单斜结构的FePO4·2H2O。
由于无定形态与结晶态结构之间存在自由能差,因此可以通过无定形结构进行晶型转化,以获得结晶态。Lou 等人将FeSO4·7H2O 与(NH4)2HPO4在H2O2的作用下,氧化生成无定形FePO4·2H2O沉淀,经固液分离和洗涤后,沉淀转移至H3PO4溶液中,85~100℃下转晶为单斜晶系的FePO4·2H2O,同时脱除夹带的SO42-等阴离子。孙少先将1.5M的FeSO4·7H2O 与H3PO4溶液混合,并用一定量的H2SO4酸化后,加入过量的H2O2,氧化沉淀生成FePO4·2H2O,再转移至反应釜中,90~95℃下陈化2.0h,无定形结构即转化为单斜晶型。
1.4 正交晶型FePO4·2H2O
与单斜晶型相比,正交晶型FePO4·2H2O 的稳定性较高。Song 等人研究发现,反应时间和体系pH 对FePO4·2H2O的晶型具有选择性。将反应原料FeCl2、H3PO4置于145~170℃的反应釜中,调节溶液pH 至0.57,反应时间短于8.0h,可得到正交晶型的FePO4·2H2O 和少量单斜晶型的FePO4·2H2O。唐涛以还原Fe 粉为Fe 源,经H3PO4溶解制备了Fe(H2PO4)2,高温下经H2O2液相氧化沉淀,即得到正交结构的结晶态FePO4·2H2O。张伟伟[42]用HNO3溶解磷铁并控制Fe3+>7.5g·L-1,以H3PO4为磷源,调节体系pH 值<0.9,80℃下微波消解2.0h,得到结晶度高的正交晶系。于克生等人[43]以FeSO4·7H2O 为铁源,H3PO4为磷源,设置阴极室和阳极室的反应液温度均为80℃,电流密度15mA·cm-2,电解10.0h,合成了正交晶系FePO4·2H2O。
由于正交晶型FePO4·2H2O 的热力学稳定性高于单斜晶系,因此在一定的条件下,同样可以通过晶相转变得到正交晶型的FePO4·2H2O。Reale等人[44]以FeCl3·6H2O 与H3PO4为原料,采用液相沉淀法制备了不同的FePO4·2H2O。常温下控制pH 值为0~1,得到单斜晶体,pH 提高到1~2,可得到单斜和正交混合产物,再进一步提高pH 到3~4,单斜晶体全部转化为正交晶系。Tananka 等人[45]以FeCl3与C6H5PO4H2为原料,控制体系pH值为6.0,温度85℃,陈化72h,先得到无定形的FePO4·2H2O,继续陈化到96h,无定形结构转化为单斜晶系,陈化120h 后最终转化为正交晶系。
2 电化学性能
前驱体FePO4的结晶度、粒度、形貌等因素,会影响LiFePO4正极材料的电化学性能,合理的晶体结构有利于Li+的嵌入/脱嵌。根据已有的研究报道,越稳定的结构,其材料的电化学活性越低,因此,各种晶型的FePO4电化学性能优异性顺序为:无定形~异磷铁锰矿>正交晶系>单斜晶系>α-石英晶型[46-49]。其中,在八面体环境中,无定形和异磷铁锰矿的Fe 原子与O 原子的配位数均为6,这种配位方式保证了Fe3+/Fe2+对的稳定性,避免了充放电过程中因O 原子重组而发生失活。单斜、正交和α-石英晶型的Fe 原子,在四面体的配位数均为4,这种配位方式会阻碍Li+的有效嵌入与脱出。需要一提的是,与α-石英晶型不同,单斜和正交结构可以形成六边形的Li+通道,因此,两者的电化学活性高于α-石英晶型。
Masquelier 等人[50]探讨了无定形FePO4·2H2O与α-石英晶型FePO4的电化学性能。结果表明,无定形FePO4·2H2O 的放电比容量高于α-石英晶型,结构中的结晶水更有利于提高电化学性能,原因可能是无定形FePO4·2H2O 具有较多的空位,有利于Li+的快速嵌入与脱出。FePO4·2H2O 转变为晶态FePO4后,无法提供有效的Li+离子扩散途径,从而表现出一定的电化学惰性[51]。徐硕炯等人[52]将无定形的FePO4·2H2O 分别在380、460、550 和650℃下煅烧并进行充放电测试。0.1C 倍率下循环20 次后,各样品的放电比容量依次为126.4、129.3、136.8 和121.6mA·h·g-1,放电比容量呈现先增加后减少的趋势。作者认为,380℃下煅烧的样品残留有结晶水,因此电化学性能偏低;650℃煅烧的样品,粒度有所增大,因此电化学活性低于无定形结构。严鹏等人[53]采用非晶态的FePO4·2H2O,分别在350、400、450 和500℃下脱去结晶水,制备了LiFe-PO4/C 正极材料。结果表明,0.1C 倍率下材料的首次放电比容量同样呈下降趋势,分别为115.0、99.5、82.5、63.5 和41.0mA·h·g-1。作者认为,随着焙烧温度升高,FePO4由无定相逐渐转变成晶体相,并伴随有颗粒的长大,这阻碍了Li+的传输。同时,虽然结晶型的FePO4热力学稳定,但电化学性能不活泼,处于电化学惰性状态。
董虹比较了无定形和单斜FePO4·2H2O 的电化学性能。无定形结构及制备的LiFePO4/C 材料其振实密度分别为0.50g·cm-3和0.81g·cm-3,0.1C 倍率下的首次放电比容量为159.0mA·h·g-1,库仑效率为99.77%,3.0C 倍率下的放电比容量为122.3mA·h·g-1。单斜及其制备的LiFePO4/C 材料的振实密度,分别为0.95g·cm-3和1.26g·cm-3,0.1C 倍率下的首次放电比容量为135.0mA·h·g-1,库仑效率为94.60%,3.0C 倍率下的放电比容量仅为84.4mA·h·g-1。尽管无定形FePO4·2H2O 的电化学性能较佳,但振实密度低,不适用于实际生产应用。袁静楠[54]分别采用无定形和单斜晶型的FePO4·nH2O,高温固相法合成了LiFePO4/C 材料。在含碳量相同的条件下,无定形合成的LiFePO4/C材料,其首次放电比容量高于单斜晶型。作者认为前驱体的颗粒尺寸和形貌对LiFePO4/C 材料造成了一定的影响。韩梦莹[55]采用电解法和共沉淀法制备了无定形和单斜FePO4·2H2O。结果表明,采用无定形结构制备的LiFePO4/C 材料,性能优于单斜晶系。0.1C 倍率下,采用电解法制备的LiFePO4/C正极材料,放电比容量为150.2mA·h·g-1,库仑效率为96.6%,充放电平台为3.5V,循环20 次后容量保持率为96%;采用共沉淀法制备的正极材料,0.1C倍率下的放电比容量为150.1mA·h·g-1,库仑效率为93.1%,充放电平台为3.3~3.4V,循环20 次后容量保持率为99%。
Song 等人比较了分别采用单斜和正交晶系FePO4·2H2O 制备的LiFePO4材料的电化学性能。电流密度为0.2×10-3A·cm-2时,正交晶系的首次充放电比容量为84mA·h·g-1,单斜晶系的首次充放电比容量为45mA·h·g-1,正交晶系的电化学活性显著高于单斜晶系。唐涛等人分别以单斜和正交晶系的FePO4·2H2O 为原料,高温固相法合成了LiFePO4/C 正极材料。结果表明,0.2C 倍率下,单斜晶系的首次充放电比容量,分别为169.3mA·h·g-1和153.7mA·h·g-1,库仑效率为90.8%;1C 倍率下100 次循环后,容量保持率为90.9%。正交结构的首次充电比容量十分接近理论比容量170mA·h·g-1,首次放电的比容量大于160mA·h·g-1,库仑效率大于95.0%,经过100 次循环后容量保持率约为93.0%。于克生等人采用电解法和液相氧化法,分别制备了正交、单斜2 种晶型的FePO4·2H2O 以及相应的LiFePO4/C正极材料。结果表明,0.2C倍率下,正交晶系制备的LiFePO4/C,其充电电压为3.5268V,放电电压为3.3374V,放电容量为147.7mA·h·g-1;单斜晶系制备的LiFePO4/C,其充电电压为3.4815V,放电电压为3.3637V,放电容量为154.1mA·h·g-1。相对于单斜晶系,正交晶系的充电电压较高,放电电压较低。
3 不同制备方法的比较
各种晶型FePO4的制备条件见表2。

表2 各种晶型FePO4 制备条件一览表
4 结语
本文总结了近年来不同晶体类型的FePO4的制备方法,包括异磷铁锰矿FePO4,以及无定形、单斜和正交晶系的FePO4·2H2O,和α-石英晶系FePO4,并比较了各种晶型的电化学性能。其中,异磷铁锰矿只能在LiFePO4的脱Li 过程中得到。无定形、单斜和正交FePO4·2H2O 可由铁盐与磷酸盐盐制备获得。α-石英晶系FePO4可由各种晶型的FePO4·2H2O 经高温煅烧制备。各种晶型的电化学性能的优异性顺序为:异磷铁锰矿~无定形>正交>单斜>α-石英晶系。用无定形FePO4·2H2O制备电化学性能优异的LiFePO4材料,将具有较广阔的应用前景。

