空腹C肽与肥胖儿童非酒精性脂肪性肝病的相关性
曹佳佳, 张俊峰, 聂文建, 叶 青
(浙江大学医学院附属儿童医院实验检验中心 国家儿童健康与疾病临床医学研究中心,浙江 杭州 310052)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是慢性肝病的最常见原因,儿童的发病率约为3%,肥胖儿童的发病率高达53%[1]。由于生活方式和饮食方式的改变,目前NAFLD的发病率逐步升高[2]。肥胖、胰岛素抵抗等代谢功能障碍与NAFLD的发生、发展密切相关[3],胰岛素抵抗通常表现为胰岛素水平升高。C肽和胰岛素以等摩尔量产生和释放,因此C肽可用于评估内源性胰岛素分泌情况。有研究结果显示,C肽还与许多NAFLD危险因素,如心血管疾病、代谢综合征有关[4]。本研究拟探讨C肽与肥胖儿童NAFLD发生的相关性。
1 材料和方法
1.1 研究对象
选取2018年9月—2019年9月浙江大学医学院附属儿童医院住院的肥胖患儿330例,其中211例患儿经腹部超声确诊为NAFLD[NAFLD组;男160例、女51例,年龄(11.52±2.42)岁],另外119例单纯肥胖儿童作为对照组[男78例、女41例,年龄(10.44±2.62)岁]。NAFLD诊断依据2010年中华医学会肝脏病学分会制定的诊断指南[5],根据腹部超声结果评估是否存在肝脂肪变性及变性程度:(1)弥漫性高回声纹理(亮肝);(2)与肾脏相比,肝脏回声质地增加;(3)深光束衰减;(4)血管模糊(门静脉和肝静脉缺乏正常的回声壁)。排除标准:(1)其他肝脏疾病,如药物性肝炎、病毒性肝炎、自身免疫性肝炎、肝豆状核变性、血吸虫病、肝硬化;(2)慢性疾病,如心脏病、肾脏疾病、癫痫、肺结核、肿瘤和其他可能影响肝功能的疾病;(3)肝脂肪变性的超声检查结果缺失或实验室检查、体格检查的数据丢失。本研究经浙江大学医学院附属儿童医院伦理委员会审核批准,所有患儿家长均知情同意。
1.2 方法
对所有患儿进行体格检查,测量身高、腰围、体质量、收缩压,计算体质量指数(body mass index,BMI)。
采集所有患儿空腹8 h的静脉血3 mL,1 274×g,离心10 min,分离血清,在8 h内完成所有项目的检测。
采用AU5800全自动生化分析仪(美国贝克曼库尔特公司)及配套试剂检测总蛋白(total protein,TP)、白蛋白(albumin,Alb)、γ-谷氨酰基转移酶(gamma glutamyltransferase,GGT)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、肌酐(creatinine,Cr)、空腹血糖(fasting blood glucose,FBG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)。采用BC-5390全自动血液分析仪(深圳迈瑞公司)及配套试剂检测白细胞(white blood cell,WBC)计数、血小板(platelet,PLT)计数、血红蛋白(hemoglobin,Hb)水平。采用cobas e411电化学发光免疫分析仪(瑞士罗氏公司)及配套试剂检测空腹C肽水平。采用Premier Hb 9210糖化血红蛋白检测仪(美国Primus公司)检测糖化血红蛋白(glycated hemoglobin A1c,HbA1c)。采用IMMULITE 2000 XPi 全自动化学发光免疫分析仪(德国西门子公司)及配套试剂检测空腹胰岛素(fasting insulin,FINS),计算胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR):HOMA-IR=[FINS(μIU/mL)×FBG(mmol/L)]/ 22.5。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。呈正态分布的计量资料以x±s表示,2个组之间比较采用独立样本t检验。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Mann-WhitneyU检验。以性别、年龄、血压、BMI为协变量,采用多因素Logistic回归分析对所有患儿进行倾向性评分,设置卡钳值为0.02,按1∶1比例匹配,无代替,构成82对配对,匹配完成后再分析空腹C肽与NAFLD的关系。采用多元逐步Logistic回归分析评估NAFLD的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 NAFLD组与对照组各项指标比较
采用倾向性评分匹配后,NAFLD组ALT、AST、GGT、TP、空腹C肽、FINS、HOMAIR显著高于对照组(P<0.05),其他各项指标2个组之间差异均无统计学意义(P>0.05)。NAFLD组与对照组匹配前各项指标的比较结果见表1,匹配后各项指标的比较结果见表2。
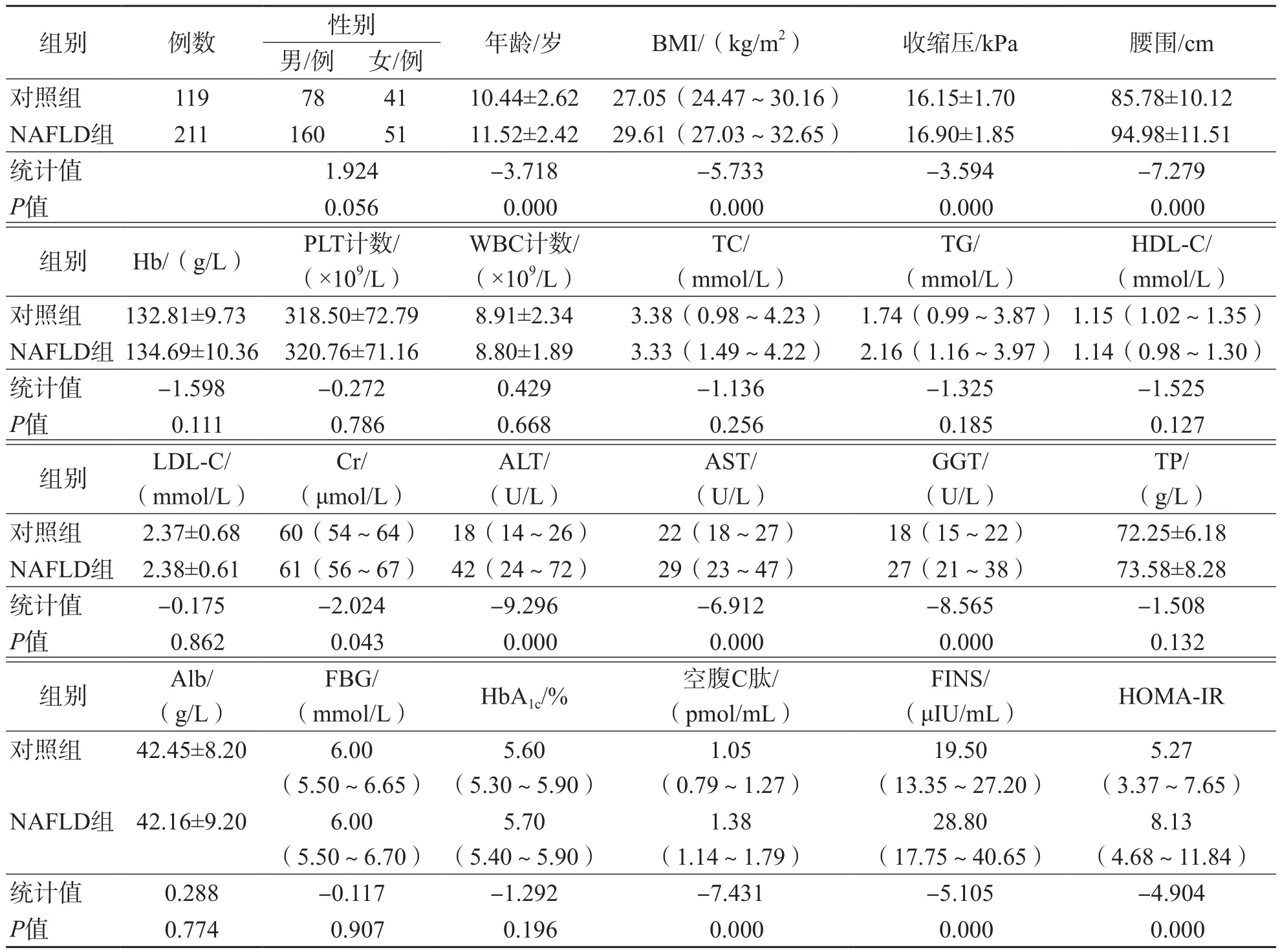
表1 NAFLD组与对照组匹配前各项指标的比较
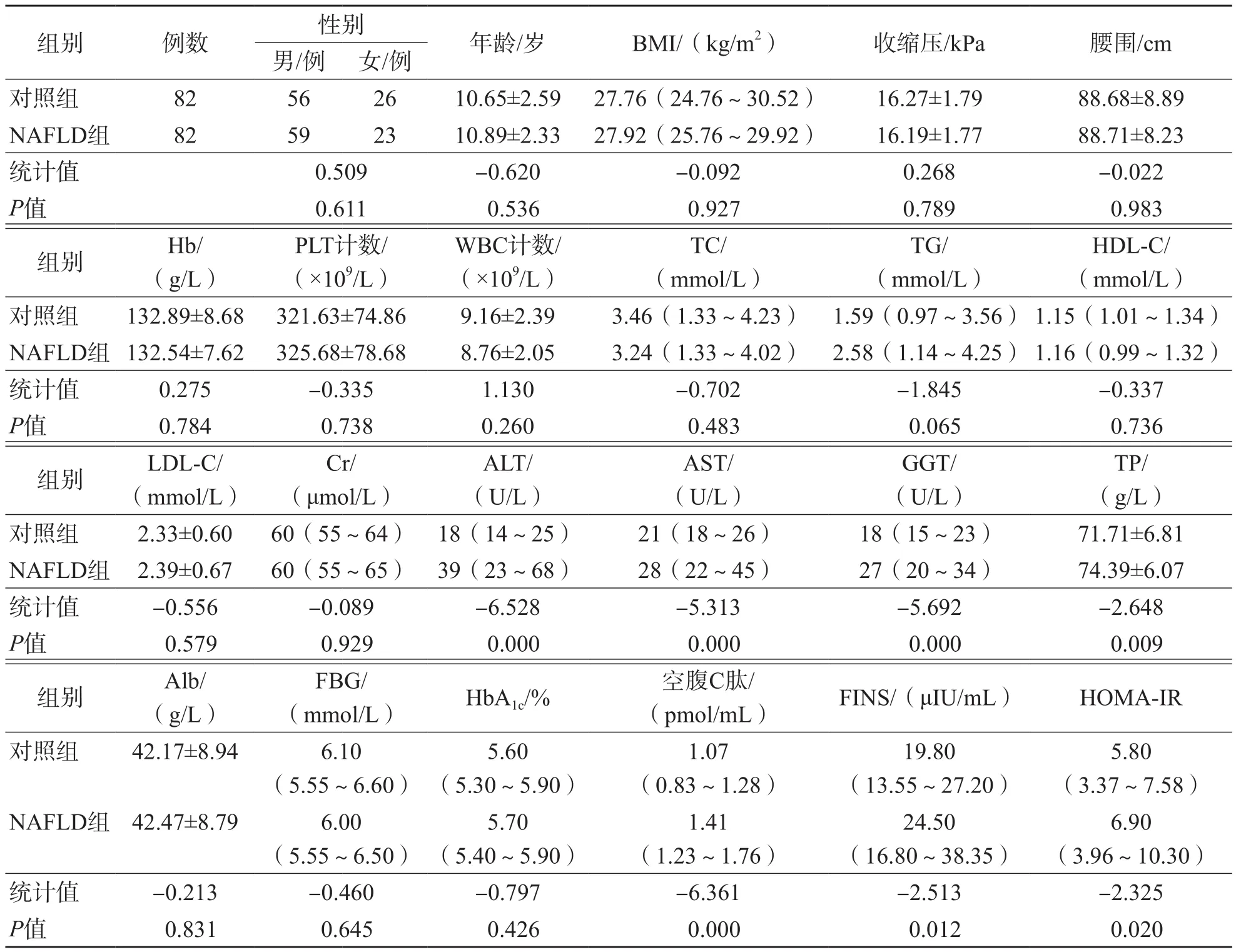
表2 NAFLD组与对照组匹配后各项指标的比较
2.2 NAFLD的危险因素分析
多元逐步Logistic回归分析结果显示,ALT和空腹C肽是NAFLD发生的危险因素[比值比(odds ratio,OR)值分别为1.057、3.307,95%可信区间(confidence interval,CI)分别为1.036~1.078、1.439~7.602]。见表3。

表3 NAFLD危险因素分析
按空腹C肽的三分位数将所有配对患儿分为C肽≤1.06 pmol/mL组、C肽1.07~1.41 pmol/mL组、C肽≥1.42 pmol/mL组。通过校正变量排除其他变量对研究的影响。模型1:校正年龄、性别、BMI、腰围、收缩压。模型2:在模型1的基础上校正ALT、Cr、TG、HDL-C、HOMA-IR和WBC计数。2个模型均以C肽≤1.06 pmol/mL组为参考计算OR值。校正不同变量后,结果显示,C肽≥1.42 pmol/mL是NAFLD发生的危险因素(OR=4.635,95%CI为1.610~13.346)。见表4。
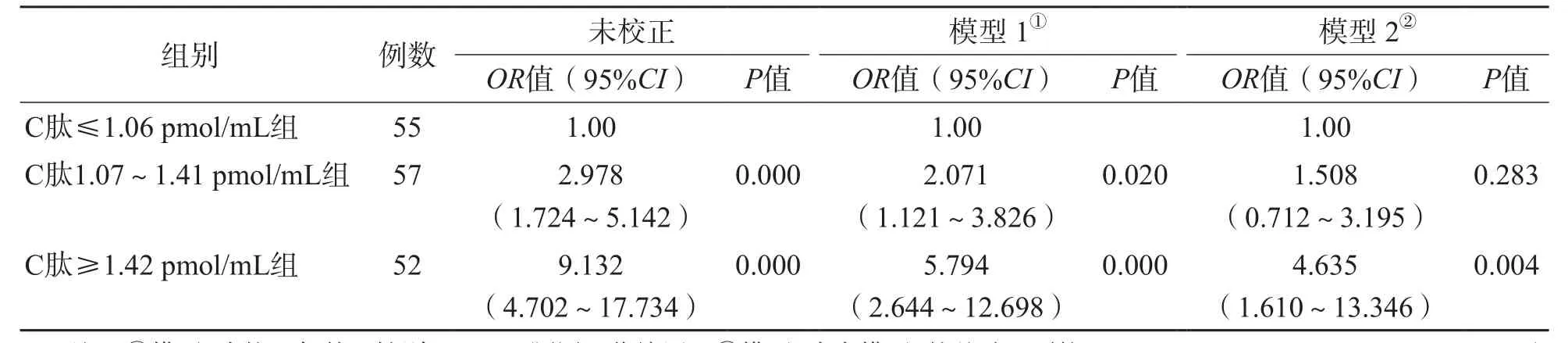
表4 C肽与NAFLD的相关性分析
3 讨论
肥胖和胰岛素抵抗被认为是NAFLD的危险因素,NAFLD的确切发病机制尚不明确,普遍的认知是“二次打击”经典假说,以胰岛素抵抗引起肝脏脂质沉积,形成单纯性肝脂肪变性为第1次打击;以氧化应激和脂质过氧化等引发线粒体功能障碍,导致肝细胞损伤以及纤维化为第2次打击[6]。在儿童中,NAFLD通常与肥胖有关,部分原因是过度饮食和果糖摄入增加。肥胖儿童由于过量摄入食物,增加了肝脏脂肪负荷,使胰岛素受体磷酸化受到干扰,从而加剧胰岛素抵抗。胰岛素抵抗可能是成人和儿童NAFLD发生的关键机制,其与代偿性高胰岛素血症密切相关,会破坏游离脂肪酸和脂质过氧化的线粒体氧化过程,这一系列反应会导致有毒脂质代谢产物的形成和积累,进而发生氧化应激和肝细胞损伤[7]。
果糖是一种食品甜味添加剂,可诱导脂肪合成酶的生成,增加肝细胞脂质沉积,因此富含果糖的高热量饮食会加剧肝脏脂肪变性和肝损伤[8]。果糖虽然不会使胰岛素水平急剧升高,但最终会导致血糖、胰岛素水平升高及胰岛素抵抗增强,且高果糖饮食被发现与肝细胞凋亡及肝纤维化密切相关[9]。与成人相比,儿童NAFLD的病情更加严重,约有15%的NAFLD患儿在确诊时肝脏已出现3期或4期纤维化[10]。
本研究多元逐步Logistic回归分析结果显示,ALT和空腹C肽是NAFLD的危险因素(OR值分别为1.057、3.307,95%CI分别为1.036~1.078、1.439~7.602)。ALT和AST升高与肝细胞损伤有关,NAFLD患者的ALT水平通常较高[11]。本研究发现,与对照组相比,NAFLD组具有更高的FINS和空腹C肽水平。C肽是胰岛素原裂解成胰岛素时产生的多肽,与等摩尔量的胰岛素同时被释放入血液,尽管胰岛素和C肽是以等摩尔量分泌,但两者的代谢存在明显差异。肝脏是胰岛素清除的主要场所,而C肽主要通过肾脏清除,且C肽半衰期较长。血中的胰岛素水平可以出现较大幅度的变化,而C肽水平很稳定,因此C肽常被用来作为评估内源性胰岛素释放的指标。有研究发现,胰岛素抵抗是NAFLD的危险因素[12]。因此,本研究将HOMA-IR纳入混杂因素进行校正,结果显示,空腹C肽≥1.42 pmol/mL是NAFLD发生的危险因素(OR=4.635,95%CI为1.610~13.346)。
本研究尚有不足之处:(1)本研究为单中心回顾性分析,样本量较小,结果可能有一定的偏移,虽然本研究采用倾向性评分匹配减轻了偏移,平衡了已知混杂因素的影响,但仍可能存在某些未知的混杂变量对结果造成影响;(2)本研究数据为单一性来源,无法反映其他地区的情况;(3)本研究未对NAFLD患儿进行肝脏病变严重程度分级,因此无法说明C肽与NAFLD严重程度的关系,后续将扩大样本量,进一步研究。
综上所述,空腹C肽可作为肥胖儿童NAFLD发生的危险因素。C肽检测相对简单,且不受外源性胰岛素制剂的影响。因此,空腹C肽对于肥胖儿童NAFLD的早期诊断有着重要的临床意义。

